毛竹PheERF5基因克隆及生物信息学分析
胡俊东,吴惠俐,2,吕 浩-3
(1.湖南省森林植物园,湖南 长沙 410116;2.长株潭城市群森林生态系统国家定位观测研究站,湖南 长沙 410116;3.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
植物整个生命过程中,会遭受各种各样的逆境胁迫影响,主要逆境环境因子如干旱、水涝、高温、低温、盐碱胁迫等均限制着植物的生长、发育、生产力和地理分布,并降低了植物的潜在利用价值。环境胁迫或病原菌侵染会诱导或抑制植物中一系列具有多种功能的基因的响应表达,从而诱导抗逆功能蛋白大量合成,以适应环境或抵御病原菌侵染[1-3]。这些功能蛋白可分为2 类:功能性蛋白和调节性蛋白。转录因子是重要的调节蛋白,在诱导抗逆功能基因表达或功能蛋白合成方面发挥着非常重要的作用。AP2/ERF(APETALA2/ethylene responsive factor)转录因子家族是植物体中较大且较为重要的转录因子家族之一,其至少包含1 个由60~70 个氨基酸残基组成的AP2 保守结构域,这些氨基酸残基在蛋白功能(如胁迫防御功能)决定方面具有重要作用。根据编码蛋白的结构域数量和基因的功能,AP2/ERF 转录因子家族可被分为4 个亚家族:AP2、RAV、DREB 和ERF[4-5]。AP2 亚家族转录因子基因编码2 个AP2保守结构域,在调节生长发育中具有重要功能,如叶片表皮细胞形成、花和胚珠发育、小穗分生组织形成和种子生长。RAV 亚家族转录因子具有1 个AP2 保守结构域和1 个类B3 结构域,在响应乙烯、油菜素类固醇以及生物和非生物胁迫反应中发挥作用,且能调节靶标基因的表达。DREB和ERF 亚家族转录因子由于参与植物抗生物和非生物胁迫而受到广泛关注。DREB 亚家族转录因子通过识别脱水应答元件(dehydration-responsive element,DRE)而在植物抗非生物胁迫中发挥重要作用,DRE 的核心基序为A/GCCGAC[6]。ERF亚家族转录因子通过识别顺式作用元件GCC box(核心基序为AGCCGCC)参与植物响应生物胁迫过程,如病原菌侵染[7]。也有研究报道指出,ERF 亚家族转录因子具有抗非生物胁迫的功能[8-9]。
目前,ERF 亚家族转录因子的功能尚不明确,尤其是其在抗非生物胁迫方面的功能。响应植物生物和非生物胁迫表达的ERF 转录因子被大量报道。比如,小麦Triticum aestiνum的TaERF3基因在高盐和干旱胁迫时上调表达[8];番茄Solanum pimpinellifolium的SpERFs基因响应高盐胁迫而表达[9];苹果Malus baccata的MbERF11基因超表达能提高拟南芥抗低温和抗盐胁迫的能力[3];水稻Oryza satiνa的OsERF101基因可提高水稻幼苗的抗旱性,从而提高其定植率[10];橡胶树Heνea brasiliensis的HbERF1基因为乙烯响应基因和耐旱性基因的正调控子,受脱落酸(ABA)、茉莉酸甲酯(MeJA)、水杨酸(SA)和乙烯(ETH)等激素诱导表达[11];烟草Nicotiana tabacum的Pti4/5/6 转录因子能识别致病相关基因启动子并与其结合,增强烟草的抗病性[12];Tsi1基因在烟草中超表达能提高其抗病原菌侵染和渗透胁迫的能力[1]。转录因子响应逆境胁迫的功能取决于其特殊的氨基酸序列和生物信息结构[6-7],因此,进行ERF 转录因子的氨基酸序列分析和生物信息学分析对预测其功能具有重要作用。
毛竹Phyllostachys edulis是禾本科Gramineae竹亚科Bambusoideae 刚竹属Phyllostachys多年生喜温常绿植物。毛竹原产于中国,其栽培面积大、分布范围广、生长速度快,是中国重要的经济竹种[13-15]。然而,自然界中广泛存在各种非生物胁迫因子(如干旱、低温、高盐、洪水、水淹等)和生物胁迫因子(如病原菌侵染等),不利于毛竹的生长发育,影响了出笋率、竹材材质等,还限制了毛竹的分布范围,严重影响了毛竹的经济和生态价值。然而,关于毛竹AP2/ERF 转录因子家族成员的遗传结构和功能研究多针对DREB 亚家族转录因子[16-17],对于ERF 亚家族转录因子的研究鲜见报道。本研究中从毛竹幼苗叶片中克隆ERF 转录因子基因PheERF5并开展生物信息学分析,旨在为深入研究毛竹ERF 亚家族转录因子成员的抗逆功能和抗逆机制提供参考依据。
1 材料与方法
1.1 植物材料培养
毛竹种子采集地点为广西省桂林市。将毛竹种子置于铺有无菌滤纸的培养皿中暗培养催芽,约2 周后将毛竹实生苗转移至直径为15 cm 的塑料花盆中,栽培基质为蛭石。于光照恒温培养箱中培养,温度为白天25 ℃、夜晚18 ℃,光周期为光16 h、暗8 h,湿度为80%,每周浇1 次Hoagland 营养液。
1.2 PheERF5 基因全长序列克隆
使用Trizol Reagent(Invitrogen 公司)提取毛竹实生苗叶片总RNA,使用反转录试剂盒(Promega公司)合成cDNA 第一链,合成产物置于-20 ℃冰箱中保存备用。根据毛竹基因组数据库中PheERF5基因的CDS 序列,通过引物设计软件Primer 5 设计PCR 特异扩增引物,引物由上海生工生物工程有限公司合成。克隆引物为PheERF5-BamHI-F(5′TAGGATCCATGAATAGCGTGCAGG AAGAA3′)、PheERF5-HindIII-R(5′ATAAGCTT TTAAGCCTCCAGATCGGTGAA3′)。上游引物5′端加BamHI 酶切位点,下游引物5′端加HindIII酶切位点。
通过RT-PCR反应扩增目的基因。PCR扩增反应体系:10 μL 2×PCR 混合缓冲液(Mg2+15 μmol/L)、1 μL 正向引物(10 pmol/L)、1 μL 反向引物(10 pmol/L)、2 μL 模板cDNA、6 μL ddH2O,总体积20 μL。扩增条件:95 ℃预变性5 min,然后94 ℃ 30 s,60 ℃ 40 s,72 ℃ 1 min,共35 个循环,再72 ℃延伸10 min。反应产物经0.8%的琼脂糖凝胶电泳分析后,使用胶回收试剂盒(QIAGEN公司)回收目的产物。将回收的目的DNA 片段连接到pMD18-T 载体上,转化DH5α 大肠杆菌Esherichia coli,经蓝白斑筛选,获得阳性克隆质粒,BamHI 和HindIII 双酶切检测,并送上海生工生物工程有限公司测序。将正确的重组质粒命名为pMD18T-PheERF5。
1.3 PheERF5 蛋白生物信息学分析
使用SMART:Main page 软件在线分析PheERF5蛋白氨基酸序列的保守结构域及其位置,使用Prot-Param 软件在线分析该蛋白的理化性质,使用ProtScale 软件在线分析蛋白的亲疏水性,使用NetPhos 3.1 软件在线分析蛋白磷酸化位点,使用TMHMM Server v.2.0 软件在线分析蛋白跨膜结构域,使用SignalP-5.0 Server 软件在线分析蛋白信号肽,使用wolf-psort、Cell PLoc 2.0 和Softberry(ProtComp 9.0)软件在线分析蛋白亚细胞定位。分别使用SOPMA 和Swiss Model 软件分析PheERF5 蛋白的二级结构和三级结构。使用DNAMAN7.0 软件进行PheERF5 蛋白及其他物种同源蛋白多序列比对,使用MEGA 6.0 软件的邻接法(neighbor-joining,NJ)构建PheERF5 蛋白和水稻AP2/ERF 家族成员蛋白的系统发育进化树。其他物种同源蛋白和水稻AP2/ERF 家族蛋白均从NCBI 数据库下载。
2 结果与分析
2.1 PheERF5 基因的克隆
使用PheERF5-BamHI-F 和PheERF5-HindIII-R引物,通过RT-PCR 反应扩增目的基因,PCR 反应产物的琼脂糖凝胶电泳结果如图1所示。由图1可以看出,EB 显色后,在约1 000 bp 处有1 条清晰的亮带,与目的基因片段大小相符。切胶回收,将回收产物与pMD18-T easy 载体连接,提取阳性克隆质粒,经BamHI 和HindIII 双酶切后得到的片段大小与PCR 产物大小相吻合。
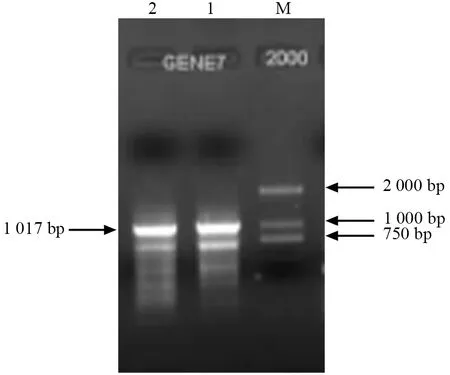
图1 PheERF5 基因PCR 扩增电泳图Fig.1 PCR amplification electrophoresis products of PheERF5 gene
PheERF5基因CDS 区碱基序列及其编码的氨基酸序列如图2所示。由图2可以看出,获得的cDNA 片段长度为1 017 bp,共编码339 个氨基酸,与毛竹基因组数据库中目的基因的长度及氨基酸序列完全符合。
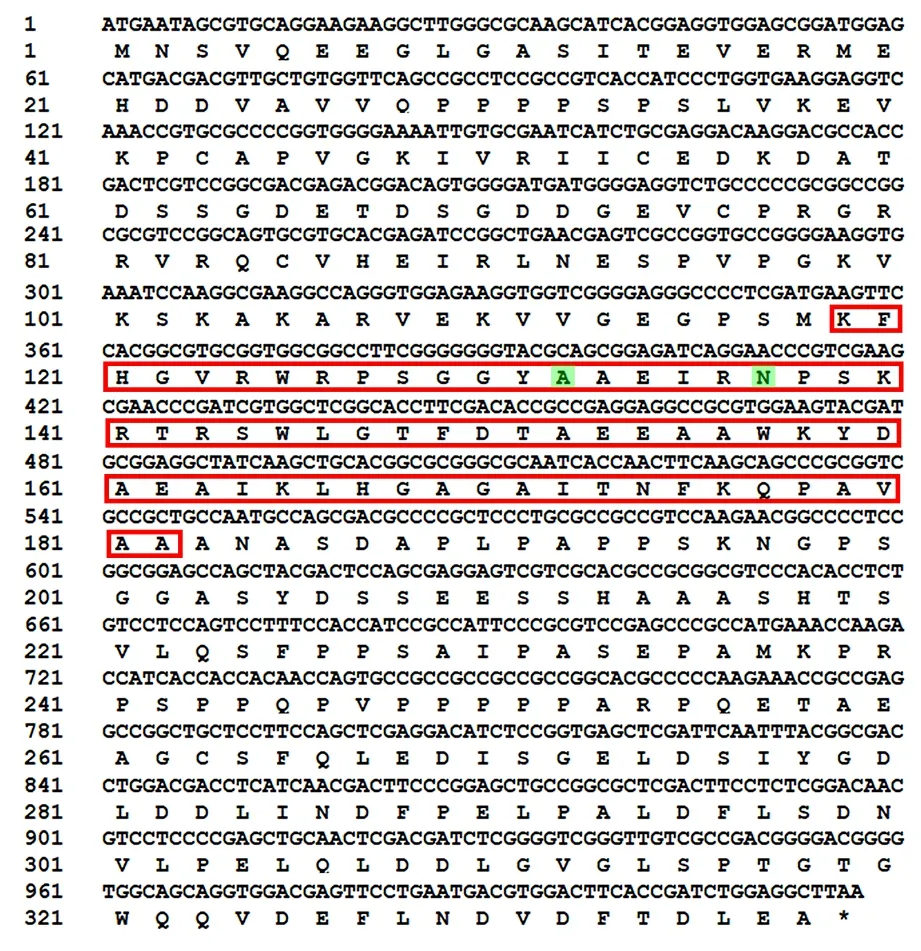
图2 PheERF5 基因CDS 区碱基序列及其编码的氨基酸序列Fig.2 The base sequence and deduced amino acid sequence of PheERF5 CDS region
氨基酸序列分析结果表明,PheERF5 蛋白保守结构域存在1 个AP2 结构域和4 个Low complexity,如图3所示。由图3可以看出,根据位置先后排序各保守结构域分别位于第29~35 位、第60~74 位、第119~182 位、第200~220 位和第239~256 位氨基酸残基处。由于该氨基酸序列具有1 个AP2 保守结构域,由64 个氨基酸残基组成,结构域第14 位和第19 位氨基酸残基分别为丙氨酸(A)和天冬酰胺(N),推测其属于AP2/ERF 转录因子家族的ERF 亚家族,故将其命名为PheERF5基因(PH01001057G0620)。

图3 PheERF5 蛋白保守结构域Fig.3 The conserved domain prediction of PheERF5 protein
2.2 PheERF5 蛋白理化性质
PheERF5 蛋白理化性质分析结果显示,其相对分子质量为35 958.87 Da,分子结构式为C1568H2453N435O517S9,总原子数为4 982,理论等电点为4.58,该蛋白为不稳定蛋白,其不稳定系数为58.58,脂肪族氨基酸指数69.59。带正电荷残基(Arg+Lys)共31 个,带负电荷残基(Asp+Glu)共55 个,表明该蛋白在中性条件下带负电荷。
PheERF5 蛋白亲疏水性预测结果如图4所示。由图4可以看出,PheERF5 蛋白在第140 位氨基酸残基处亲水性最强,亲水系数为-2.756;在第50 位氨基酸残基处疏水性最强,亲水系数为1.733。PheERF5 蛋白序列中疏水性氨基酸残基(分值大于0)占23.89%,亲水性氨基酸残基(分值小于0)占76.11%,总平均亲水性系数-0.533,由此推测PheERF5 蛋白为亲水性蛋白。
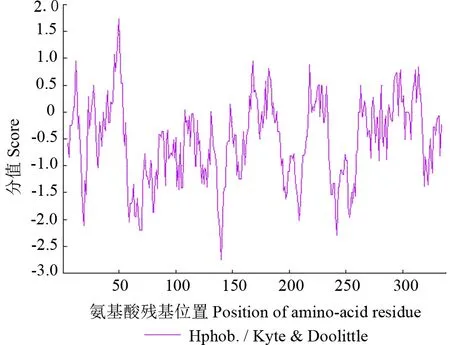
图4 PheERF5 蛋白亲疏水性预测结果Fig.4 Hydrophilicity and hydrophobicity prediction of PheERF5 protein
2.3 PheERF5 蛋白磷酸化位点
PheERF5 蛋白磷酸化位点预测结果如图5所示。由图5可以看出,PheERF5 蛋白链中可能磷酸化且发生分值大于0.5 的氨基酸残基位点有48个,其中苏氨酸磷酸化位点12 个,丝氨酸磷酸化位点322 个,酪氨酸磷酸化位点4 个。PheERF5蛋白链主要磷酸化位点为丝氨酸残基位点,由此推测其生物功能是以通过丝氨酸磷酸化修饰调控为主,以通过苏氨酸磷酸化修饰调控为辅。
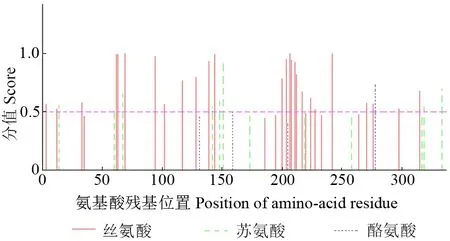
图5 PheERF5 蛋白磷酸化位点预测结果Fig.5 Phosphorylation site prediction of PheERF5 protein
2.4 PheERF5 蛋白跨膜结构与亚细胞定位
PheERF5 蛋白跨膜结构分析结果显示,该蛋白无跨膜结构,属于非跨膜蛋白。PheERF5 蛋白的信号肽预测如图6所示。由图6可以看出,该蛋白存在信号肽的概率仅有0.22%,由此推导出PheERF5 蛋白是非分泌蛋白。Wolf-psort 软件的预测结果表明,PheERF5 蛋白质位于细胞核的得分最高,为13,位于叶绿体和线粒体的得分分别为1 和0 分;CellPLoc 2.0 软件的预测结果表明,PheERF5 蛋白质位于细胞核或细胞质;Softberry软件的预测结果表明,该蛋白位于细胞核。因此,可推测PheERF5 蛋白的亚细胞定位为细胞核。

图6 PheERF5 蛋白信号肽预测结果Fig.6 Prediction of signal peptide of PheERF5 protein
2.5 PheERF5 蛋白二、三级结构
PheERF5 蛋白的二级结构分析结果如图7所示。由图7可以看出,PheERF5 蛋白肽链中含有99 个α-螺旋(29.29%),36 个延伸链(10.65%),15个β-转角(4.44%),188个无规则卷曲(55.62%),据此推测该蛋白的二级结构主要为无规则卷曲。
PheERF5 蛋白的三级结构分析结果如图8所示。由图8可以看出,PheERF5 蛋白质的存在形式为单体蛋白,含有1 个α-螺旋,3 个β-折叠,组分间以β-转角相连。
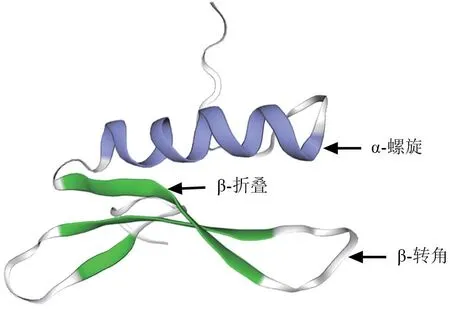
图8 PheERF5 蛋白三级结构预测结果Fig.8 The tertiary structure of PheERF5 protein
2.6 PheERF5 基因同源性比对及系统进化分析
利用NCBI 数据库进行PheERF5基因序列同源性的Blast 比对分析,结果如图9所示。由图9可以看出,PheERF5基因编码的蛋白序列与小米Setaria italica、水稻Oryza satiνa、二穗短柄草Brachypodium distachyon、狗尾草Setaria νiridis、节节麦Aegilops tauschii、大麦Hordeum νulgare、疣粒野生稻Oryza meyeriana、小麦、Dichanthelium oligosanthes、玉米Zea mays高粱Sorghum bicolor的同源性高达84%以上,分别为85%、84%、85%、85%、85%、85%、84%、99%、85%、85%、98%,其氨基酸序列与这些物种的氨基酸序列的一致性达到64.29%。这些氨基酸序列的AP2 保守结构域的同源性较高,共有37个保守氨基酸,分别是2F、4G、5V、6R、8R、9P、11G、13Y、14A、15A、16E、17I、18R、20P、23R、25R、27W、28L、29G、30T、31F、32D、33T、34A、35E、36E、37A、38A、41Y、42D、45A、46I、48L、50G、53A、56N、57F。

图9 PheERF5 蛋白与其他物种同源蛋白AP2 结构域氨基酸序列的多重比对Fig.9 Multiple amino acid sequence alignment of the AP2 domains of PheERF5 protein with homologous proteins of other pecies
将PheERF5 蛋白的氨基酸序列与水稻已知的124 个AP2/ERF 家族转录因子的氨基酸序列构建进化树,结果如图10所示。由图10可以看出,PheERF5基因与水稻基因ERF 亚族B-5 组基因(Os12g41030、Os05g25260、Os03g60120、Os06g06540、Os01g12440和Os01g46870)聚为一支,且与Os12g41030进化关系最近。
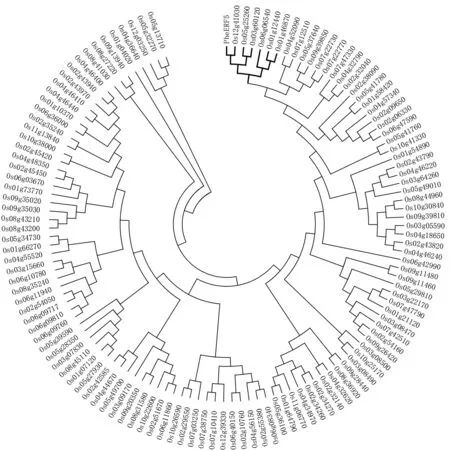
图10 PheERF5 蛋白与水稻中124 个AP2/ERF 家族成员蛋白聚类Fig.10 Cluster analysis of PheERF5 protein from Phyllostachys edulis and 124 AP2/ERF family proteins from Oryza sativa
3 结论与讨论
本研究中从毛竹幼苗叶片中克隆获得了PheERF5基因的cDNA 片段,其序列全长为1 017 bp,编码339 个氨基酸。PheERF5基因编码蛋白为具有1 个AP2 保守结构域、无跨膜结构、无信号肽、定位于细胞核且带负电荷的不稳定的亲水性蛋白。通过NCBI 数据库进行Blast 比对分析,结果表明PheERF5基因编码氨基酸序列与禾本科植物(如小米、水稻、二穗短柄草等)ERF 蛋白氨基酸序列亲缘关系近,其同源性均达到84%以上。通过构建PheERF5 与124 个水稻AP2/ERF 家族成员氨基酸序列系统进化树,分析结果显示,PheERF5与Os12g41030 亲缘关系最近,且与水稻ERF 亚家族B-5 子组成员聚类为一支,这说明PheERF5是典型的ERF 亚家族转录因子。生物信息学分析结果显示,PheERF5 转录因子可能在毛竹抗生物和非生物胁迫过程中发挥着重要的作用。
植物体中ERF 亚家族转录因子是AP2/ERF 家族转录因子较丰富的亚家族,水稻基因组中含有77 个ERF 亚家族成员[7],玉米基因组中含有153个ERF 亚家族成员[18],小麦基因组中含有47 个ERF 亚家族成员[19],毛竹基因组中含有53 个ERF亚家族成员[17],拟南芥基因组中含有65 个ERF亚家族成员[5]。ERF 亚家族参与调控植物生长发育过程,响应生物和非生物环境胁迫[3,20]。比如,水稻OsEBP-89基因在胚乳和维管束韧皮部表达,尤其在茎节和居间分生组织邻近部位高水平表达,表明ERF 转录因子可能参与胚乳细胞和颈部组织淀粉的积累;转基因拟南芥和转基因烟草中超表达ERF 类基因,提高了病原相关蛋白基因的表达量,显著增强了植物对腐生营养型真菌、细菌性叶斑病、烟草花叶病毒等的抗性;在反义品系中,水稻OsERF3负调控降低了褐飞虱雌成虫的采食量、产卵量及初孵若虫的成活率,在过量品系中与之相反,表明OsERF3超表达可调节水稻通过防御昆虫取食而提高对昆虫的抵抗力;在番茄植株体内烟草TERF2基因过量表达,可提高番茄对低温胁迫的耐受性[21-22]。ERF 转录因子参与植物生长发育和胁迫应答的作用机理与其基因结构和蛋白序列特征紧密相连,因此,研究毛竹ERF 亚家族成员的生物信息结构和功能对揭示毛竹生长发育和抗逆机制具有重要的意义。
PheERF5 蛋白的AP2 结构域由63 个氨基酸残基组成,其结构域第14 位氨基酸为丙氨酸(A),这与ERF 亚家族转录因子结构域第14 位特征氨基酸一致,但是,PheERF5 蛋白结构域第19 位氨基酸为天冬酰胺(N),与ERF 亚家族转录因子结构域第19 位特征氨基酸(天冬氨酸D)不一致。这可能与ERF 转录因子AP2 结构域第14 位氨基酸为极度保守氨基酸,而第19 位氨基酸的保守性较低有关[23]。PheERF5基因编码氨基酸磷酸化位点预测结果显示,其存在48 个可能发生磷酸化的氨基酸残基位点。转录因子通过磷酸化调控来诱导或抑制抗逆功能基因的表达,特定氨基酸残基磷酸化可能影响转录因子的核定位、转录活性或与之互作的其他蛋白[12]。所以,PheERF5 转录因子可能通过氨基酸残基磷酸化来响应逆境胁迫,提高毛竹的耐逆性。
ERF 亚家族B-5 子组转录因子也被命名为细胞分裂素反应因子(cytokinin response factors,CRFs),已被证实参与植物抗生物和非生物胁迫过程[24]。比如,Kwon[24]报道,过表达AtCRF2的拟南芥转基因植物显示出加速的叶片衰老表型,极端的AtCRF2过表达在生长早期具有致命性,植物叶片呈现出病态表型。此外,受相容性半营养细菌病原体丁香假单胞菌变种(番茄DC3000)的侵染后,转基因植株比野生型植株受到的危害更大。经进一步研究发现,AtCRF2的表达与病原相关基因有较强的相关性,然而过表达AtCRF2的转基因植株的表型完全受细菌水杨酸羟化酶NahG 表达的抑制[24]。这些研究结果表明,AtCRF2可能增强水杨酸(SA)的生物合成,导致自身免疫反应和叶片衰老。Zhou 等[12]通过酵母双杂试验,鉴定了3 个B-5 子组基因Pti4、Pti5、Pti6,其所编码的蛋白能与致病相关蛋白结合,上调抗细菌性斑点病基因的表达。Park 等[1]从烟草中克隆了Tsi1基因,发现其不仅能被盐胁迫处理诱导表达,还能被乙烯利和水杨酸处理诱导表达。Park 等[1]还发现,Tsi1基因在植物体内超表达,能诱导一系列致病相关基因在正常生长条件下表达,从而提高植株的耐盐性和抗病能力。Hasan 等[25]分析了干旱胁迫过程中3 个棉花品种相关响应基因的转录表达水平,研究结果表明3 个棉花品种的CRF1基因均响应干旱胁迫转录表达,但表达水平不一致。由此可推断,PheERF5基因参与毛竹抗生物和非生物逆境过程,尤其是抗病原菌过程。
本研究中虽然获得了PheERF5基因的cDNA片段且对其进行了生物信息学分析,但尚未对PheERF5基因功能进行验证,应通过进一步的研究(如酵母自激活、亚细胞定位、遗传转化等)验证其功能。

