儿茶酚抑素与高血压患者血压晨峰增加的相关性
刘冉 李春蕾 朱宏燕 杨婧
人的血压呈现昼夜波动的勺型曲线,清晨醒来时血压会急剧升高,学者们将此现象称为血压晨峰[1],生理情况下清晨血压会在合理范围内轻度升高,而大多数高血压患者则存在血压晨峰的异常增加,多项研究显示这种血压晨峰的异常增加是预测心脑血管事件的独立危险因素[2,3]。因此,了解血压晨峰异常增加的相关机制对及时发现并干预晨峰异常,降低心脑血管事件风险至关重要。我们知道参与血压晨峰增加的机制有很多,有研究发现交感神经系统过度兴奋在其中发挥重要作用[4],而多项研究显示儿茶酚抑素(Catestatin)参与交感活性的调节[5],那么它与血压晨峰之间关系如何,目前笔者尚未发现相关报道。
1 资料与方法
1.1 一般资料 2013年5月至2016年4月,我院门诊原发性高血压患者399例。根据24 h动态血压监测结果分为血压晨峰升高组(试验组)和血压晨峰正常组(对照组),其中试验组194例,男116例,女78例;平均年龄(54.40±10.10)岁;对照组205例,男114例,女91例;平均年龄(56.70±8.76)岁。
1.2 纳入与排除标准 纳入标准:年龄30~70岁;入选时从未服用降血压药物或既往曾服用降血压药但因各种原因自行停药>2周;高血压诊断标准符合门诊收缩压≥140 mm Hg和(或)舒张压≥90 mm Hg[6]。排除标准:继发性高血压,白大衣高血压,糖尿病,肝肾功能不全及确诊为心脑血管疾病者(包括心绞痛、心肌梗死、心力衰竭、冠心病介入或搭桥术后;存在肢体功能异常的脑血管病或短暂性脑缺血发作;有症状的周围动脉硬化症)。
1.3 方法
1.3.1 采集患者基本资料,包括年龄、性别、是否吸烟、高血压家族史及高血压病史。
1.3.2 24 h动态血压监测:采用德国Mobil-Graph全信息动态血压监测仪进行。测量当日避免剧烈运动,避免劳累,禁食烟酒、浓茶及咖啡等。日间(6∶00~21∶59)每30分钟记录1次,夜间(22∶00~5∶59)每隔45 min测定1次。血压晨峰的计算方法:睡-谷晨峰值=(醒后2 h内的收缩压平均值)-(包括夜间最低值在内的1 h收缩压平均值),参照《中国高血压防治指南2018》[6],以睡-谷晨峰值≥35 mm Hg为血压晨峰增加。
1.3.3 去甲肾上腺素、Catestatin测定:采集清晨(6∶00Am~8∶00Am)静脉血,EDTA抗凝,3 000 r/min离心10 min后留取血浆,加入抑肽酶置于-80℃冰箱保存,待样品收集完成,用ELISA方法完成样品检测。

2 结果
2.1 一般资料比较 2组年龄、性别比、吸烟率、高血压家族史、高血压病程之间差异无统计学意义(P>0.05)。见表1。

表1 2组一般资料比较
2.2 24 h动态血压监测结果比较 与对照组比较,试验组24 h平均收缩压(SBP)、24 h平均动脉压(MAP)、日间平均收缩压、日间平均动脉压均升高,差异均有统计学意义(P<0.05)。见表2。
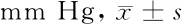
表2 24 h动态血压监测结果比较
2.3 实验室结果比较 试验组去甲肾上腺素水平高于对照组,CST/NE低于对照组,差异均无统计学意义(P>0.05)。Catestatin试验组低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组患者实验室检查结果比较
2.4 亚组分析发现 血压晨峰增加组中血压晨峰增加值与CST/NE水平呈负相关,回归方程y=-0.0007x + 0.1042,R2=0.8163,提示血压晨峰增加越大,CST/NE水平越低。见图1。
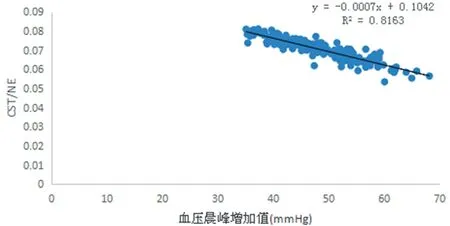
图1 CST/NE与血压晨峰增加值的相关性
从睡眠到觉醒会伴随着血压的迅速升高,我们称之为血压晨峰,大多数高血压患者存在血压晨峰的异常增加,其与心脑血管事件密切相关[7]。高血压患者血压晨峰增加的相关机制有很多,包括交感神经系统、肾素-血管紧张素-醛固酮系统的激活,血小板活性及血浆纤维蛋白含量增加以及压力感受器敏感性下降等[8,9],交感神经系统过度兴奋在其中发挥重要作用[8]。Catestatin是新发现的一种心血管活性肽,它主要来源于肾上腺的嗜铬细胞和肾上腺素能神经元,此外在胃肠道的嗜铬细胞、嗜铬样细胞及多核中性粒细胞中也发现CST的存在[10]。还发现小鼠的心肌细胞也可以产生CST,并通过自分泌或旁分泌的方式进一步发挥作用[11]。Catestatin是上述细胞中的嗜铬粒蛋白A(Chromogranin A,CgA或CHGA)酶解而来的活性片段,与CHGA、儿茶酚胺共同储存在嗜铬细胞、交感神经元细胞以及心肌细胞中,并通过胞吐作用释放[12]Catestatin,能够非竞争、特异性地作用于烟碱型乙酰胆碱受体(nAChR),以自分泌负反馈机制抑制儿茶酚胺释放[13],在交感系统中发挥重要作用。
本研究显示,与对照组比较试验组中去甲肾上腺素水平有升高的趋势,但差异并无统计学意义,提示血压晨峰增加组存在交感系统的过度激活。之前研究也发现在高血压晨峰血压异常的患者中交感过度活化尤为显著[8]。另外研究还发现试验组中catestatin水平显著降低,说明2组catestatin的变化要比去甲肾上腺素显著,不仅提示catestatin下降参与了血压晨峰的异常增加,而且catestatin的下降可能发生在交感活性异常之前。既往研究发现大鼠静脉注射catestatin可显著降低电刺激后交感兴奋引起的急性及延迟性血压升高[14];敲除CgA基因可致小鼠血浆儿茶酚胺水平升高2倍,而外源性给予catestatin或导入CgA基因则可使儿茶酚胺水平下降,血压也显著下降[15,16];本课题组在以往研究中也发现外源给予catestatin可以降低SHR血浆儿茶酚胺水平[17],临床研究也发现在高血压早期存在交感异常活化及血浆catestatin水平下降,另外有高血压家族史的正常血压个体,catestatin水平亦显著降低[18],提示交感异常及catestatin变化在高血压前期即出现,另外血浆catestatin水平较低的个体,寒冷刺激后血浆儿茶酚胺水平、舒张压、平均动脉压升高更为显著[19],均提示catestatin是参与调节交感活动的重要物质。结合本研究结果,我们推测catestatin通过影响交感活性,不仅参与高血压的发生发展,而且在高血压血压晨峰异常增加中也有重要作用。
进一步的亚组分析发现,血压晨峰增加组中CST/NE水平与高血压血压晨峰增加存在负相关,而这种相关性在血压晨峰正常组中并没有体现,Meng 等[20]研究发现与对照组相比,高血压患者血浆CST/NE值明显降低,并且CST/NE比值会随血压水平的升高而降低,还有研究指出CST/NE可以反映交感活性,CST/NE水平降低常提示交感过度激活[21];近几年研究还发现高血压合并左心室肥厚患者中存在交感过度激活及CST/NE水平的显著下降[22],均提示相比catestatin而言CST/NE水平与交感活性相关性更强。本研究显示CST/NE与血压晨峰增加值之间存在负相关,且这种相关性主要体现在试验组,一方面提示血压晨峰增加组中交感活性改变更显著,一方面CST/NE与血压晨峰增加值之间呈现出的负相关,提示我们CST/NE有可能成为高血压患者血压晨峰增加的预测指标,这为临床监测高血压患者的晨峰血压提供了一个新思路。
综上所述,catestatin的减少可能是参与高血压血压晨峰增加的机制之一,CST/NE与血压晨峰增加值表现出的负相关,使其有可能成为血压晨峰增加的血浆标志物,今后可以作为动态血压监测的补充手段辅助我们早期发现高血压患者的异常血压晨峰,并及时干预,从而降低心脑血管事件风险,改善预后。

