miR-132通过靶向KLF7抑制鼻咽癌细胞增殖和迁移
张可,姜岚,僧东杰,朱卿文
鼻咽癌(nasopharyngeal carcinoma,NPC)起源于解剖位置较为隐秘的鼻咽部,属于头颈部肿瘤之一,在我国南方发病率较高。临床多采用放射联合化学疗法治疗NPC,然而其早期易出现远处转移和浸润,且复发率较高[1]。肿瘤细胞增殖、迁移和侵袭是发生远处转移和复发的病理基础[2],探究NPC细胞增殖、迁移的分子机制,寻找相关治疗靶点可能有益于其治疗效果的提高。微小RNA(miRNA)是高度保守的短链(20~25个核苷酸)非编码RNA分子,可以调控基因表达。研究显示,miRNA表达失调及功能障碍可调节肿瘤细胞增殖及转移,在NPC等肿瘤中发挥癌基因或肿瘤抑制基因的作用[3]。本研究旨在通过探讨miR-132和Kruppel样因子(KLF)7在NPC增殖、迁移和侵袭中的作用,以期为NPC的治疗提供新靶标。
1 材料与方法
1.1 材料 SPF级7周龄NIH-Foxn1rnu裸大鼠(均为雄性)70只,购自北京维通利华公司[许可证号:SCXK(京)2016-0006],体质量200~220 g,于郑州大学实验动物中心[动物许可证号:SYXK(豫)2018-0004]进行本项研究,且实验过程遵守3R原则。鼻咽癌组织及正常鼻咽上皮组织均来自郑州儿童医院病理科。CNE-2Z鼻咽癌细胞和NP69永生化正常鼻咽上皮细胞均购自中国医学科学院细胞资源中心。RNA TriPure、反转录试剂及荧光定量PCR(qPCR)试剂购自Roche公司,LipofectamineTM3000转染试剂购自Invitrogen公司;miR-132 mimics及阴性对照、KLF7-WT质粒(携带KLF7 3'UTR原始序列)、KLF7-MUT质粒(携带KLF7 3'UTR突变序列)、KLF7-OE质粒及空质粒均购自上海吉玛公司;双荧光素酶检测试剂盒购自Promega公司;引物、二辛可宁酸二钠(BCA)、HE及CCK-8试剂盒购自上海生工公司;β-actin兔多克隆抗体、KLF7兔多克隆抗体、CD34兔多克隆抗体及山羊抗兔IgG(HRP)购自Abcam公司;培养基购自HyClone公司;qPCR仪器购自Thermo公司;显微镜购自Olympus公司;电泳仪、酶标仪购自BioRad公司。
1.2 方法
1.2.1 细胞培养及分组 CNE-2Z鼻咽癌细胞采用RPMI 1640培养基(含10%FBS、1%链霉素和青霉素)进行培养,NP69永生化正常鼻咽上皮细胞采用Keratinocyte-SFM培养基(含10%FBS)进行培养,每日早晚观察细胞情况,2~3 d传代1次,取第3代状态良好的细胞进行实验。CNE-2Z细胞分组:空白组(不转染)、NC组(转染miR-132 NC和空质粒)、miR-132 mimics组(转染miR-132 mimics)、KLF7-OE组(转染KLF7-OE质粒)和miR-132 mimics+KLF7-OE组(转染miR-132 mimics和KLF7-OE质粒)。根据转染试剂盒操作说明,采用无血清培养基制备LipofectamineTM3000脂质体和miR-132 mimics或(和)KLF7-OE质粒混悬液,分别加入到相应组细胞中,混匀后置于培养箱培养24 h。
1.2.2 qPCR检测miR-132表达 Trizol法提取鼻咽癌、正常鼻咽组织和细胞中的RNA,测定浓度后用试剂盒进行反转录。以反转录所得cDNA为模板根据试剂盒说明配置qPCR反应体系,检测miR-132表达。扩增条件:95℃预变性1 min;95℃变性15 s,65℃退火35 s,68℃延伸45 s,设置40个循环。以U6为内参根据公式2-ΔΔCt计算组织及细胞中miR-132相对表达量。miR-132上游引物5'-ACCGTGGCTTTCGATTG-3',下游引物5'-GAACATGTCTGCGTATCTC-3',产物大小143 bp;U6上游引物5'-CCTCACTGTCCACCTTCCA-3',下游引物5'-GGGTGTAAAACGCAGCTCA-3',产物大小127 bp。
1.2.3 Western blot检测KLF7蛋白表达 制备鼻咽癌及正常鼻咽组织的PBS匀浆液,收集各组细胞并经PBS漂洗3次,加入蛋白裂解液混匀,冰上裂解15 min,离心分离上清液,BCA法测定所提取的蛋白浓度。分别取20μg按顺序进行SDS-聚丙烯酰胺凝胶电泳、转印至PVDF膜,奶粉封闭,兔源一抗KLF7抗体(1∶1 000)和β-actin抗体(1∶500)4℃过夜孵育,洗膜后加入山羊抗兔IgG(HRP)二抗(1∶3 000)室温孵育50 min,加入ECL发光液曝光拍照,根据目的蛋白和内参β-actin条带的灰度值计算组织及细胞中KLF7蛋白相对表达量。
1.2.4 网站预测及双荧光素酶检测KLF7与miR-132的靶向关系 经TargetScan网站预测显示,KLF7 mRNA 3'UTR区存在与miR-132序列配对结合的连续位点,进一步用双荧光素酶检测验证KLF7与miR-132的靶向关系。CNE-2Z细胞分为KLF7-3'UTR-WT+miR-132 NC组、KLF7-3'UTR-WT+miR-132 mimics组、KLF7-3'UTR-MUT+miR-132 NC组和KLF7-3'UTR-MUT+miR-132 mimics组,用LipofectamineTM3000试剂盒分别将KLF7-WT质粒、KLF7-MUT质粒和miR-132 NC、miR-132 mimics转染相应细胞,48 h后收集细胞裂解后采用荧光素酶试剂盒进行检测。以海肾荧光素酶为对照,根据萤火虫荧光素酶活性/海肾荧光素酶活性×100%计算报告基因的荧光素酶活性。
1.2.5 CCK-8实验检测细胞增殖能力 收集各组细胞重新接种于96孔板(每孔100μL含1×104个细胞),培养12、24、36、48、60 h后,将10μL CCK-8溶液加入各孔,继续培养4 h,轻轻混匀后上酶标仪测量各孔在450 nm处的光密度(OD)值,绘制细胞生长曲线。
1.2.6 Transwell实验检测细胞迁移及侵袭能力 收集各组细胞接种于Transwell小室上层(每孔200μL含5×104个细胞),下层加入500μL RPMI培养基,置于培养箱中24 h后取出小室上层,棉签拭去上层凝胶和(或)细胞,浸没在70%乙醇中固定15 min,PBS洗涤3次后苏木精染色,封片并观察。每个小室随机读取5个视野计算通过小室上层的平均细胞数,以评估CNE-2Z细胞迁移、侵袭能力。侵袭实验前,将100μL基质胶加在上层小室中,室温过夜凝固,迁移实验则不作此处理。
1.2.7 裸鼠成瘤实验检测肿瘤体内生长情况 将雄性裸大鼠按照体质量标号后采用随机数字表法分为空白组(CNE-2Z)、NC组、miR-132 mimics组、KLF7-OE组和miR-132 mimics+KLF7-OE组,每组至少12只。取1.2.1中各组CNE-2Z细胞,用胰蛋白酶分离并计数。各组裸大鼠均经腋窝外侧皮下注射相应0.2 mL细胞悬液(1.0×107细胞/mL)。每2天用游标卡尺测量一次裸大鼠腋窝处肿瘤的最小直径(a)和最大直径(b),根据公式1/2(a2×b)计算瘤体体积。
1.2.8 免疫组化检测肿瘤血管密度 取各组裸大鼠的肿瘤组织制备石蜡切片,按顺序进行脱蜡、水化、灭活内源性过氧化物酶、抗原修复、一抗(CD34抗体)孵育、二抗孵育、链霉亲和素-过氧化物酶孵育后,加入DAB显色,苏木素染液复染后脱水、透明、封片,显微镜下拍照观察。每片任取6个视野,通过Image Pro Plus 6.0软件进行图像分析。判断标准:CD34阳性表示内皮细胞,由内皮细胞围绕成的不规则管腔结构判断为微血管。每张切片取6个视野进行微血管计数,以平均值代表肿瘤微血管密度(microvessel density,MVD)。
1.3 统计学方法 采用GraphPad 8.0对数据进行统计分析,数据以±s表示,2组间比较采用t检验,多组比较间比较采用one-way ANOVA,组间多重比较采用Bonferroni校正t检验分析。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-132在鼻咽癌组织及细胞中的表达 鼻咽癌组织中miR-132表达水平(0.35±0.05)较正常鼻咽组织(1.00±0.02)降低(n=30,t=66.111,P<0.01);鼻咽癌CNE-2Z细胞中miR-132表达水平(0.41±0.02)较正常鼻咽上皮细胞NP69(1.00±0.03)降低(n=6,t=40.083,P<0.01)。
2.2 KLF7与miR-132靶向关系验证及KLF7在鼻咽癌组织及细胞中的表达 经TargetScan预测显示,KLF7为miR-132的靶基因,见图1。双荧光素酶检测结果显示,KLF7-3'UTR-WT+miR-132 NC组、KLF7-3'UTR-WT+miR-132 mimics组、KLF7-3'UTR-MUT+miR-132 NC组和KLF7-3'UTR-MUT+miR-132 mimics组荧光素酶活性分别为1.00±0.03、0.45±0.03、1.02±0.05和1.01±0.02,差异有统计学意义(n=6,F=400.681,P<0.01)。与KLF7-3'UTRWT+miR-132 NC组比较,KLF7-3'UTR-WT+miR-132 mimics组荧光素酶活性显著降低(P<0.05),KLF7-3'UTR-MUT+miR-132 NC组和KLF7-3'UTRMUT+miR-132 mimics组无明显变化。Western blot结果显示,鼻咽癌组织中KLF7蛋白表达水平(3.41±0.09)较正常鼻咽组织(1.00±0.03)增高(n=30,t=139.141,P<0.01);鼻咽癌CNE-2Z细胞中KLF7蛋白表达水平(3.37±0.06)较正常鼻咽上皮细胞NP69(1.00±0.02)增高(n=6,t=91.790,P<0.01),见图2。

Fig.1 The targeting relationship between KLF7 and miR-132图1 KLF7与miR-132的靶向关系分析

Fig.2 The expression levels of KLF7 in nasopharyngeal carcinoma tissues and cells图2 KLF7在鼻咽癌组织及细胞中的表达
2.3 转染miR-132 mimics和(或)KLF7-OE质粒对KLF7表达的影响 空白组、NC组、miR-132 mimics组、KLF7-OE组和miR-132 mimics+KLF7-OE组KLF7蛋白表达水平分别为1.05±0.03、1.04±0.04、0.49±0.02、2.38±0.07和1.11±0.05,差异有统计学意义(n=6,F=1 421.155,P<0.01)。与空白组和NC组比较,miR-132 mimics组CNE-2Z细胞中KLF7蛋白表达水平显著降低,KLF7-OE组其表达水平显著增高(P<0.05)。与miR-132 mimics组比较,miR-132 mimics+KLF7-OE组KLF7蛋白表达显著增高(P<0.05)。
2.4 miR-132靶向KLF7对鼻咽癌细胞增殖的影响 CKK-8分析结果显示,相比空白组和NC组,miR-132 mimics组的CNE-2Z细胞36、48、60 h增殖活力显著降低,KLF7-OE组则显著增高(P<0.05)。相比miR-132 mimics组,miR-132 mimics+KLF7-OE组的CNE-2Z细胞36、48、60 h增殖活力显著增高(P<0.05),见表1。
2.5 miR-132靶向KLF7对鼻咽癌细胞迁移和侵袭的影响 Transwell实验结果显示,相比空白组和NC组,miR-132 mimics组的CNE-2Z细胞迁移和侵袭数量显著降低(P<0.05),KLF7-OE组迁移和侵袭数量均显著增高(P<0.05)。相比miR-132 mimics组,miR-132 mimics+KLF7-OE组的CNE-2Z细胞迁移和侵袭数量显著增高(P<0.05)。见图3、表2。
Tab.1 Comparison of CNE-2Z cell proliferation ability between the five groups at different time points表1 各组CNE-2Z细胞不同时点增殖能力比较 (n=6,OD值,±s)
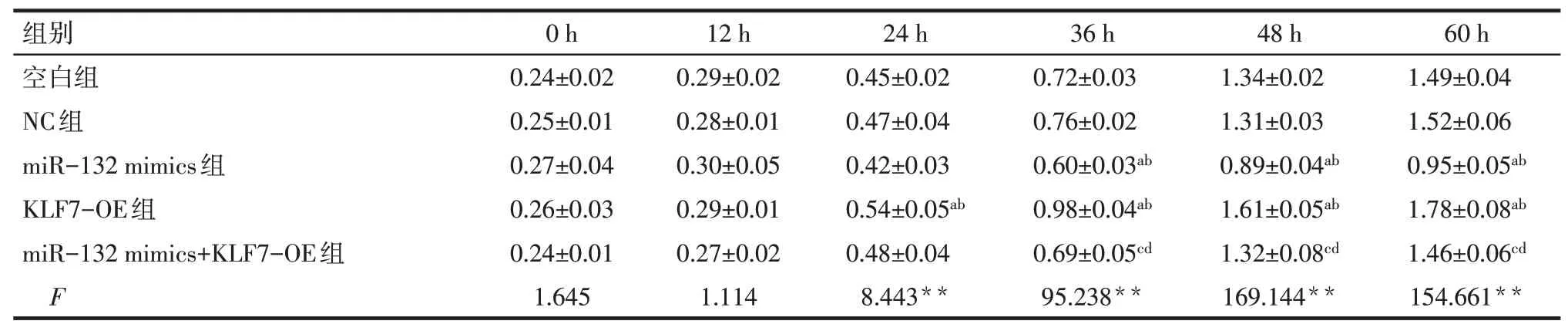
Tab.1 Comparison of CNE-2Z cell proliferation ability between the five groups at different time points表1 各组CNE-2Z细胞不同时点增殖能力比较 (n=6,OD值,±s)
**P<0.01;a与空白组比较,b与NC组比较,c与miR-132 mimics组比较,d与KLF7-OE组比较,P<0.05
?

Fig.3 Comparison of CNE-2Z cell migration and invasion between the five groups(hematoxylin dyeing,×200)图3 各组CNE-2Z细胞迁移及侵袭情况比较(苏木精染色,×200)
Tab.2 Comparison of CNE-2Z cell migration and invasion between the five groups表2 各组CNE-2Z细胞迁移及侵袭情况比较(n=6,个/视野,±s)

Tab.2 Comparison of CNE-2Z cell migration and invasion between the five groups表2 各组CNE-2Z细胞迁移及侵袭情况比较(n=6,个/视野,±s)
**P<0.01;a与空白组比较,b与NC组比较,c与miR-132 mimics组比较,d与KLF7-OE组比较,P<0.05
?
2.6 miR-132靶向KLF7对裸鼠体内肿瘤生长的影响 相比空白组和NC组,miR-132 mimics组的肿瘤体积在第8~20天均显著降低(P<0.05),KLF7-OE组的肿瘤体积在第8~20天均显著增高(P<0.05)。相比miR-132 mimics组,miR-132 mimics+KLF7-OE组的肿瘤体积在第8~20天显著增高(P<0.05)。见表3。
2.7 miR-132靶向KLF7对裸鼠肿瘤内血管生成的影响 免疫组化检测结果显示,空白组、NC组、miR-132 mimics组、KLF7-OE组和miR-132 mimics+KLF7-OE组MVD(条/视野)分别为65.47±5.06、62.86±4.93、35.14±4.51、184.83±8.50和68.07±4.28,差异有统计学意义(n=12,F=1 268.092,P<0.01)。相比空白组和NC组,miR-132 mimics组的肿瘤内血管减少,MVD降低(P<0.05),KLF7-OE组的肿瘤内血管增多,MVD显著增高(P<0.05);相比miR-132 mimics组,miR-132 mimics+KLF7-OE组的肿瘤内血管增多,MVD显著增高(P<0.05)。见图4。
3 讨论
随着放射和化学疗法的进步,放疗的敏感性和局部控制效果明显改善,然而仍有30%~40%的NPC患者会在4年内发生远处转移,严重影响预后[4]。进一步认识NPC转移的分子模式,对于开发有效的新治疗策略至关重要。目前,已在NPC中观察到多种miRNA表达失调,且特定miRNA异常表达与NPC细胞的增殖、转移和侵袭有关[5]。
miR-132在肿瘤中的作用具有差异性,其在胆管癌、胰腺癌中高表达,发挥促增殖、促侵袭等致癌作用[6-7]。然而,miR-132在更多肿瘤中表达降低,发挥肿瘤抑制作用,其中miR-132在前列腺癌中低表达,且在转移性淋巴结中的表达更低,miR-132的功能丧失可能通过提高葡萄糖代谢,促进癌细胞生长[8]。在卵巢癌和非小细胞肺癌中miR-132亦低表达,过表达miR-132可抑制细胞的增殖、克隆形成、上皮间质转化、迁移和侵袭等过程[9-10]。Chen等[11]研究显示,miR-132在甲状腺癌组织和细胞系中显著下调,过表达miR-132可通过靶向FOXA1等发挥抑癌作用。另有研究显示,miR-132在胃癌中通过靶向黏蛋白(MUC13)、CD44、纤连蛋白1(FN1)等促进胃癌细胞的扩散和远处转移[12-13]。Yang等[14]采用GSE36682芯片分析发现miR-132在NPC肿瘤组织中表达降低,且miR-132低表达与远处转移和不良预后有关。本研究也在NPC组织和细胞系中观察到miR-132表达下调,过表达miR-132可抑制CNE-2Z细胞增殖、迁移和侵袭,进一步体内实验表明过表达miR-132可抑制NPC细胞在裸鼠内生长和肿瘤内血管形成,表明在鼻咽癌中miR-132亦发挥抑癌作用,其机制有待探索。
Tab.3 Comparison of tumor volume in nude mice between the five groups at different time points表3 各组裸鼠体内不同时点肿瘤体积的比较 (n=12,mm3,±s)
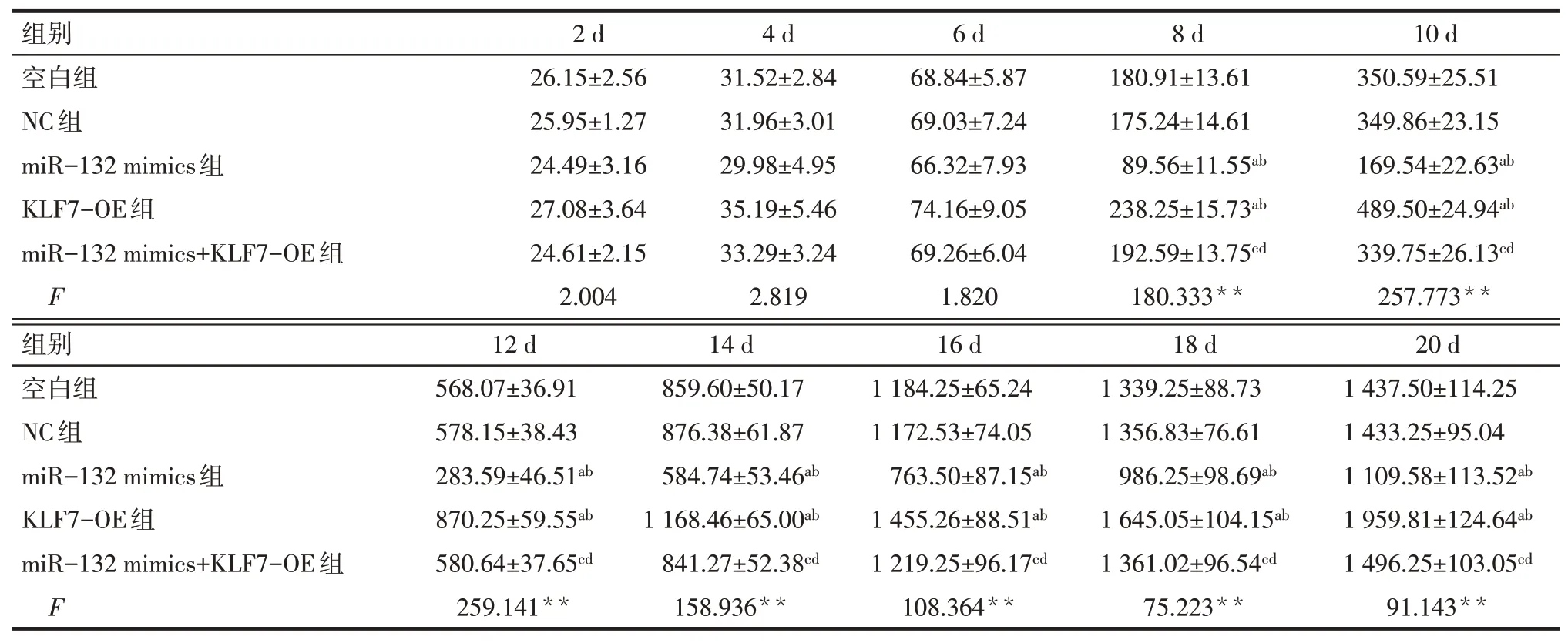
Tab.3 Comparison of tumor volume in nude mice between the five groups at different time points表3 各组裸鼠体内不同时点肿瘤体积的比较 (n=12,mm3,±s)
**P<0.01;a与空白组比较,b与NC组比较,c与miR-132 mimics组比较,d与KLF7-OE组比较,P<0.05
?
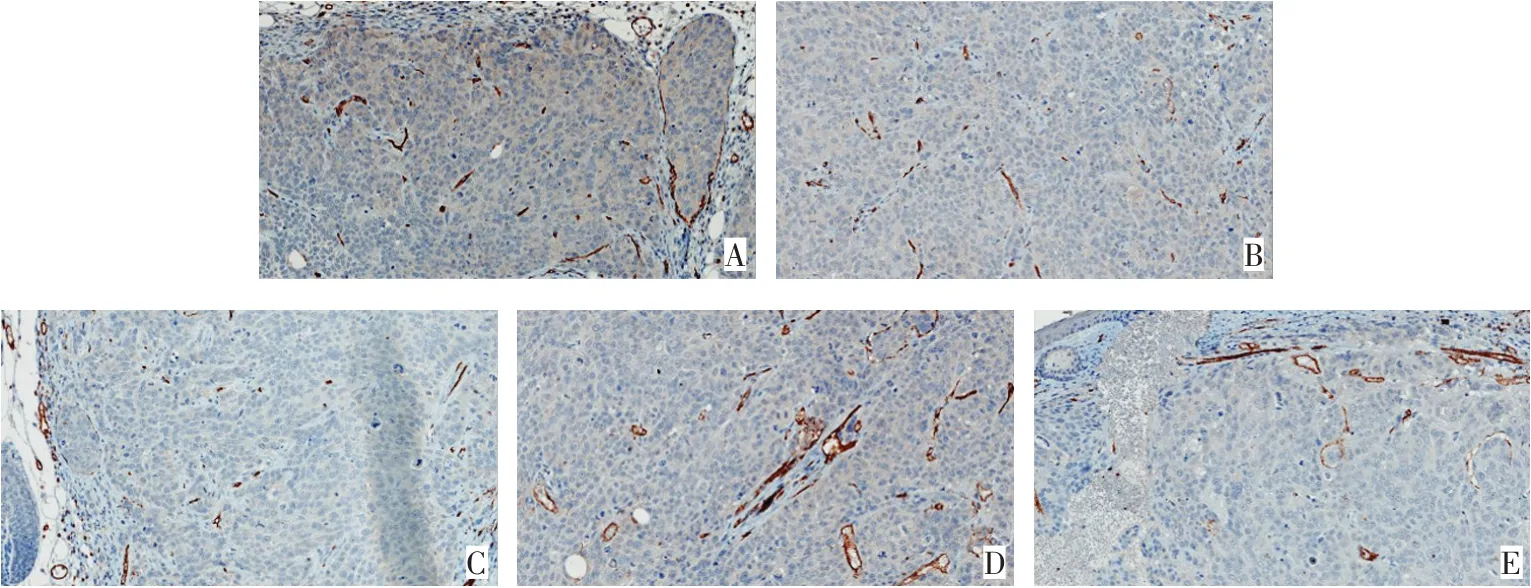
Fig.4 Comparison of angiogenesis in tumor of nude mice between the five groups(SP immunohistochemistry,×200)图4 各组裸鼠肿瘤内血管生成的比较(SP免疫组化,×200)
本研究结果显示,过表达miR-132可显著降低CNE-2Z细胞中KLF7蛋白表达,进一步通过TargetScan网站预测[15]和双荧光素酶检测证实KLF7为miR-132的直接靶标之一,推测KLF7可能是miR-132的作用靶点。KLF可与DNA转录区域结合并充当转录激活因子或阻遏因子,可影响细胞增殖、分化和迁移等过程[16]。近年研究发现,KLF7在宫颈癌[17]、肺癌[18]等多种肿瘤组织或细胞中高表达,可促进肿瘤进展,造成患者不良预后。Li等[19]报道,KLF7可调节非小细胞肺癌组织中Wnt/β-catenin信号介导的上皮间质转化过程,并作为miR-103的直接靶标,KLF7表达上调可能促进胃癌发展。另有研究发现,KLF7在神经胶质瘤中高度表达,可通过激活精氨酸琥珀酸裂合酶(ASL)转录,触发神经胶质瘤细胞的异常生长,上述作用受到miR-136-3p的负调控[20-21]。Gupta等[22]报道,KLF7可通过维持高尔基体结构和功能复杂性,促进胰腺导管腺癌生长和转移。本研究证实,KLF7蛋白在NPC组织和细胞系中均表达上调,过表达KLF7可促进CNE-2Z细胞增殖、迁移、侵袭及其在裸鼠内生长和肿瘤内血管形成,且过表达KLF7可减弱miR-132 mimics的抑肿瘤作用,进一步表明miR-132可靶向KLF7,对NPC细胞增殖、迁移及侵袭产生影响。
综上所述,miR-132在NPC组织和细胞中呈低表达,KLF7呈高表达,miR-132可通过负调控KLF7,影响NPC细胞的增殖、迁移及侵袭,这为NPC靶向治疗提供了新思路。然而miR-132具有多个靶点,且基因表达可受到多种miRNA调控。本研究仅揭示了miR-132和KLF7在NPC中的作用,因此后续还需要对miR-132的其他靶标及调控KLF7的其他miRNA进行系统分析。

