《化学必修二 认识有机物——乙醇》教案


学科目标与核心素养:
1、通过模型认知、实验探究分析,了解乙醇的结构、性质和应用,初步学会认识有机化合物的一般思路,发展变化观念和证据推理与模型认知的学科素养。
2、通过探究乙醇的催化氧化反应实验并分析其反应规律,认识一种有机反应类型----氧化还原反应的基本规律,知道乙醇在一定条件下可以转化为乙醛、乙酸,了解有机化合物的转化。培养科学探究与创新意识的核心素养。
3、通过乙醇在生产、生活中的实际应用,认识乙醇在能源、饮食、健康等方面的应用价值,知道如何合理使用常见的有机化学品。培养科学精神与社会责任的学科核心素养。
教学重点、难点的确立:
重点:1.乙醇分子的组成和结构。
2.乙醇的主要化学性质。
难点:1.建立乙醇分子的立体结构模型
2.催化氧化反应中的断键位置
教学过程:
情境导入:1.同学学古诗中也有学过一些酒的诗句,同学们能想得起来吗?
2.根据生活经验,总结乙醇的物理性质
任务一:总结乙醇物理性质
任务二:搭建模型 微观探析乙醇的结构
根据乙醇分子式:C2H6O推断乙醇的结构式
问题1.乙醇的分子结构和哪种烷烃分子相似?
问题2.在乙烷分子结构中嵌入一个O原子(即得到C2H6O),有几种情况,并组装。请写出它们的结构式。(附:根据C、H、O原子的成键特殊性,推测乙醇的可能结构)
过渡:乙醇的结构到底是哪一种呢?
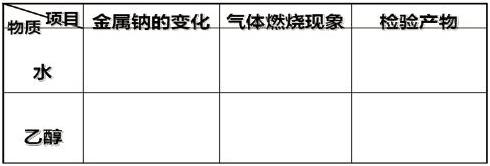
示范实验:书本实验7-4
操作步骤:1.在一支大试管里取2ml的无水乙醇。
2.再向其中加入一粒新切的、用滤纸擦干表面煤油黄豆粒大小的金属钠。
问题3、依据乙醇的结构,请推测、分析:乙醇与金属钠反应的现象如何?
归纳:认真观察实验现象,同时回忆以前学习的钠和水反应的实验现象。(小组讨论)
1.水和钠的反应说明水中 键易断裂?
2.由乙醇和钠的反应说明乙醇中存在 键容易断裂?
小结:金属钠与C2H5OH反应断O-H共价键,该共用电子对偏向O,O-H容易断。
思考:书本乙醇燃烧火焰不稳定,会跳动,并且加热乙醇会挥发出C2H5OH,乙醇燃烧会产生CO2,烧杯上澄清石灰水会变浑浊。请问该如何进行改进实验?
任务三、证据推理构建乙醇的化学性质的认知模型
1、乙醇与活泼金属钠、钾反应
投影:(1)播放乙醇与金属钠反应的微观动画。
(2)写出乙醇和钠反应的原理。
(3)进一步写出乙醇和钾反应的原理。
2、乙醇的氧化反应(燃烧反应)
【投影:加油站的宣传标语。联系课前归纳整理乙醇的用途,回忆书写乙醇的燃烧方程式。
3、乙醇的催化氧化
问题:酒是人们经常接触的饮品,为什么人喝多了会醉?乙醇在人体内发生了怎样的变化?查酒驾的原理是什么?
学生实验:
实验操作:把一根弯成螺旋状的铜丝放在酒精灯外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里,这样反复操作几次。
实验现象:_______________________________________________________
小结:铜丝在外焰上加热后变成黑色的氧化铜,伸入乙醇后又变成铜,说明铜丝在反应中充当催化剂的作用。
动画模拟乙醇在催化氧化过程中的断键位置。
乙醇催化氧化的反应方程式:____________________________________________
拓展:CH3CH(CH3)OH 与CH3C(CH3)2OH能发生催化氧化反应吗?若能,写出相应产物从这实例得到什么启示?
结论:羟基连接碳原子上有氢原子时才可以被氧化
4、乙醇能被强氧化剂氧化
思考:乙醇在生活中的另一個应用——查酒驾依据乙醇什么化学性质?
任务四、科学态度与社会责任了解乙醇的用途
板书设计:
小结:小组为单位畅所欲言本节课的收获
课堂小测:
乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
1、与活泼金属反应键 断裂
2、CH3CH2OH 燃烧键 断裂
3、在Cu或Ag催化下和O2反应键 断裂
广东省茂名市第十六中学 唐妃琼

