基于ISSR-PCR的长白落叶松种子园单株遗传多样性分析
邱新宇 张含国 黎家俊 玉苏普·赛迪艾合麦提胥丽雅 张素芳 张磊


摘要: 以长白落叶松无性系种子园347个单株为试验材料,利用ISSR-PCR分子标记技术分析其遗传多样性的结果表明,长白落叶松种子园单株具有丰富的遗传多样性。11条引物共扩增出172条谱带,其中,多态性谱带169条,多态位点比率为98.26%,基因多样性指数0.285 5,Shannon多样性指数0.479 5~0.520 4,Nei's 指数0.064 0~0.436 0。
关键词: ISSR; 长白落叶松; 单株; 遗传多样性
中图分类号: S 791. 22, S 722. 7 文献标识码: A 文章编号:1001 - 9499(2019)02 - 0023 - 03
长白落叶松(Larix olgensis)为松科落叶松属,主要分布于东北林区,其速生性、耐腐性和力学特性优于其他松科植物,常作为木材工业原料使用,是我国主要的造林树种之一。不同物种的遗传物质是不同的,在特定的环境条件中,通过群体的遗传多样性研究可以了解物种遗传物质的丰富程度[ 1 - 2 ]。物种的遗传多样性越丰富,适应环境变化的能力就越强,越不容易灭绝[ 3 ]。DNA标记是目前最有效的遗传多样性研究方法,其中,ISSR分子标记简单便捷、开发成本低,被广泛应用于遗传多样性研究中。本研究以黑龙江省林口青山林场的长白落叶松种子园为研究对象,在DNA水平上研究长白落叶松无性系种子园的遗传多样性,以此了解长白落叶松对环境的适应能力,为种质资源亲缘关系的鉴别、评价和利用提供参考依据。
1 试验材料与方法
1. 1 试验材料
试验材料源于牡丹江林口县青山林场,采自1994年定植的长白落叶松无性系种子园第78区的347个单株。2016年6 月下旬,采取当年生幼嫩针叶,分袋装好并标记,置于冰箱-80℃冷冻保存,用于提取样本总DNA。
1. 2 试验方法
1. 2. 1 基因组DNA提取
使用新型植物基因组DNA提取试剂盒(北京天根生化科技有限公司生产)提取长白落叶松样品总DNA。
1. 2. 2 DNA质量检测
用1.5%的琼脂糖凝胶电泳以及紫外吸收法检测DNA 质量。根据DNA凝胶条带判断DNA的完整性,若窄带集中,说明DNA完整性较好。利用分光光度计测定DNA浓度与纯度,为保证后续试验顺利进行,浓度需大于200 ng/ul,OD260/OD280=1.8~2.0。将已提取的DNA模板置于-40℃冰箱保存待用。
1. 2. 3 引物筛选
以100条试验室已有引物(来源:林木遗传育种国家重点试验室的ISSR引物,部分加拿大哥伦比亚大学公布的第9套ISSR引物序列)为筛选目标,随机选取4个单株作为引物筛选样品。
1. 2. 4 ISSR-PCR反应体系和扩增程序
根据PCR电泳结果选择谱带清晰的引物,按照落叶松ISSR-PCR反应体系和扩增程序[ 8 - 10 ],随机选用不同样品进行PCR扩增。在1×TAE缓冲液中,将扩增产物用含有溴化乙锭的1.5%琼脂糖凝胶进行电泳分离,在紫外灯下拍摄保存记录结果。
1. 2. 5 分子标记数据统计与分析
参照电泳图谱中分子量标准,分析PCR 扩增产物片段的大小,推算扩增产物的分子量。有DNA条带的记为“1”,无DNA条带的记为“0”。利用 Popgene32软件计算得到供试材料的等位基因数、有效等位基因数、Nei's基因多样性指数、Shannon 多样性指数等相关参数[ 11 - 12 ]。
2 结果与分析
2. 1 DNA质量检测
由DNA 琼脂糖检测结果(图1)可以看出:窄带比较集中,提取的长白落叶松DNA样品质量较好,其浓度及纯度均符合试验要求。
2. 2 引物筛选
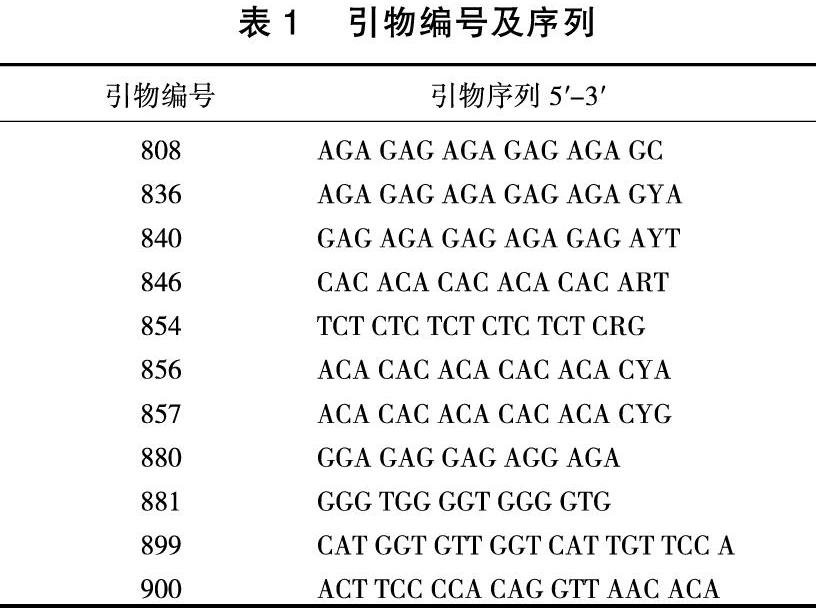
根据电泳结果,选择条带清晰、差异明显、重复性和稳定性较好的引物进行遗传多样性分析,从100个引物中共筛选出了11个引物,引物编号及序列见表1。
2. 3 ISSR-PCR扩增
多态位点比率反映了群体遗传变异水平的高低,对环境适应能力强的群体多态位点比率也比较高。利用11个引物对长白落叶松无性系347个单株的DNA 样品进行ISSR-PCR 扩增,共检测到 172个位点,位点范围为100 bp~3 000 bp。每个引物平均扩增 15.63个条带,多态位点有169个,多态位点比率高达 98.26%。其中,引物900扩增位点最多,有20个位点,多态位点百分率为55%;引物854多态位点最少,有11个位点,多态位点百分率为63.64%。
2. 4 单株遗传多样性分析
由单株遗传多样性分析结果(表4)可以看出:(1)单株等位基因平均数范围为1.000 0~2.000 0,有效等位基因數变动范围为1.000 0~1.999 9。14、44、45号3个单株有效等位基因数最低,其值均为1.000 0,第143株有效等位基因数最高,其值为1.999 9。(2)基因多样性指数最大为0.500 0,最小为0.000 0;Shannon指数最大为0.692 6,最小为0.000 0,单株间遗传变异变化幅度为0.479 5~0.520 4,不同单株遗传变异变化幅度为0.064 0~0.436 0,种群总体遗传变异平均值为0.285 5,试验样本种内单株之间的遗传变异明显,群体分化强烈。(3)遗传距离范围为0.017 6~0.658 9,347个长白落叶松单株的亲缘变化幅度较大。
3 结论与讨论
本次对长白落叶松种子园单株样本进行ISSR标记,共检测到 172个位点,多态位点比率为98.26%,表明长白落叶松不同单株间相似度低、多态性高,单株之间的遗传变异明显,群体分化强烈,个体间的亲缘关系变幅较大。据此可以判断,长白落叶松种子园单株遗传多样性较高,可提供大量无亲缘关系的优良种子。
参考文献
[1] Soltis PS, Slotis DE.Genetics variation in endemidc and widespread plant species: Examples from Szxifragaceae and Polystichum. Aliso, 1991, 13: 215 - 223.
[2] 林萍, 张含国, 谢运海. 正交设计优化落叶松ISSR-PCR反应体系. 生物技术, 2005, 15(5): 34 - 37.
[3] 马丽, 侯乐峰, 郝兆祥, 等. 82个石榴品种遗传多样性的ISSR分析[J]. 果树学报, 2015, 32(5): 741 - 750.
[4] Akhare A, Sakhare S, Kulwal P, et al.RAPD profile studies in Sorghum for identification of hybrids and their parents[J].Int J Inter Biol, 2008, 3(1) : 18 - 24.
[5] 钱韦, 葛颂, 洪德元. 采用RAPD和ISSR标记探讨中国疣粒野生稻的遗传多样性[J]. 植物学报, 2000, 42: 741.
[6] Ge X J, Sun M. Reprodutive biology and genetic diversity of a cryptoviviparous mangrove Aegiceras corniculatum (Myrtinaceae) using allozyme and intersimple sequence repeat (ISSR) analysis[J]. Mol E col, 1999, 8: 2 061.
[7] 胡连清, 王清明, 丁显平, 等. 极危物种——南川木波罗遗传多样性ISSR分析[J]. 四川大学学报(自然科学版), 2018, 55(04): 865 - 872.
[8] Camacho F J, Liston A. Population structure and genetic diversity of Botrychium pumicola(Ophioglossaceae) based on inter-simple sequence repeats (ISSR)[J]. Am J Bot, 2001, 88: 1 065.
[9] 郭艳, 洪建聪, 陈铌铍, 等. 白及遗传多样性的ISSR分析[J]. 中成药, 2018, 40(09): 2 020 - 2 024.
[10] 姚宇, 张含国, 张振, 等. 去劣疏伐对长白落叶松初级无性系种子园SSR遗传多样性的影响[J]. 中南林业科技大学学报, 2013, 33(03): 40 - 46.
[11] 于大德. 华北落叶松种子园遗传多样性及亲本分析[D]. 北京林业大学, 2014.
[12] 范英明. 华北落叶松天然群体SSR标记遗传多样性分析[D]. 北京林业大学, 2014.
第1作者簡介: 邱新宇(1996-), 女, 本科, 研究方向: 林木遗传育种。
通讯作者: 张含国(1962-), 男, 教授, 博导, 研究方向: 林木遗传育种。
收稿日期: 2019 - 01 - 06
(责任编辑: 王 岩 )

