消渴平含药血清对高糖诱导大鼠肾小球系膜细胞凋亡的影响
胡 爽,辛传伟,羊 波,夏仲尼
(浙江省中医药研究院,浙江省立同德医院·浙江 杭州 310012)
糖尿病肾病(diabetic kidney disease.,DKD)是糖尿病患者常见且严重的微血管并发症。研究表明,DKD占终末期肾病(end-stage renal disease,ESRD)的30%~47%,是引起终末期肾病的最常见诱因[1-2],其发病机理和防治途径是医学界研究的热点。肾小球系膜细胞(glomerular mesangial cells,MC)是肾小球内的固有细胞,在各种病理因素作用下,MC凋亡造成的系膜细胞缺失是糖尿病肾损伤的重要机制[3]。因此,研究寻找抑制MC凋亡的有效药物,具有重要的意义。消渴平合剂(Xiaokeping,XKP)作为医院制剂,前期研究表明该药有改善胰岛素抵抗、保护大鼠肾功能等作用[4-5];但尚未见消渴平对MC凋亡的研究报道。本实验通过观察消渴平对高糖诱导的大鼠肾小球系膜细胞凋亡的影响,探讨其防治 DKD的作用机理。
1 材料与方法
1.1 细胞 肾小球系膜细胞株HBZY-1:购自赛百慷(上海)生物技术股份有限公司。
1.2 药物与试剂 消渴平(黄芪、生地黄、丹参、山药、菊花、麦冬、天花粉、枸杞子等配方组成):浙江省中医药研究院制剂室生产。DMEM培养基:Hyclone;胎牛血清:浙江天杭生物科技股份有限公司;TUNEL凋亡试剂盒:生工生物工程(上海)股份有限公司;兔抗 cleaved caspase-3:美国 Cell Signaling;兔抗 Bax、Bcl-2、细胞色素 C (Cytochrome c,Cyt-C)抗体:英国 Abcam。
1.3 血清制备 取SPF级雄性健康SD大鼠40 只,体质量(200±20) g,购于上海斯莱克动物实验有限公司,动物生产许可证号:SCXK(沪)2017-0015,按实验动物管理使用指南饲养。含药血清分别使用消渴平高浓度(2 g·mL-1)、低浓度(0.5 g·mL-1)的浓缩液对大鼠进行灌胃。正常对照组则给予等体积的生理盐水。连续给药7 d,最后一次给药后2 h无菌操作心脏采血,分离血清,置于-20 ℃冷存备用。使用前置于56 ℃的水浴行30 min灭活,然后 0.2 μm微孔滤膜除菌备用。
1.4 实验分组 取第5代大鼠系膜细胞,用含15%胎牛血清的DMEM低糖培养液,接种于96 孔板中,贴壁同步化24 h,按实验设计分组如下:正常对照组(加入10%正常大鼠血清,NC组)、高糖组(25 mmol·L-1葡萄糖培养,HG组)、正常血清+高糖组(25 mmol·L-1葡萄糖+10%正常大鼠血清,NS组)、消渴平低剂量组(25 mmol·L-1葡萄糖+10%XKP 0.5 g·mL-1含药血清,LXKP组)、消渴平高剂量组(25 mmol·L-1葡萄糖+10%XKP 2 g·mL-1含药血清,HXKP组)、厄贝沙坦组(25 mmol·L-1葡萄糖+10%厄贝沙坦3 g·L-1含药血清,IP组)。
1.5 观察指标检测
1.5.1 系膜细胞凋亡检测 按照生工生物工程TUNEL凋亡检测试剂盒说明书操作,首先细胞爬片,细胞贴壁后加药。药物作用结束弃去培养液,每孔加入1~2 mL预冷的4%多聚甲醛,固定10 min,PBS漂洗3次,每次5 min;通透细胞膜后,滴加Tunel工作液100 μL行Tunel反应,PBS漂洗后,每孔加入核染试剂DAPI细胞核染色,倒置荧光显微镜下观察拍照。荧光显微镜下计数每个高倍视野中阳性染色细胞数和总细胞数,以阳性细胞百分比计算凋亡率(AI)。
1.5.2 Western blot检测肾小球系膜细胞中cleaved caspase-3、Bax、Bcl-2及Cyt-C的蛋白表达 分别添加RIPA 蛋白裂解液60 μL、蛋白酶抑制剂0.6 μL,提取细胞总蛋白,用BCA法检测蛋白浓度。分别用SDS-PAGE凝胶电泳对蛋白样品分离,转移至PVDF膜,5%脱脂奶粉封闭2 h,一抗于4 ℃孵育过夜。TBST洗膜,然后加二抗2 h室温孵育,滴加ECL后检测,以β-actin为内参照,用Quantity One图像分析系统测定各目的条带灰度值。
1.5.3 荧光定量PCR检测肾小球系膜细胞中Bax mRNA、Bcl-2 mRNA表达情况 收集细胞样品,加入Trizol试剂,提取总RNA,进行逆转录反应,内参基因为GAPDH,引物设计如表1所示,实验数据采用2-△△CT法进行分析。

表1 荧光定量 PCR实验引物设计表
2 结果
2.1 消渴平对各组大鼠肾小球系膜细胞凋亡的影响 实验发现,与正常对照组相比,高糖组大鼠肾小球系膜细胞中凋亡率显著升高(P<0.01)。与高糖组相比,正常血清+高糖组大鼠肾小球系膜细胞中凋亡率无显著性变化,消渴平高剂量治疗组及IP治疗组细胞凋亡率明显降低(P<0.05)。见图1,表2。

图1 各组肾小球系膜细胞的凋亡变化(×400)

表2 各组大鼠肾小球系膜细胞凋亡率比较
2.2 消渴平对高糖培养肾小球系膜细胞cleaved Caspase-3、Bax、Bcl-2及Cyt-C蛋白表达的影响 实验结果表明,与NC组相比,高糖组cleaved Caspase-3、Bax、Cyt-C蛋白表达水平明显升高(P<0.01),Bcl-2蛋白表达明显降低(P<0.01)。与高糖组比较,HXKP及IP组cleaved Caspase-3、Bax、Cyt-C表达明显降低(P<0.05),Bcl-2蛋白表达明显升高(P<0.05),其中消渴平高剂量组与IP组相比无显著性差异(P>0.05),见图2,表3。
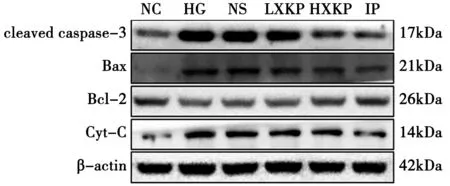
图2 各组肾小球系膜细胞Cleaved caspase-3、Bax、Bcl-2及Cyt-C蛋白表达Western blot 检测结果
表3 各组肾小球系膜细胞Cleaved Caspase-3、Bax、Bcl-2及Cyt-C蛋白表达的比较
2.3 消渴平对高糖培养肾小球系膜细胞Bax mRNA、Bcl-2 mRNA表达的影响 与空白对照组相比,高糖组Bax mRNA的表达水平显著升高(P<0.01),Bcl-2 mRNA表达水平显著降低(P<0.01)。与高糖组比较,HXKP及IP治疗组Bax mRNA表达均明显降低(P<0.05),Bcl-2 mRNA表达水平明显升高(P<0.05)。其中HXKP组与IP治疗组相比无显著性差异(P>0.05),见表4。
表4 各组肾小球系膜细胞Bax mRNA、Bcl-2 mRNA表达的比较
3 讨论
糖尿病肾病(DKD)发病机理复杂,研究表明,糖尿病肾病肾脏损伤从肾小球系膜细胞凋亡开始,致使肾小球基底膜增厚,诱发肾衰竭,干预肾小球系膜细胞的凋亡能够有效减少DKD肾损伤[6]。本研究利用体外高糖对系膜细胞进行培养,TUNEL研究结果发现系膜细胞在高糖(25 mmol·L-1葡萄糖)环境下明显出现凋亡;与高糖组相比,消渴平高剂量组能显著抑制高糖诱导的系膜细胞凋亡。Western blot检测结果显示,消渴平高剂量组能明显抑制肾小球系膜细胞中cleaved caspase-3、Bax及Cyt-C的蛋白表达(P<0.05),升高Bcl-2蛋白表达(P<0.05);荧光定量PCR实验同样证实消渴平对高糖诱导的系膜细胞凋亡具有抑制作用,可显著降低Bax mRNA表达(P<0.05),明显升高Bcl-2 mRNA表达水平(P<0.05)。
研究表明,B淋巴细胞瘤基因相关X蛋白(Bax)主要作用在线粒体水平,其与B淋巴细胞瘤基因-2(Bcl-2)属于一个家族,通过控制线粒体膜的通透性来阻止Cyt-C从线粒体释放到细胞质,从而抑制细胞凋亡[7]。半胱天冬酶-3(Caspase-3)是参与细胞凋亡过程中的信号分子,它的活化可以被Bcl-2阻断,从而产生抑制凋亡的作用[8]。生理状态下Bax/Bcl-2保持相对动态平衡,在疾病状态下,Bax介导Cyt-C的释放,具有促凋亡作用,而Bcl-2可阻止凋亡形成因子Cyt-C从线粒体释放出来,具有抗凋亡作用[9]。本实验研究结果显示,高糖刺激下系膜细胞凋亡率明显增加,凋亡相关蛋白Bax、Cyt-C、cleaved caspase-3表达增高,抗凋亡蛋白Bcl-2表达降低,而消渴平高剂量组能显著抑制高糖诱导的系膜细胞凋亡。
消渴平合剂为笔者所在医院院内制剂,前期临床研究表明该药可提高胰岛素敏感性[4],动物实验证实消渴平合剂可以明显降低db/db小鼠体质量及血肌酐、尿素氮水平[10]。本实验从系膜细胞凋亡的角度探讨了消渴平合剂对DKD的防治机制,实验结果显示,消渴平合剂可明显抑制高糖诱导的大鼠系膜细胞凋亡,明显抑制肾小球系膜细胞中cleaved caspase-3、Bax及Cyt-C蛋白表达,升高Bcl-2 蛋白表达,这可能是其防治DKD的机制之一。

