Mn2+掺杂普鲁士蓝纳米颗粒T1-T2双模磁共振成像和光热治疗的体外研究
何庚翰,陶 泉,刘 闯,张 迪,周宇平,刘瑞源
南方医科大学生物医学工程学院,广东 广州 510515
肿瘤是严重威胁人类健康的主要疾病之一[1-2],对其进行诊断和治疗是医学研究的热点[3]。磁共振成像(MRI)因其具有高空间分辨率[4]、深层软组织穿透力[5-6]和无创成像[7]等优点,是目前用于肿瘤检查和诊断的主要方式[8-10]。在肿瘤治疗方面,光热治疗(PTT)是一种极具潜力的新型肿瘤治疗方式,一般通过靶向基团将近红外吸收剂特异性地输送到肿瘤部位[11-12],在近红外激光的照射下,有效地将光能转换为热能并诱发肿瘤细胞凋亡[13-17],可最大限度地减少对周围正常组织的损伤[18],具有低副作用[19-20]、高效性和生物安全性等优点[21-22]。
普鲁士蓝纳米粒子是由过渡金属离子或者镧系元素通过氰基桥联配体组装而成的一种无机纳米粒子[23-25],具有生产成本低、分子结构可调、孔隙率高、生物相容性好等优点[26],现已广泛应用于肿瘤的光声成像、磁共振成像、超声成像、光热治疗及药物载体等多种领域[27-32],是构建诊疗一体化探针的理想材料。
在普鲁士蓝众多的合成方法中,微乳液法是一种较为新型的合成方法。微乳液是由水、油、表面活性剂和助表面活性剂按一定的比例混合形成的热力学稳定体系。在W/O型微乳液体系中,其内部的球状水滴直径通常很小(仅50~80 nm),是制备纳米材料的理想“反应容器”。与传统的合成方式相比,通过改变微乳液的体系结构可以方便地对纳米颗粒的粒径大小、形貌以及分散性进行有效控制。Mn2+掺杂的普鲁士蓝纳米颗粒因在增强磁共振成像效果的同时可以提供良好的光热治疗效果,具备向临床诊疗一体化探针转化的巨大潜力而备受关注。然而通过微乳液法对Mn2+掺杂的普鲁士蓝纳米颗粒的粒径大小进行控制合成的研究未见相关报道。本研究采用Triton X-100微乳液体系成功制备了掺杂Mn2+的普鲁士蓝纳米颗粒,利用动态光散射(DLS)、电泳光散射(ELS)、傅里叶变换红外光谱法(FTIR)、紫外吸收光谱分析(UV-vis)技术对纳米颗粒进行理化性能表征,并考察了其体外T1-T2双模态磁共振成像效果及对HepG2细胞的光热治疗效果。
1 材料和方法
1.1 材料与仪器
酶联免疫分析仪(BIOTEKELX80)、纳米粒度电位仪(布鲁克海文NanoBrook 90PlusZeta)、紫外-可见光吸收光谱仪(Thermo Fisher Evolution 300)、傅里叶红外光谱仪(Thermo Fisher Nicolet iS50 FT-IR)、手持红外热成像仪(Fluke TiS20)、激光器(长春镭锐光电科技,LR-MFJ-808/5000 mW)、倒置荧光显微镜(蔡司,Axio Observer)、小动物磁共振成像仪(7T Bruker)。Triton X-100、正己醇、环己烷、四氢呋喃、二氯化锰、氯化亚铁和铁氰化钾(艾览化工科技)。CCK-8试剂盒(同仁化学)。钙黄绿素AM/PI 检测试剂盒(活/死细胞染色试剂盒,凯基生物技术)。DMEM基础培养基、抗体(青霉素和链霉素)、胎牛血清、PBS 缓冲液、胰蛋白酶(Invitrogen Gibco)。除非另有说明,所有的试剂和溶剂均为购买获得,未经进一步的纯化而直接使用。实验中使用的水均为超纯水。人源肝癌细胞(HepG2)由南方医科大学基础医学院细胞生物学教研室赠与。
1.2 Mn2+掺杂普鲁士蓝纳米颗粒的合成及表征
1.2.1 Mn2+掺杂普鲁士蓝纳米颗粒的合成 合成方法参考文献[33],将Triton X-100、正己醇和环己烷按质量比2∶1∶1混合均匀,得到油相EAX。分别配制0.05 mol/L的MnCl2、FeCl2及铁氰化钾溶液各20 mL,再分别补充800 mg柠檬酸并超声至澄清透明。
取8 g EAX和3.330 g铁氰化钾水溶液(0.05 mol/L)混合均匀,得到微乳液1。取8 g EAX,0.666 g MnCl2水溶液(0.05 mol/L),2.664 g FeCl2水溶液(0.05 mol/L)混合均匀,得到微乳液2。在磁力搅拌的条件下将微乳液1缓慢滴加到微乳液2中,室温下反应2 h。反应完毕后置于100 ℃水中水浴15 min破乳,然后离心、洗涤并干燥得到Mn2+掺杂普鲁士蓝纳米颗粒Mn-PB NPs的粉末。
1.2.2 Mn-PB NPs理化性能检测 配制浓度为60 μg/mL的Mn-PB NPs水分散系,通过布鲁克海文NanoBrook 90PlusZeta型纳米粒度电位仪测定粒径及Zeta电位。取干燥后获得的Mn-PB NPs粉末,通过Thermo Fisher Nicolet iS50 FT-IR 型傅里叶红外光谱仪检测Mn-PB NPs的红外光谱图。
1.2.3 光热性能检测 配制不同浓度(0、10、20、40、80 μg/mL)的Mn-PB NPs 水分散系,用808 nm 激光(2.5 W/cm2)分别照射10 min,通过Fluke TiS20 红外热像仪记录过程的温度变化数值。
配制浓度为40 μg/mL的Mn-PB NPs水分散系,测定不同功率密度(1.0、1.5、2.0和2.5 W/cm2)808 nm激光照射10 min的升温数值。
配制浓度为40 μg/mL的Mn-PB NPs水分散系,以808 nm激光(2.0 W/cm2)照射10 min,然后冷却10 min为一个循环,反复循环4次,用Fluke TiS20 红外热像仪监测并记录其温度变化。
1.2.4 紫外性能检测 配制浓度为40 μg/mL的Mn-PB NPs水分散系,用Thermo Fisher Evolution 300型紫外-可见光吸收光谱仪测定光照前的紫外吸收曲线。用功率为2.0 W/cm2的808 nm NIR激光照射10 min,测定光照后的紫外吸收曲线。
1.2.5 T1-T2双模磁共振成像效果检测 配制浓度分别为320、160、80、40、20、10、0 μg/mL的Mn-PB NPs水分散系(PBS,pH=7.4),采用7T Bruker 小动物磁共振成像系统(Bruker Biospec,Billerica,MA)检测其T1和T2成像性能。常规弛豫增强快速采集序列(RARE)采集T1w与T2w像,加速因子(RARE Factor)分别为2和16,TR/TE分别为500/4和2500/50 ms。T1-map采集序列为翻转恢复序列(IR),TR/TE=10000/30 ms,TI=10、20、40、80、120、200、500、1000、1600、2000、2500、3000、4000 ms。T2-map采集序列为多层多回波序列(MSME),TR/TE=2500/30 ms,TE=90、210、330、450、570、690、810、930、1050、1170、1290、1410、1530 ms。
1.3 肿瘤细胞光热治疗研究
按89%DMEM基础培养基+10%胎牛血清+1%双抗(青霉素和链霉素)配制获得DMEM完全培养基。用DMEM完全培养基对Mn-PB NPs进行梯度稀释,获得材料浓度为0、0.0125、0.025、0.05、0.1、0.2 mg/mL的工作液1。按DMEM完全培养基:CCK-8=10:1的比例配制获得工作液2。取5 μLAM、5 μL PI及10 mL PBS混合并吹打均匀,获得工作液3。用DMEM完全培养基对Mn-PB NPs 进行梯度稀释,获得材料浓度为0、0.05、0.1、0.2 mg/mL的工作液4。
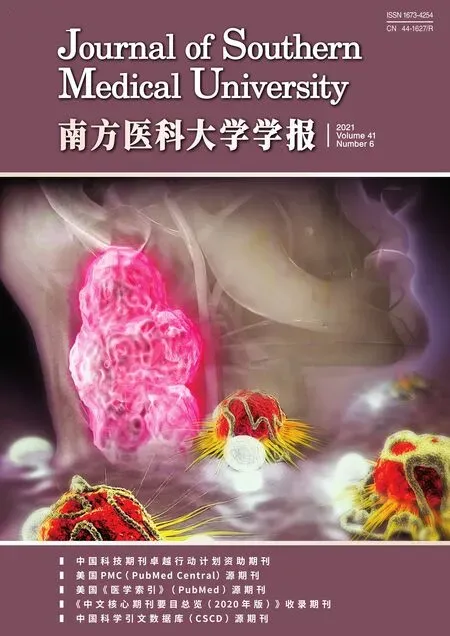
将HepG2细胞(1×104/孔)接种于96 孔板中孵育12 h,加入不同浓度的工作液1,共孵育4 h 后各孔用100 μL PBS润洗3次,并补充100 μL DMEM完全培养基,用808 nm激光(0.8 W/cm2)照射5 min,然后转移至培养箱中(37 ℃,5%CO2)继续孵育8 h。采用标准的CCK-8 法计算光热治疗后的细胞存活率:各孔经PBS润洗后,加入100 μL工作液2,转移至培养箱中孵育2 h,通过BIOTEKELX80型酶联免疫分析仪测定各组的吸光度,细胞存活率按以下公式计算获得。
将HepG2细胞(5×104/孔)接种于48 孔板中培养36 h。加入不同浓度的工作液4孵育4 h,PBS洗涤3次后各孔补充500 μL DMEM完全培养基,808 nm激光(0.8 W/cm2)照射5 min,转移至培养箱中继续孵育8 h。根据钙黄绿素AM/PI试剂盒的使用说明对细胞进行处理:各孔经PBS润洗后补充500 μL工作液3,转移至培养箱中孵育20 min,然后通过Axio Observer型倒置荧光显微镜对染色后的细胞进行拍摄分析。(AM可将活细胞染成绿色,PI可将死细胞染成红色。绿色荧光的激发波长为490 nm,发射波长为515 nm;红色荧光的激发波长为488 nm,发射波长为617 nm)
1.4 肿瘤细胞磁共振成像研究
用DMEM完全培养基对Mn-PB NPs进行稀释,获得材料浓度为0.2 mg/mL的工作液5。将HepG2细胞(1×106/瓶)接种于T75培养瓶中,培养72 h。弃去原培养液,加入工作液5后转移至培养箱中继续孵育4 h,PBS清洗3次后,加入1 mL胰蛋白酶消化80 s,然后加入2 mL DMEM完全培养基终止消化。将细胞吹打下来后转移至15 mL离心管中离心(800 r/min,3 min),获得的细胞沉淀转移至1.5 mL离心管内用于照片拍摄及细胞的磁共振成像。细胞的磁共振图像来自于7TBruker小动物磁共振成像系统(Bruker Biospec,Billerica,MA),相关参数设置与测试Mn-PB NPs水分散系的磁共振成像参数一致。
1.5 统计学方法
所有实验数据均采用SPSS 21.0 软件进行统计学分析,两组比较采用独立样本t 检验,多组比较采用Two-way ANOVA,P<0.05则认为差异具有统计学上的意义。
2 结果
2.1 Mn-PB NPs理化性能表征
Mn-PB NPs的粒径为39.46±0.42 nm,分散性指数(PDI)为0.236,Zeta电位为-25.9±1.2 mV(图1A)。Mn-PB NPs的红外光谱图显示在2075.23 cm-1处存在很强的吸收尖峰(图1B)。
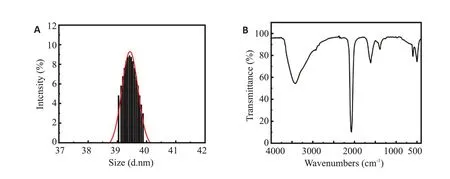
图1 (A)Mn-PB NPs在水中的粒径分布.(B)Mn-PB NPs的红外光谱图Fig.1 Particle-size distribution of Mn-PB NPs in water(A)and its infrared spectra(B).
2.2 紫外吸收光谱和光热表征
Mn-PB NPs 的紫外吸收最高峰位于713 nm,经2.0 W/cm2的808 nm激光照射10 min后,紫外吸收曲线无明显变化(图2A)。同样条件下,Mn-PB NPs水分散系的升温曲线显示,照射2 min后分散系温度迅速上升到50.4 ℃,升温幅度为20.4 ℃,该条件下超纯水组水温无明显变化(图2B)。保持Mn-PB NPs水分散系的浓度为40 μg/mL,用不同功率(1.0、1.5、2.0、2.5 W/cm2)的808 nm激光对分散系进行10 min照射(图2C),其升温速率及最高稳定温度随着Mn-PB NPs水分散系浓度的升高而提高。保持808 nm激光的功率为2.5 W/cm2,对不同浓度(0、10、20、40、80 μg/mL)的Mn-PB NPs分散系进行10 min照射(图2D),其升温速率及最高稳定温度随着激光功率的升高而提高。Mn-PB NPs分散系经过4次激光照射/关闭循环(808 nm,2.0 W/cm2,10 min),各个循环中达到的最高温度无显著变化(图2E)。
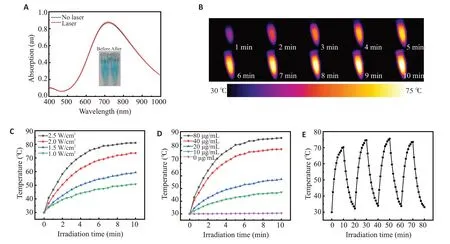
图2 Mn-PB NPs的紫外吸收光谱和光热效果图Fig.2 UV-vis absorption(A)and photothermal effect(B)of Mn-PB NPs.C,D:Photothermal heating curves.E:Temperature variations of Mn-PB NPs.
2.3 磁共振成像效果测定
梯度浓度(0~1 mmol/L)Mn-PB NPs水分散系的T1及T2加权磁共振成像结果,随着浓度的提高,磁共振成像的效果也逐渐提高(图3A、B)。数据拟合获得Mn-PB NPs水分散系的r1值为0.68(mmol/L)-1s-1,r2 值为3.65(mmol/L)-1s-1(图3C、D)。
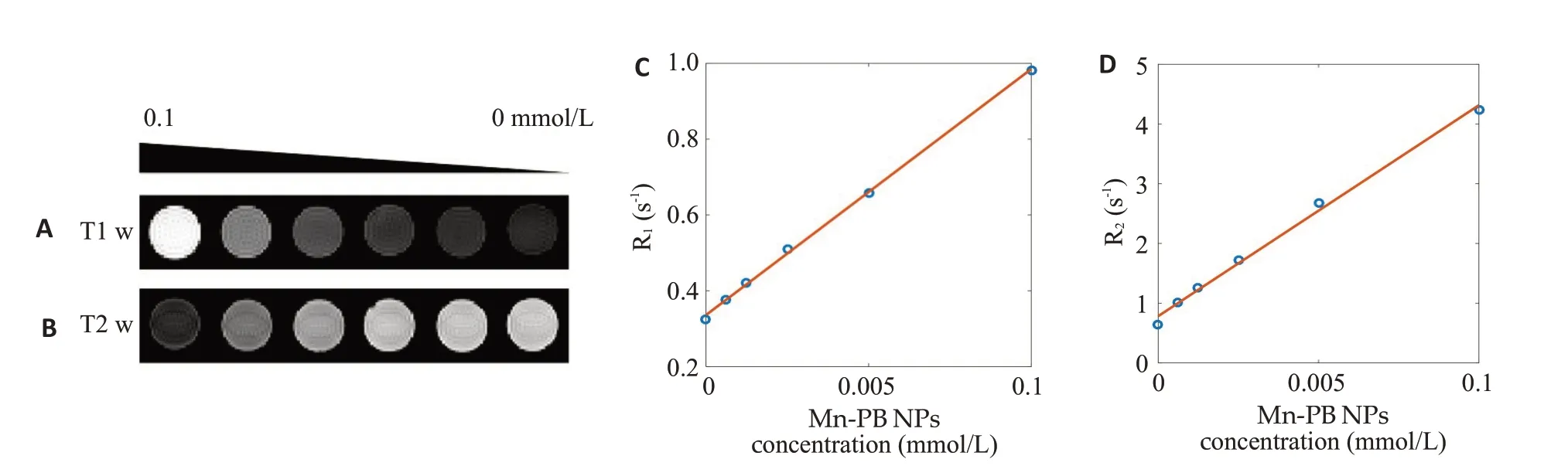
图3 梯度浓度Mn-PB NPs的(A)纵向弛豫加权成像图和(B)横向弛豫加权成像图,及其对应的(C)纵向弛豫量化曲线及(D)横向弛豫量化曲线Fig.3 T1-weighted (A) and T2-weighted (B) MR images acquired with different concentrations of Mn-PB NPs.C:Longitudinal relaxation rate quantization curve of aqueous dispersion of Mn-PB NPs.D:Transverse relaxation rate quantization curve of aqueous dispersion of Mn-PB NPs.
2.4 细胞的光热治疗
用不同浓度的Mn-PB NPs分散系与HepG2细胞共培养4 h,更换新鲜培养基后,以对照组为参考,控制光照的功率(0.8 W/cm2)和光照时间(5 min)一致。通过CCK-8法检测各组对细胞的杀伤效果,结果表明在无激光照射的条件下,各浓度组的细胞存活率均接近90%。在激光照射下,细胞的相对存活率随Mn-PB NPs分散系浓度的提高而降低,浓度为0.2 mg/mL的实验组细胞存活率仅为10%左右(图4A)。通过钙黄绿素AM/PI试剂盒对不同浓度Mn-PB NPs的光热治疗效果进行可视化测定,随着共培养Mn-PB NPs的浓度提高,视野中绿色荧光数量减少,红色荧光数量明显增加(图4B)。
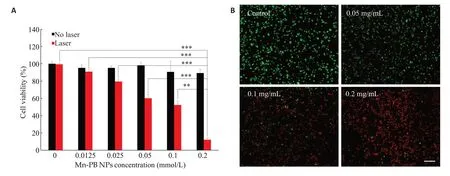
图4 体外细胞实验Fig.4 In vitro cell experiments.A:Cell viability of HepG2 cells treated with different concentrations of Mn-PB NPs before and after 808 nm NIR laser irradiation(0.8 W/cm2,5 min).(***P<0.001,**P<0.01).B:Fluorescence images of HepG2 cells irradiated with 808 nm NIR laser and stained by calcein AM/PI after treatment with different concentrations of Mn-PB NPs for 4 h(Scale bar=100 μm).
2.5 细胞的磁共振成像
用胰蛋白酶对实验组细胞(与Mn-PB NPs共培养4 h)和对照细胞组(不给药)进行消化离心后获得细胞沉淀。图5A和B分别为实验组细胞沉淀、对照组细胞沉淀和PBS的T1w和T2w成像结果。图5 C和D为与之对应的量化T1值与T2值,从结果的均值来看,PBS的T1最长(2812.97 ms),空白细胞组次之(1832.12 ms),给药细胞组最短(1126.31 ms),T2值也有着同样的趋势(349.89 ms、118.92 ms、45.19 ms)。图5E为两组细胞沉淀的对比照片。
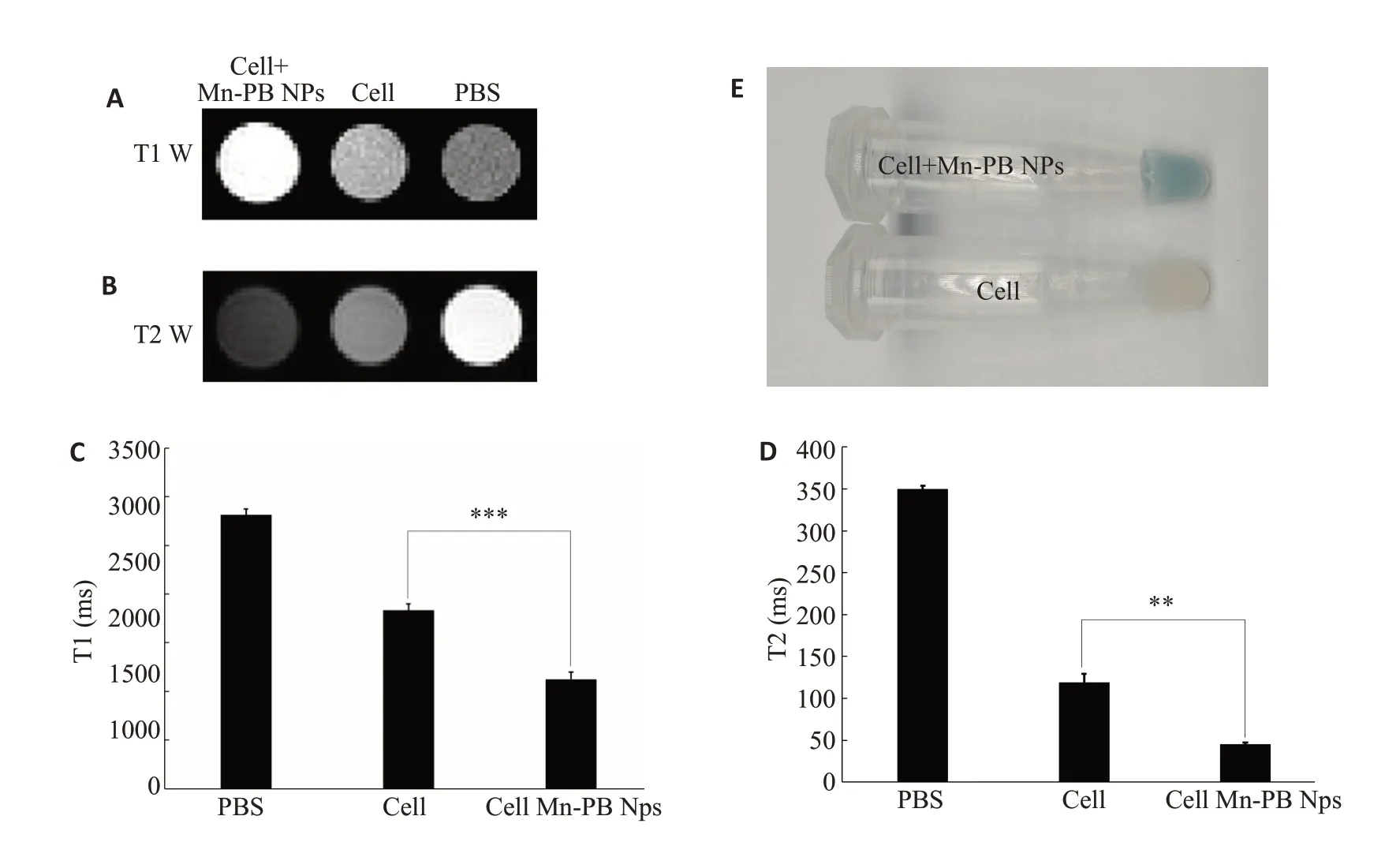
图5 经Mn-PB NPs处理过的HepG2细胞的(A)T1加权成像、(B)T2加权成像效果和其对应的(C)(D)量化柱状图,以及(E)离心所得细胞的对比照片Fig.5 T1-weighted(A) and T2-weighted(B)MR images and the corresponding quantized histograms(C,D) of HepG2 cells treated with Mn-PB NPs.E:A representative photograph of the cells obtained by centrifugation.***P<0.001,**P<0.01.
3 讨论
Guillaume等[34]通过自组装法合成了粒径为63.0±8.7 nm的普鲁士蓝纳米颗粒,Peng等[35]通过自蚀刻反应获得的普鲁士蓝纳米颗粒的粒径在100~200 nm范围之间,Zhu 等[36]则通过NaCl 沉淀法获得了粒径在50~160 nm 范围之间的普鲁士蓝。本研究通过Triton X-100微乳液体系制备的Mn-PB NPs粒径仅为39.46±0.42 nm,PDI数值为0.236,表明纳米颗粒粒径较小且分布均匀,比以上方式合成普鲁士蓝的效果都要好。红外谱图中2075.23 cm-1处存在的吸收尖峰对应着Mn-PB NPs结构中的-C≡N-伸缩振动峰。Mn-PB NPs的紫外光谱图最高吸收峰在713 nm,且在713~850 nm波长范围内仍具有较高吸收,表明材料具有成为光热制剂的潜力。808 nm激光照射前后Mn-PB NPs分散系的颜色及紫外光谱图无明显变化,且经4次激光照射/关闭循环后,分散系最高温度均保持在72 ℃左右,表明Mn-PB NPs 具有良好的光热转换能力和优异的光热稳定性能。Mn-PB NPs的梯度激光功率和梯度浓度光热实验结果显示Mn-PB NPs的光热升温效果对分散系的浓度及激光功率有依赖作用。相对于纯水,Mn-PB NPs的T1w 是亮信号,T2w 是暗信号,且随着Mn-PB NPs 浓度的增加,T1及T2的成像效果显著提高。经计算获得Mn-PB NPs 的r1 值为0.68(mmol/L)-1s-1,r2 值为3.65(mmol/L)-1s-1,证明本研究合成的Mn-PB NPs具有优异的磁共振成像效果。
鉴于Mn-PB NPs具有良好的磁共振增强效果和光热转换能力,我们对Mn-PB NPs进行了细胞成像及光热治疗的研究。在无激光照射的条件下,CCK-8法各浓度组的细胞存活率均接近90%,表明Mn-PB NPs细胞毒性较低,具有良好的生物相容性。在激光照射下,CCK-8和钙黄绿素AM/PI试剂盒检测结果均显示细胞的相对存活率随Mn-PB NPs分散系浓度的升高而降低,说明该材料具有良好的光热转换能力及优异的光热治疗效果。给药前的细胞照片无明显颜色,给药后的细胞照片则出现了明显的蓝色,证明Mn-PB NPs可以成功被HepG2细胞胞吞。细胞磁共振成像实验结果显示,胞吞了Mn-PB NPs的实验组细胞比对照组细胞具有更好的T1-T2双模磁共振成像质量,给药组细胞量化的T1及T2值显然低于未给药组,进一步表明了本研究合成的纳米颗粒对HepG2细胞具有显著的T1-T2双模磁共振增强效果。
综上,通过Triton X-100 微乳液体系制备的Mn-PB NPs具有良好的T1-T2双模态磁共振成像和光热治疗效果,为开发新型诊疗一体化探针提供了新思路。但本研究合成的Mn-PB NPs探针尚未修饰靶向肿瘤基团,也没有在动物体内开展相关的磁共振成像或光热消融肿瘤实验,缺乏探针在体内长效的稳定性和安全性评估,这些将会在后续的实验阶段进行相关探索研究。