添加氧载体对核黄素发酵的影响
吴烨飞,陆建卫,沈 波,俞海燕,俞东方,祝金山
(浙江钱江生物化学股份有限公司,浙江 嘉兴 314400)
核黄素(Riboflavin)又名维生素B2,化学名称7,8-二甲基-10-(D-1-核糖基)异咯嗪,分子式C17H20N4O6,是一种人和动植物必需的水溶性维生素[1],在医药行业[2]、养殖业[3]和种植业等领域有广泛应用[4]。目前,微生物发酵法是唯一被采用的核黄素工业化生产方法,常用的生产菌有枯草芽孢杆菌(Bacillussubtilis)、棉囊阿舒霉(Ashbyagossypii)、无名假丝酵母(Candidafamata)及阿舒假囊酵母(Eremotheciumashbya),均采用对氧气需求量极高的高密度发酵工艺[5]。高密度发酵应用广泛,对溶氧要求高[6-7],工业上通常采用更改发酵罐径高比、增大通气量、改变搅拌方式等方法增加溶氧,但这些方法不利于企业控制生产成本,且未从根本上解决核黄素高密度发酵供氧不足的问题[8]。目前,国内外对发酵生产核黄素的研究主要集中在菌种选育、培养基优化等方面,对如何改善核黄素发酵过程中的高需氧量问题鲜有报道[9]。
氧载体是一类对细胞没有毒性,比水具有更高溶氧量,且与水不互溶的有机化合物。在液态发酵体系中加入氧载体,可以降低氧气的传质阻力,改善溶氧环境,有利于发酵水平的提高[10]。任东雪等[11]在γ-聚谷氨酸发酵体系中添加体积分数10%的聚二甲氧基硅烷(PDMS),使菌体OD600提高了3~5倍,产量提高了39%。王爽等[12]研究发现:在纳他霉素发酵体系中加入体积分数6%的吐温80可促进菌体生长,同时提高纳他霉素产量82.6%。通过添加氧载体改善核黄素发酵体系溶氧环境以提高核黄素发酵水平的研究尚未见报道。
1 材料与方法
1.1 材料与仪器
1.1.1 菌 种
枯草芽孢杆菌(Bacillussubtilis)QJVB-1,浙江钱江生物化学股份有限公司保藏菌种。
1.1.2 培 养 基
种子培养基:葡萄糖20 g/L,玉米浆干粉6 g/L,尿素2 g/L,pH 6.5~6.7。
摇瓶发酵培养基/5 L罐发酵培养基:蔗糖40 g/L,黄豆粉10 g/L,玉米浆干粉10 g/L,NaCl 2.5 g/L,pH 6.5~6.7。
5 L罐补料培养基:50%(质量分数)葡萄糖。
1.1.3 仪 器
5 L发酵罐,上海保兴生物设备工程有限公司;SGD-4全自动还原糖测定仪,山东生物传感器重点实验室;紫外分光光度计,上海仪电分析仪器有限公司。
1.2 方 法
1.2.1 发酵实验
种子培养:将甘油管保存的B.subtilisQJVB-1自然解冻,吸取0.5 mL接至装有50 mL种子培养基的250 mL三角瓶,于培养箱中200 r/min,37 ℃培养20 h。
摇瓶发酵:按体积分数5%的接种量将培养好的种子液接入装有100 mL发酵培养基的500 mL三角瓶,于恒温培养箱中200 r/min,37 ℃培养72 h,定时取样测定发酵液中的生物量、葡萄糖质量浓度及核黄素质量浓度。
5 L罐发酵:接种量5%(体积分数),起始装液量50%,控制通气量1 L/min,溶氧20%~40%,pH 6.4~6.6,37 ℃培养72 h,发酵过程中通过补料控制还原糖质量分数为0.8%~1.0%。定时取样测定葡萄糖质量浓度、核黄素质量浓度和生物量等数据。
1.2.2 氧载体添加实验
1)氧载体种类对核黄素发酵的影响
按体积分数5%的接种量将种子液接入发酵培养基。在发酵4 h时往发酵培养基中分别添加体积分数1%的豆油、正十六烷、油酸乙酯和吐温80,对照组不添加氧载体(体积用蒸馏水补足),继续摇瓶发酵至72 h,发酵结束后,以各组发酵液中核黄素质量浓度及生物量为指标,挑选出优选氧载体。
2)氧载体添加量对核黄素发酵的影响
按体积分数5%的接种量将培养好的种子液接入发酵培养基,在发酵4 h时分别添加体积分数0%,1%,2%,3%,4%,5%,6%的优选氧载体,继续摇瓶发酵至72 h,发酵结束后,测定各组发酵液中的核黄素质量浓度及生物量。
3)氧载体添加时间对核黄素发酵的影响
按体积分数5%的接种量将培养好的种子液接入发酵培养基,分别于发酵0,4,8,16,20 h时添加适量优选的氧载体,继续摇瓶发酵至72 h,发酵结束后,测定各组发酵液中的核黄素质量浓度及生物量。
1.2.3 相关测定方法
1)生物量测定
采用平板菌落计数法测定发酵液中活菌数作为生物量的指标。
2)还原糖测定[13]
取1 mL发酵液于1.5 mL EP管,10 000 r/min离心3 min,取上清液,使用SGD-4全自动还原糖测定仪测定还原糖。
3)核黄素测定[14]
取发酵液1 mL于100 mL烧杯,加入2 mL冰醋酸和20 mL水,加热煮沸5 min,加适量水,冷却至室温后移入250 mL容量瓶并定容。摇匀后过滤,取滤液用分光光度计于444 nm条件下比色测定,根据标准曲线计算核黄素质量浓度。
2 结果与分析
2.1 核黄素标准曲线的测定
准确称取100 mg核黄素标准品于100 mL烧杯,加入5 mL冰醋酸和20 mL水,缓慢加热使之完全溶解,用水稀释至5,10,15,20,25 mg/L,在波长444 nm下测定吸光值。以核黄素质量浓度为横坐标,吸光值为纵坐标,得到的线性回归方程为y=0.03x+0.008,相关系数R2=0.997 6,说明在5~25 mg/L范围内线性关系良好,核黄素标准曲线见图1。

图1 核黄素标准曲线
2.2 不同氧载体对核黄素摇瓶发酵的影响
氧载体种类不同,不仅对发酵体系溶氧环境的改善能力不同,对微生物生长的影响也不同[15]。按1.2.2方法进行实验,考察了不同氧载体对核黄素摇瓶发酵的影响,结果见图2。

图2 不同氧载体对B.subtilis QJVB-1 生长及核黄素合成的影响
由图2可知:与对照组(未添加氧载体)相比,添加体积分数1%的豆油实验组和乙酸乙酯实验组显示出较高的菌体生物量和较强的核黄素生产能力。其中,豆油组生物量为1.14 Gcfu/L,较对照组提高18.8%,核黄素质量浓度11.3 g/L,较对照组提高17.7%;油酸乙酯组生物量为1.1×109cfu/L,较对照组提高14.6%,核黄素质量浓度10.9 g/L,较对照组提高17.7%。说明豆油和油酸乙酯在核黄素发酵体系中,可以降低氧气的传质阻力,有利于菌体生长以及核黄素的合成。吐温80实验组及正十六烷实验组的菌体生物量及核黄素质量浓度较对照组均有不同程度的降低,说明在实验条件下添加1%体积分数的吐温80和正十六烷不利于核黄素生产菌QJVB-1的生长和代谢。
2.3 氧载体添加量对核黄素摇瓶发酵的影响
李娜娜等[16]研究发现过量的液态烷烃不利于粘红酵母发酵产番茄红素,说明液体发酵体系中,氧载体浓度对菌体生长及目标产物的合成至关重要。综合2.2的研究结果,比较了在发酵4 h添加不同浓度豆油和乙酸乙酯对菌体生长及核黄素合成的影响,结果见图3。
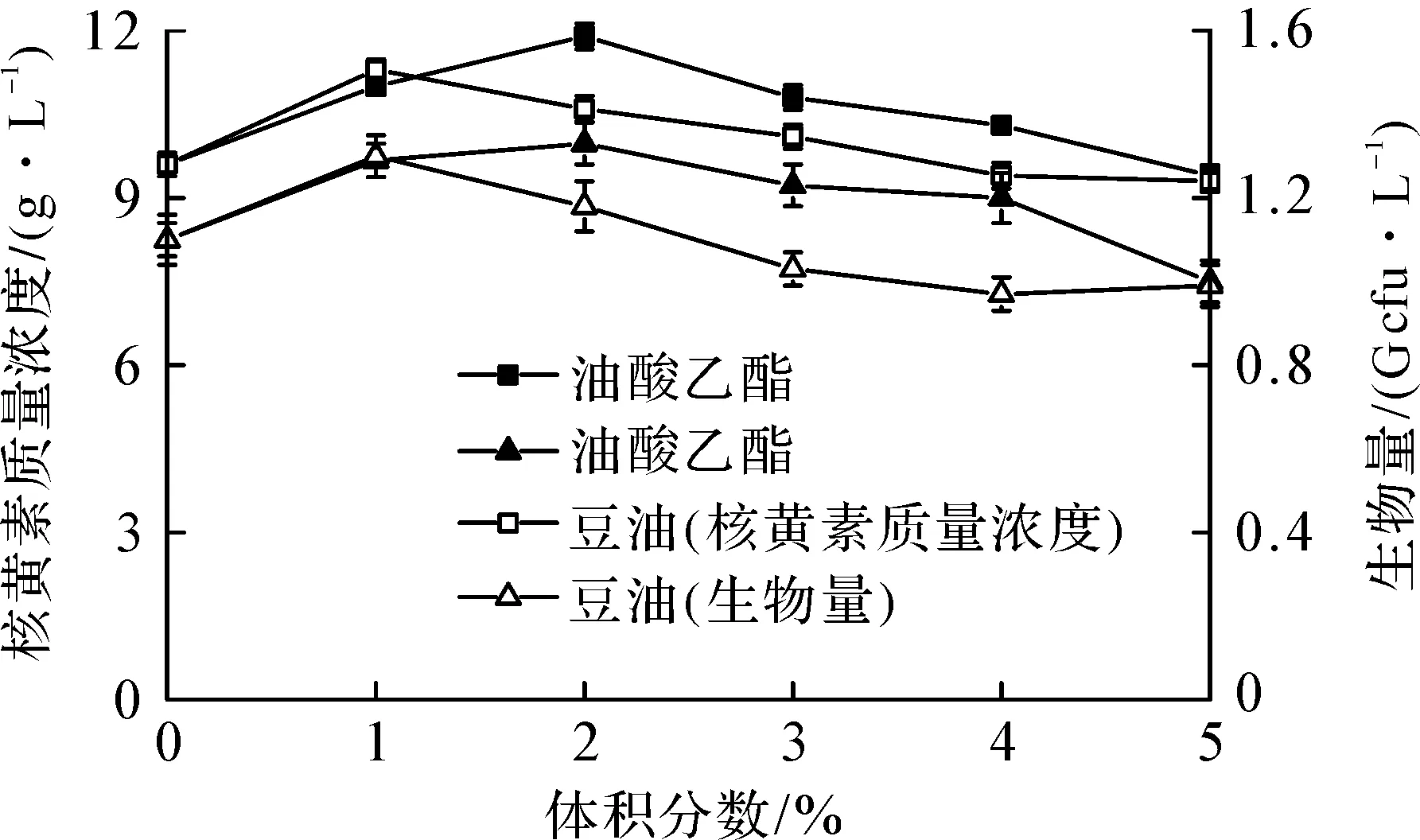
图3 氧载体添加量对B.subtilis QJVB-1 生长及核黄素合成的影响
豆油实验组结果表明:添加量为0%~5%时,菌体生物量及核黄素质量浓度均出现先升高后降低的趋势,体积分数1%的添加量最有利于菌体生长及核黄素的合成,此时生物量为1.28×109cfu/L,核黄素质量浓度为11.4 g/L,分别较未添加豆油的对照组提高17.9%和18.0%。油酸乙酯实验组表明:体积分数2%的添加量最适合菌体生长及核黄素的合成,其中菌体生物量较对照组提高18.5%,核黄素质量浓度较对照组提高20.2%,当添加量超过2%时,菌体生物量及核黄素质量浓度均呈下降趋势。结果表明:过量添加豆油和油酸乙酯会抑制QJVB-1菌的生长,不利于核黄素的合成。造成这种现象的可能原因是:过量添加油状的氧载体,会使发酵液表层形成过厚的“油膜”,造成表观黏度增大,不利于发酵液和空气之间的氧气传递,进而对菌体生长及核黄素的合成造成不利影响。
2.4 氧载体添加时间对核黄素摇瓶发酵的影响
综合2.3节,考察不同时间添加豆油或油酸乙酯对菌体生长和核黄素合成的影响,结果见图4。

图4 氧载体添加时间对B.subtilis QJVB-1 生长及核黄素合成的影响
豆油实验组结果表明:发酵4 h时添加体积分数1%的豆油表现出最强的核黄素合成能力。油酸乙酯实验组结果表明:发酵0 h时添加体积分数2%的油酸乙酯对菌体生长的促进能力最强,且核黄素质量浓度最高,达到13.0 g/L。氧载体添加时间在发酵8 h及更迟时,豆油实验组及油酸乙酯实验组的生物量及核黄素质量浓度下降趋势明显,造成这种现象的可能原因是:在高密度发酵生产核黄素过程中,菌体生长迅速,在发酵初期就需要大量氧气,较早加入氧载体可以更好地满足发酵前期菌体生长所需氧气,从而有利于菌体生长及核黄素的合成。发酵8 h及更迟的氧载体添加时间,添加时间过晚,不能满足前期菌体生长对溶氧的需求。
综合考虑豆油、油酸乙酯的添加量和添加时间对菌体生物量及核黄素合成能力的不同影响,确定在生产菌QJVB-1发酵生产核黄素的液体发酵体系中,0 h时添加体积分数2%的油酸乙酯为优选的氧载体添加方案。
2.5 优选氧载体添加方案下的核黄素摇瓶发酵曲线
比较添加优选氧载体和未添加氧载体条件下的QJVB-1摇瓶发酵曲线,结果见图5。

图5 油酸乙酯添加对B.subtilis QJVB-1核黄素摇瓶发酵的影响
由图5可知:在发酵周期内,添加油酸乙酯实验组的耗糖能力更强,生物量和核黄素质量浓度较对照组均有大幅度提高,其中最高生物量提高17.9%,核黄素终质量浓度提高26.7%,达到12.1 g/L。原因可能是:核黄素作为一种代谢产物,与生长具有相关性,菌体的生长速度、生物量和代谢强度均直接影响核黄素的生成。油酸乙酯改善了发酵环境中的溶氧,有利于核黄素生产菌QJVB-1的生长,提高了核黄素的生产能力。
2.6 优选氧载体添加方案下的5 L罐核黄素发酵曲线
发酵罐最常用的溶氧控制手段为调节通气量和搅拌速度。在恒定通气量条件下,考察核黄素发酵过程中氧载体对搅拌速度和溶氧关系的影响,结果见图6,对照组(不添加氧载体)为保证高密度发酵过程中的高溶氧环境,发酵罐搅拌速度调至800 r/min(设备的最高转速),但在发酵24 h时溶氧仍降至10%以下,发酵中后期溶氧也只能维持在20%。添加氧载体油酸乙酯后,以速度500 r/min搅拌就可在发酵24 h时溶氧达到20%,在发酵中后期将搅拌速度降至400 r/min也能维持溶氧为30%,满足菌体生长的需求,说明添加氧载体可以改善发酵体系的溶氧量。较低的搅拌速度不仅可以降低搅拌剪切力对菌体的影响,也可降低能耗。

图6 油酸乙酯添加对搅拌速度及溶氧的影响
5 L发酵罐发酵曲线见图7,添加油酸乙酯后,发酵30 h时达到最大菌体生物量2.51 Gcfu/L,较对照组提高13.5%。核黄素终质量浓度达到24.3 g/L,较对照组提高12.6%。

图7 油酸乙酯添加对5 L罐中B.subtilis QJVB-1核黄素发酵的影响
3 结 论
通过摇瓶实验比较了氧载体不同种类、添加量及添加时间对核黄素发酵的影响,确定发酵0 h时添加体积分数2%的油酸乙酯为优选氧载体添加方案。在优选氧载体添加条件下,摇瓶发酵核黄素质量浓度为12.1 g/L,较对照提高26.7%;5 L罐发酵核黄素质量浓度为24.3 g/L,较对照提高12.6%。同时,油酸乙酯对溶氧环境的改善降低了发酵过程中的搅拌速度,有利于降低搅拌剪切力对菌体的不良影响,并能为核黄素生产企业节能降耗。研究对核黄素生产成本的降低和产能的提高具有一定的意义。

