过表达骨形态发生蛋白2对骨折大鼠的骨愈合和成骨能力的影响及其可能机制▲
康 麟 曹 磊 赵秋鹤 刘雪婷
(新疆乌鲁木齐市中医医院1 骨科,2 软伤科,乌鲁木齐市 830001,电子邮箱:k56234899@163.com;3 新疆乌鲁木齐市友谊医院疼痛科,乌鲁木齐市 830001;4 新疆医科大学基础医学院,乌鲁木齐市 830011)
骨折是肌肉骨骼系统最常见的损伤之一[1-2]。有5%~10%的患者因骨折修复受损而愈合延迟或无法愈合[3],长时间的康复和持续治疗会给患者带来不必要的经济负担,并降低其生活质量。骨折愈合是骨组织细胞学、形态学和一系列复杂过程(包括体内免疫调节)的综合结果,目前骨折愈合的机理仍不确定。骨形态发生蛋白(bone morphogenetic protein,BMP)属于转化生长因子β的超家族,在骨骼发育、骨骼生长和骨折修复过程中起着至关重要的作用[4]。BMP-2位于20p12的基因组上,作为BMP家族的重要成员,其不仅参与骨骼系统的早期发育和组织构建[5],也参与诱导成骨细胞的分化和成骨细胞增强骨基质的产生[6]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联是BMP-2信号转导的另一种非典型途径。Runt相关转录因子2的表达是成骨细胞开始分化的标志,因此它是骨形成过程中最早和最具特异性的标志基因[7]。BMP-2通过激活p38 MAPK信号传导以促进Runt相关转录因子2的表达和激活[8]。研究显示,鞘磷脂磷酸二酯酶(sphingomyelin phosphodiesterase,Smpd)3在生长板发育和骨矿化中具有重要作用,此外Smpd3也是发育中的生长板中肥大软骨细胞凋亡的必需物质[9]。已有研究表明,动物骨折模型中BMP-2表达下调[10-11]。因此,本实验通过建立大鼠骨折模型,探讨BMP-2过表达对骨折大鼠的骨愈合和成骨能力的影响及其可能机制,为临床治疗骨折提供新的思路。
1 材料与方法
1.1 实验动物 60只成年雄性SD大鼠(无特定病原体级,200~220 g)购自新疆医科大学实验动物中心,动物生产许可证号:SCXK(新)2019-002。实验大鼠饲养于标准动物房中,正常饮食饮水。大鼠适应环境两周后进行实验。
1.2 主要试剂 BMP-2过表达的阴性质粒和BMP-2过表达的质粒购自中国上海基因医药生物技术有限公司。苏木精-伊红(hematoxylin-eosin,HE)试剂盒购自购自北京索莱宝生物科技有限公司(货号:AG1120)。大鼠血清白细胞介素(interleukin,IL)-6试剂盒、大鼠血清肿瘤坏死因子(tumor necrosis factor,TNF)-α和大鼠血清IL-10试剂盒购自南京凯基生物科技有限公司(货号:ZN2280-GPK、ZN2367-GPK、ZN2154-GPK)。ALP检测试剂盒购自长春汇力生技术有限公司(货号:ARB12667)。RIPA裂解液和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒购自美国Promega公司(货号:AR0105、AR1257)。BMP-2抗体购自武汉博士德工程有限公司(货号:KG22178-1)。p38 MAPK抗体、Smad1抗体、Runx2抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体和IgG-辣根过氧化物酶(horseradish peroxidase,HRP)抗体购自美国Cell Signaling Technology公司(货号:8690T、6944T、12556S、5174T、7074S)。Smpd3抗体购自美国Santa Cruz Biotechnology公司(货号:A10197)。
1.3 大鼠分组及骨折模型制备 将60只SD大鼠采用完全随机分组方法分为模型组、BMP-2过表达的阴性质粒组(pcDNA/NC组)和BMP-2过表达质粒组(pcDNA/BMP-2组),每组20只。经腹腔注射3%戊巴比妥钠麻醉各组大鼠。待成功麻醉后,在大鼠皮肤外侧做一个10 mm的切口,用钝器解剖暴露肌肉后暴露右股骨干,于股骨中段用线锯将股骨横行切断,并将髓内固定针逆行插入骨折近端,从股骨大转子穿出,生理盐水洗净伤口后逐层缝合。术后给予大鼠经腹腔注射青霉素(100 000 IU/mL)1 mL/kg,1次/d,连用3d,清洁级环境下单笼饲养。
1.4 给药方法 骨折造模24 h后,给予模型组大鼠经尾静脉注射磷酸缓冲盐溶液100 μL,pcDNA/NC组经尾静脉注射BMP-2过表达的阴性质粒溶液100 μL,pcDNA/BMP-2组经尾静脉注射BMP-2过表达质粒溶液100 μL。49 d后,经腹腔注射3%戊巴比妥钠麻醉处死大鼠,取材,进行相应指标检测。
1.5 观察指标检测
1.5.1 X线片:分别于术后第 1周、第4周、第7周周末对各组大鼠进行X线(多功能X线机诊断计量仪,德国QUART公司,型号:32)检查,观察各组大鼠骨折线的变化及达到骨性愈合的时间,骨性愈合的判断标准为骨折间隙中可见新的骨形态形成。
1.5.2 mirco-CT参数:实验结束后,取出各组大鼠股骨并在4%多聚甲醛中固定24 h后,使用micro-CT系统[布鲁克(北京)科技有限公司,型号:Bruker SkyScan 1174]以50 kV和200 μA的9 μm分辨率分析骨密度、骨体积分数(bone volume density,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)和骨小梁数量(trabecular number,Tb.N)。
1.5.3 蕃红O染色:各组大鼠的股骨组织经固定、包埋、切片后,将切片在二甲苯中脱蜡,于梯度浓度的乙醇(100%,5min;95%,2 min;85%,2 min;75%,2 min)中脱水。然后将切片用苏木精染色5 min,在流动的自来水下清洗10 min,用1%乙酸溶液快速冲洗15 s,然后在0.1%番红O溶液中染色5 min。将切片脱水并用95%乙醇,无水乙醇和二甲苯透明,之后使用中性树胶封片,于光学显微镜下观察切片并拍照。
1.5.4 酶联免疫吸附法检测:实验结束后,心尖取血,置于离心管中,3 000 r/min 离心15 min,吸取上层血清100 μL。按照酶联免疫吸附法检测试剂盒说明书进行操作,于酶标仪450 nm波长处依序测定各孔的光密度(OD值),根据OD值所绘制的标准曲线计算血清IL-1β、TNF-α和IL-6的表达水平。同时按照上述方法,使用ALP酶联免疫吸附测定试剂盒检测血清中ALP的表达水平。
1.5.5 蛋白免疫印迹法检测:实验结束后,取各组大鼠骨折部位周围骨组织,用RIPA裂解液提取蛋白,用BCA法测定总蛋白含量。行SDS-聚丙烯酰胺凝胶电泳分离蛋白,并将蛋白转移到聚偏二氟乙烯膜上。在室温下用5%脱脂奶封闭1 h后,将聚偏二氟乙烯膜与BMP-2抗体(1 ∶1 000)、p38 MAPK抗体(1 ∶1 000)、Smpd3抗体(1 ∶1 000)、Smad1抗体(1 ∶1 000)、Runx2抗体(1 ∶1 000)和GAPDH抗体(1 ∶2 000)在4℃孵育过夜。随后,将聚偏二氟乙烯膜用TBST洗涤3次,5 min/次,并与IgG-HRP(1 ∶5 000)室温孵育1 h,用TBST洗涤3次,5 min/次。最后显影曝光,用Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。以GAPDH为内参蛋白,利用Image J软件对蛋白条带进行灰度分析,计算目的蛋白表达水平。
1.6 统计学分析 采用SPSS 19.0软件进行数据分析。正态分布计量资料以(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组大鼠股骨创伤处X线检查结果 X线片结果显示,模型组和pcDNA/NC组大鼠在第7周时骨折未能完全愈合,而pcDNA/BMP-2组大鼠在第7周时骨折完全愈合,见图1。
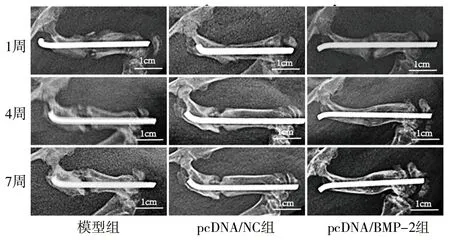
图1 3组大鼠股骨创伤处X线片
2.2 3组大鼠股骨创伤处micro-CT图像及参数 模型组和pcDNA/NC组观察到明显的骨折间隙,而在pcDNA/BMP-2组大鼠的骨折间隙中可见新的骨形态形成,见图2。与模型组和pcDNA/NC组相比,pcDNA/BMP-2组大鼠的骨密度、BV/TV、Tb.Th和Tb.N均升高(均P<0.05),见表1。
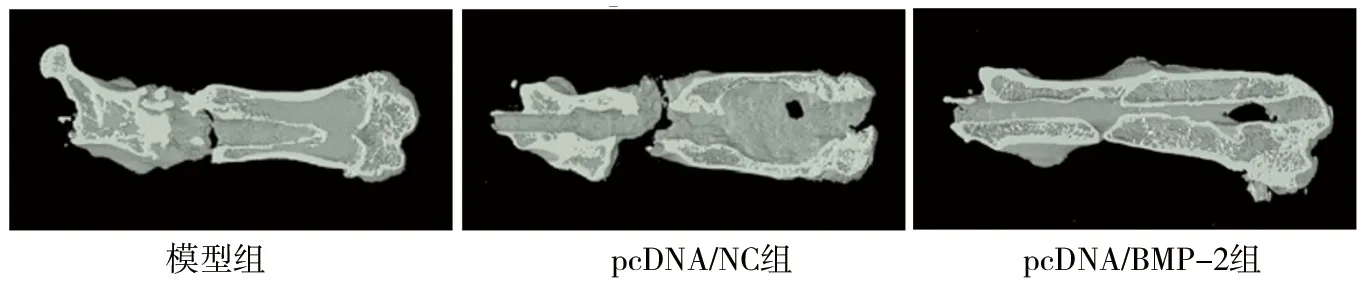
图2 3组大鼠股骨创伤处micro-CT图像
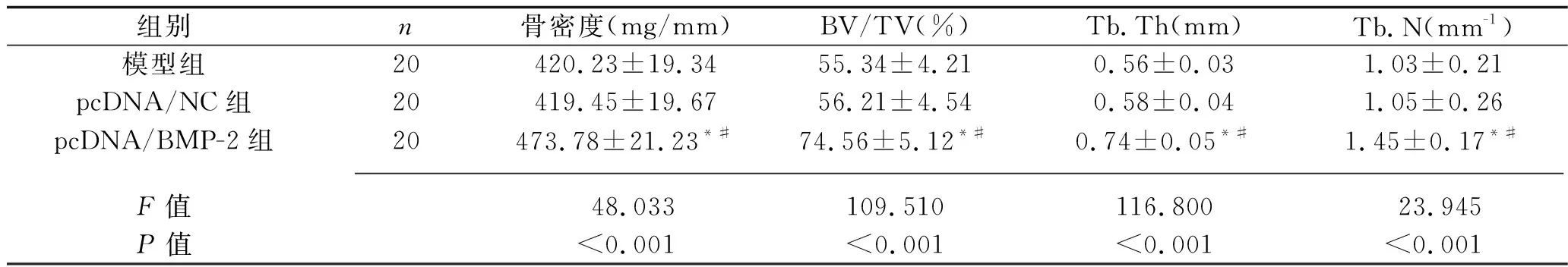
表1 3组大鼠骨折愈合相关指标的变化(x±s)
2.3 3组大鼠股骨创伤处病理变化 蕃红O染色结果显示,在模型组和pcDNA/NC组中,股骨的骨折部位有大量的软骨组织和滑膜形成,而在pcDNA/BMP-2组中股骨骨折部位观察到编织骨,见图3。与模型组和pcDNA/NC组相比,pcDNA/BMP-2组大鼠股骨的骨折愈合有明显改善。
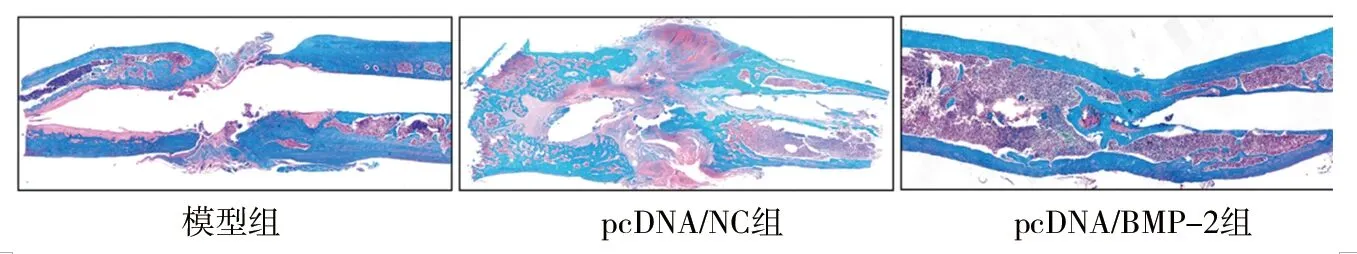
图3 3组大鼠股骨创伤处病理变化(蕃红O染色,×200)
2.4 3组大鼠血清IL-6、TNF-α、IL-10和ALP水平的比较 与模型组和pcDNA/NC组相比,pcDNA/BMP-2组大鼠血清中IL-6、TNF-α水平均下降(P<0.05),IL-10、ALP水平升高(均P<0.05),见表2。
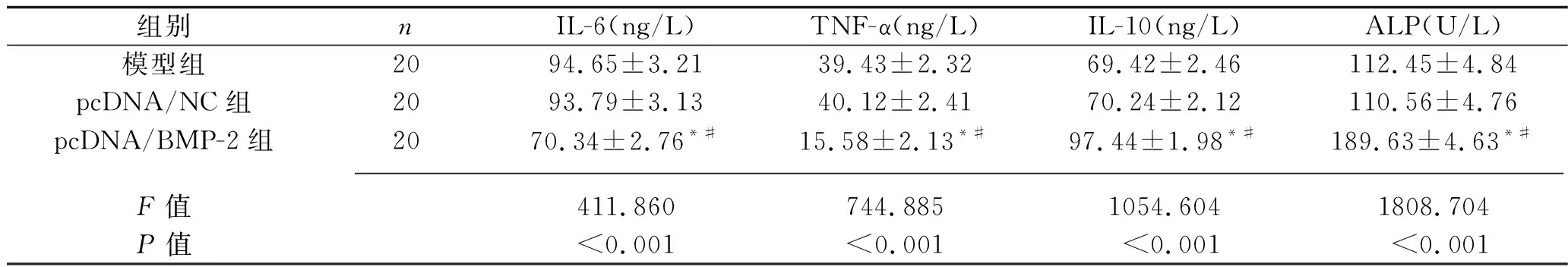
表2 3组大鼠血清中IL-6、TNF-α、IL-10和ALP水平比较(x±s)
2.5 3组大鼠骨组织中BMP-2、Smad1和Runx2蛋白的表达 与模型组和pcDNA/NC组相比,pcDNA/BMP-2组中BMP2、Smad1和Runx2的蛋白相对表达水平升高(均P<0.05),见图4及表3。
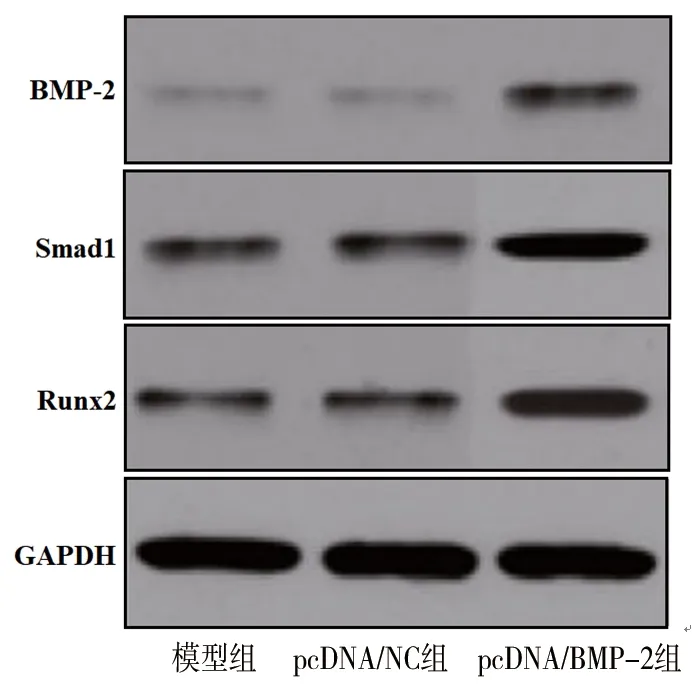
图4 3组大鼠骨组织中BMP-2、Smad1和Runx2蛋白的表达
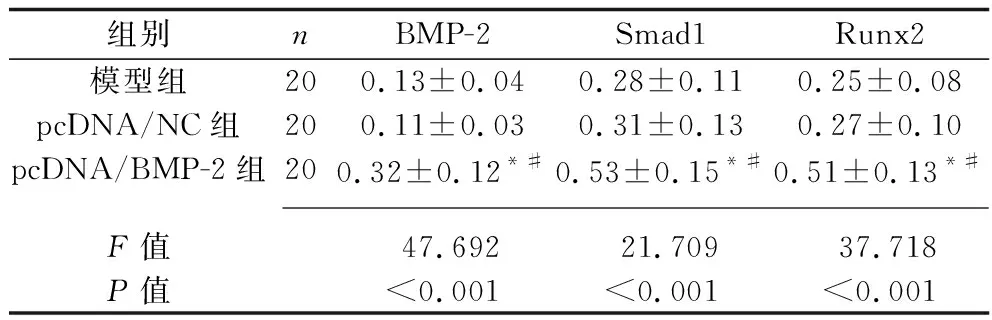
表3 3组大鼠骨组织中BMP-2、Smad1和Runx2蛋白的相对表达水平(x±s)
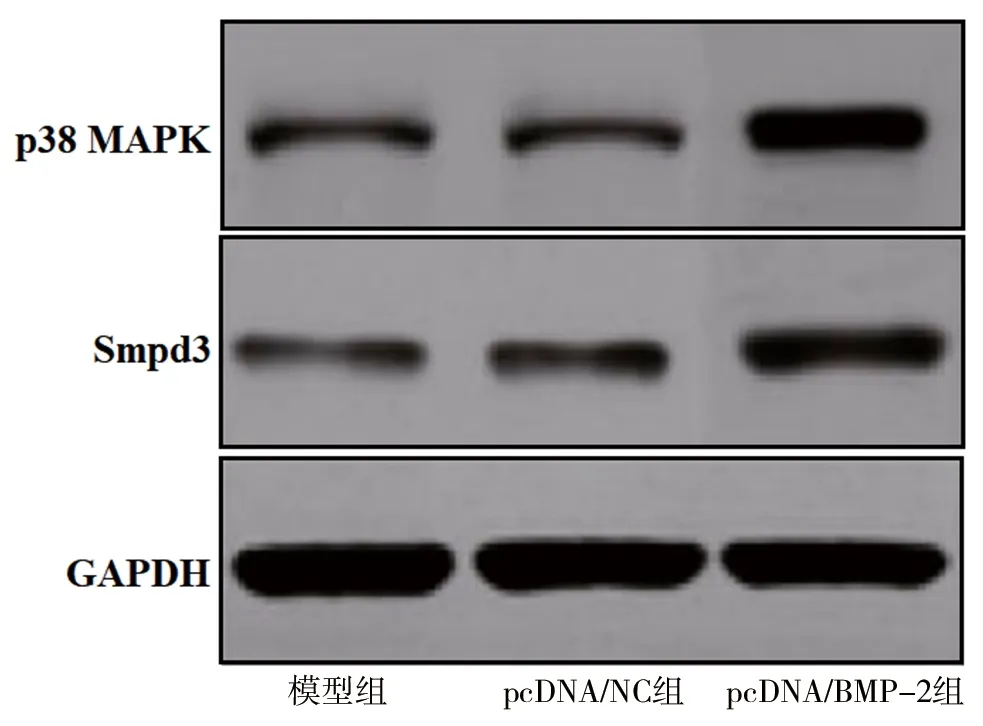
图5 3组大鼠骨组织中p38 MAPK和Smpd3蛋白的表达

表4 3组大鼠骨组织中BMP-2、p38MAPK和Smpd3蛋白的相对表达水平(x±s)
3 讨 论
骨折愈合是一系列复杂的生化反应的结果,通常与年龄、性别和健康状况有关[12]。在细胞水平上,骨折愈合指的是骨细胞的再生,骨折部位周围组织和细胞分泌的相关细胞因子和营养均可促进骨细胞的再生。近年来,在探索骨折愈合的分子机制方面取得了某些进展,然而在信号转导过程中其特定的信号通路和相关的基因功能仍未清楚[13]。BMP-2是一种重要的分化因子,能够通过间充质干细胞的趋化性、迁移、增殖和分化促进软骨内骨化,从而诱导骨再生,使其具有潜在的成骨活性,在骨折和骨缺损治疗中刺激新骨生长[14]。本研究探讨BMP-2过表达对骨折大鼠的骨愈合和成骨能力的影响,并分析其可能机制。
骨创伤修复时,骨母细胞、软骨母细胞、血管骨内皮等均合成ALP[15]。成骨细胞分泌的ALP可以渗入血液,使血液中ALP水平增加。因此,血清ALP可作为骨重建活跃情况的标志物[16]。本实验结果显示,过表达BMP-2的大鼠在第7周时骨折完全愈合,骨密度、BV/TV、Tb.Th和Tb.N均升高,且血清中ALP活性升高,这提示BMP-2的过表达可促进骨折愈合的进程。
骨折后局部形成血肿机化组织,先天免疫细胞浸润骨折部位并分泌炎性细胞因子,以刺激修复细胞进一步募集到骨折部位[17]。参与骨折愈合的细胞因子主要包括促炎性因子(TNF-α、IL-1和IL-6)和抗炎性因子(IL-10),它们在炎症早期和创伤愈合组织重塑阶段都具有独特的激增模式[18]。本实验结果显示,BMP-2过表达可使骨折大鼠血清IL-6、TNF-α水平下降,IL-10水平升高,这提示BMP-2过表达可降低炎症因子的水平,从而促进骨愈合。
BMP2/Smad1/Runx2途径参与了骨髓间质干细胞的增殖和成骨分化,Runx2是骨形成的关键因素[19]。Smad蛋白与Runx2相互作用,参与成骨细胞表型基因的表达和分化,两者共同调节成骨细胞中胶原蛋白的表达[20]。本实验结果提示,过表达BMP-2可使骨折大鼠骨组织中Smad1和Runx2的表达水平明显增加。这表明,BMP-2过表达可通过上调Smad1和Runx2的表达以促进骨细胞中胶原蛋白的形成,从而促进骨愈合。
研究表明,BMP-2可激活p38 MAPK途径;相反,p38 MAPK也需要通过BMP-2诱导成骨细胞表型,从而导致体外矿物质沉积[21]。Smpd3是一种脂质代谢酶,也是骨骼发育的关键调节剂[22]。本实验结果表明,过表达BMP-2使骨组织中p38 MAPK和Smpd3的表达水平明显增加。因此,过表达BMP-2可进一步促进成骨细胞的形成,从而加快骨折愈合。
综上所述,过表达BMP-2可促进大鼠骨折愈合,这可能与BMP-2可下调炎症因子的表达,上调Smad1和Runx2的表达以促进骨细胞中胶原蛋白的形成,以及通过p38 MAPK积极上调Smpd3的表达有关。因此,BMP-2在骨折愈合中发挥着重要作用,可为临床治疗骨折提供新的思路。

