西北某油田一株硫化氢产生菌的筛选及其活性抑制
王堑傧,郁梦雅,魏 宠,杨春璐,史荣久,韩斯琴,张 颖
(1.辽宁大学环境学院,沈阳 110036;2.中国科学院沈阳应用生态研究所,沈阳 110016)
向油藏中注水来提高原油采收率(简称水驱)是原油开采非常重要且核心技术之一[1-2].但是,硫酸盐还原菌(SRB)能利用随注入水进入的硫酸盐及其他含硫化合物进行生长和代谢,产生H2S,导致油藏酸败[3~6].酸败过程对油田开发产生多种危害,例如,SRB可引发或促进金属管线等设施腐蚀[7];硫化氢是有毒有害气体,对人身健康和生命安全具有潜在威胁;油气中增加的硫化氢会降低油气价值,增加后续的加工成本.因此,深入认识引发油藏酸败的微生物的特征与代谢机制,研发有效的防控技术对油田开发具有重要意义.
长期以来,SRB一直被认为是引发油田酸败的主要微生物类群.但是近年来已有研究显示,有些油田中的微生物不能利用硫酸盐(即“非硫酸盐还原菌”),而能够利用单质硫、硫代硫酸盐等产生硫化氢.考虑到油藏环境的巨大异质性和微生物组成的复杂多样性,深入认识这些非SRB及其活性抑制对于油田酸败控制具有重要价值.
目前,油田企业主要采用向注入水中投加化学杀菌剂的方法控制油藏酸败[5-6].但是,长期使用同一种化学杀菌剂会使细菌产生耐受性,造成使用剂量加大、费用增高的后果[8].此外,环境法规的限制和对环境敏感地区油库的开发刺激了易于降解的“绿色”杀菌剂的研究与使用[9],许多毒性大的杀菌剂在应用上受到严格限制.因此,筛选高效、低毒、低成本的杀菌剂仍具有持续的需要.杀菌剂筛选与使用受SRB种类及代谢活性、油藏水质环境等因素影响[3,10].在油田环境中,由于环境复杂性导致微生物群落结构组成具有很大的差异[11],同一种杀菌剂的使用对于油藏酸败的控制效果具有不确定性.鉴于此,在深入了解特定油田硫化氢产生菌(SPB)生理生态学基础上,针对特定微生物种群进一步开展杀菌剂筛选与效果评价,是提高油藏酸败控制技术效果的关键[12-13].
前期调研结果显示,我国西北某油田多数油井经长期水驱采油后,井口采出水中H2S浓度大于50 mg/L,油田酸败特征明显.本文采用Hungate厌氧纯培养技术从典型酸败油井采出水中成功分离得到了一株优势的硫化氢产生菌WX-1,通过16S rRNA基因测序并结合菌株生理生化特性分析初步确定该菌株的系统发育地位;重点评价了2种抑菌剂及5种杀菌剂对该优势SPB生长及产H2S活性的抑制效果.本文研究结果拓展了我国油田酸败微生物成因的理论认识,并为酸败防控提供了技术支撑.
1 材料与方法
1.1 油田采出水的采集与预处理
从西北某油田一口发生严重酸败的采油井采集采出液.用预先除菌的高密度聚乙烯塑料桶(10.0 L)从采出井采集采出液(原油与采出水的混合物),完成取样后迅速加盖密封,然后尽快运回实验室.样品到达实验室进行油水分离后,将油井采出水进行混合用于SPB菌株筛选和水质基本理化性质测定.表1为油井采出水的基本理化性质.

表1 西北某油田1口酸败油井采出水的基本理化性质Tab.1 Characteristics of the produced water from a soured well of an oilfield in northwest China
1.2 培养基
将STM培养基[14]适当改进后富集筛选采出水中的硫化氢产生菌.改进后的培养基(简称M)成分为:乳酸钠(50%)2.5 g/L,NH4Cl 1.0 g/L,Na2SO41.0 g/L,酒石酸钾钠1.0 g/L,MgSO4·7H2O 0.5 g/L,K2HPO4·3H2O 0.5 g/L,酵母膏0.5 g/L,Na2S2O30.2 g/L,柠檬酸铁铵0.2 g/L,NaCl 7.0 g/L,抗坏血酸0.1 g/L.在培养基M中按1.8%的比例加入琼脂条即为固体培养基.培养基的终pH为7.0~7.2.在1×105Pa条件下,高温蒸汽灭菌30 min.
基础培养基(简称N)成分为:乳酸钠(50%)2.5 g/L,Na2S2O31 g/L,酵母膏1 g/L,KH2PO40.5 g/L,NaCl 7.0 g/L,抗坏血酸0.1 g/L.培养基的终pH为7.0~7.2.在1×105Pa条件下,高温蒸汽灭菌30 min.该培养基N用于SPB纯菌株的唯一电子供体、受体利用及影响因子实验(详见1.3.3节).使用培养基N评价菌株可利用电子供体及影响因子实验时,在灭菌后的培养基N内另补充过0.22μm滤膜的4 g/L硫酸亚铁铵溶液0.2 mL.使用培养基N评价纯菌株电子供体利用试验时,用等量的待评测电子供体取代乳酸钠;评价纯菌株电子受体利用试验时,用等量的待评测电子受体取代硫代硫酸钠;通过调节培养基N中的NaCl浓度和pH梯度,评价SPB纯菌株在不同矿化度或pH条件下的生长特性.培养基的配制、分装、灭菌等过程均按照厌氧微生物培养基制备方法完成[15].厌氧瓶或厌氧管顶空气体均为高纯氮气(N2纯度≥99.99%).以上所有试剂均为分析纯等级.
1.3 SPB分离筛选、优势菌株的生理特性及初步鉴定
1.3.1 SPB富集与菌株分离筛选 用无菌注射器取5 mL采出水混合物转接至已灭菌的95 mL液体培养基M的厌氧瓶中进行富集,然后将厌氧瓶置于37℃生化培养箱中恒温静止培养.待厌氧瓶内液体培养基变黑(5 d;形成的FeS黑色沉淀表明菌株的生长)后,取厌氧瓶内富集好的液体培养液1 mL,用9 mL生理盐水进行10倍梯度稀释(最低稀释度为10-5),采用Hungate滚管法[16]分离筛选SPB纯菌株.在超净台内挑取厌氧管内生长良好的SPB菌落,将其接种至含有10 mL液体培养基M的厌氧管中再次培养;为了获得SPB纯菌株,待厌氧管内液体培养基变黑后,重复梯度稀释、滚管分离、液体培养等步骤至少3次,直至获得SPB纯菌株(通过光学显微镜镜检与16S rRNA基因测序判定).
1.3.2 SPB菌株16S rRNA基因序列分析 筛选分离获得的SPB纯菌株基因组DNA由天跟生化科技有限公司细菌基因组DNA提取试剂盒(DP302)提取.采用NanoDrop 2000(Thermo,USA)检测提取菌株的DNA纯度与浓度.采用细菌通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)扩增SPB菌株的16S rRNA基因片段.PCR扩增反应条件为:95℃预变性5 min;94℃变性1 min,55℃退火30 s,72℃延伸2 min,35个循环后再在72℃延伸10 min.在80 V电压下使用1.5%琼脂糖凝胶电泳检测扩增产物是否有条带产生.将扩增成功的PCR产物送至北京六合华大基因科技股份有限公司进行测序.获得的序列经拼接、去除载体序列等处理后,通过BLASTn程序在GenBank数据库(www.ncbi.nlm.nih.gov)进行序列相似性比对分析.通过比对结果选取菌株近缘序列后,采用MEGA X软件的Neighbor-Joining方法构建系统发育树,Bootstrap值设为1000.
1.3.3 优势SPB菌株细胞形态与生理生化特性评价 选取1.3.2节中所获得的最优势“种”所对应的SPB纯菌株,通过扫描电镜进行菌株形态学观察.扫描电镜的菌液前处理步骤为:收集适量体积的对数生长期SPB菌液,在10 000 g离心15 min,用生理盐水重悬润洗菌体,重复离心、洗涤步骤3次;置于2.5%戊二醛磷酸钠缓冲液中,于4℃固定过夜;次日以0.5%戊二醛磷酸钠缓冲液重悬清洗菌体,然后依次使用40%、70%、90%、100%乙醇溶液分别脱水处理15 min,脱水后使用冷冻保护剂叔丁醇置换乙醇,于12 000 g条件下离心15 min后,将样品于真空冷冻干燥机中冷冻干燥,镀膜处理后通过扫描电镜(Quanta 250,Holland,荷兰飞利浦公司)查看菌株形态并拍照.SPB纯菌株扫描电镜拍照在中国科学院沈阳应用生态所分析检测中心完成.
参照文献[17-18]完成优势SPB纯菌株生理生化特性评测.待评测的唯一电子供体(碳源)包括D-果糖、葡萄糖、甘油、蔗糖、乳糖、乳酸钠、甲酸钠、乙酸钠、丙酸钠、柠檬酸钠、丙酮酸钠、0.5%原油;待评测的唯一电子受体包括Na2SO3、Na2SO4、Na2S2O3、单质硫、NaNO3、NaNO2.当评测NaNO3、NaNO2时,SPB菌株不会产生H2S即菌液观察不到变黑,此时采用监测零时和第30 d时菌液OD600的变化.此外,使用培养基N考察温度、pH、矿化度(以NaCl计)对优势SPB菌株生长及产H2S代谢活性的影响.共设4个温度梯度,分别为14℃、37℃、45℃、60℃;使用HCl或NaOH调节培养基初始pH,分别为3.0、5.0、7.0、8.0、9.0、10.0;通过调整培养基内NaCl浓度至0%、0.5%、1%、3%、5%、10%、15%、20%,考察菌株的耐盐性.生理生化特性试验中,所有实验处理的接菌量为5%,同时设“不接菌”的对照处理;当评测唯一电子供体、电子受体时,同时设“不接菌”和“接菌但不添加待评测电子供体或电子受体”的对照处理.所有处理均设2个重复.除了温度影响评价试验外,所有实验处理组均置于37℃生化培养箱中静止恒温培养.第30 d时取样测定厌氧管内菌液中H2S质量浓度.
1.4 不同杀菌剂及硝酸盐、亚硝酸盐添加对优势SPB菌株产H2S活性的影响
选取五种化学杀菌剂,即戊二醛、次氯酸钠(NaClO)、溴硝醇、四羟甲基硫酸磷(Tetrakis-hydroxymethyl phosphonium sulfate,THPS)和苄基三甲基氯化铵(benzyl trimethyl ammoniumchloride,BTAC),各设5个浓度梯度,评价不同杀菌剂不同使用剂量对优势SPB菌株产H2S活性的影响;另设5个不同浓度梯度的硝酸钠及亚硝酸钠,评价不同使用剂量对优势SPB产H2S活性的影响(表2).以5%的接种比例取对数生长期的优势SPB菌液,所有厌氧管于37℃生化培养箱内恒温静止培养35 d,定期取样测定H2S质量浓度变化.所有试验组均设置3个平行.
1.5 分析测定
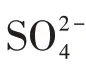

表2 五种不同杀菌剂及硝酸盐、亚硝酸盐的评测浓度Tab.2 Concentrations of five biocides,nitrate and nitrite used for test
2 结果与分析
2.1 西北某油田采出水中的优势SPB菌株筛选
采用厌氧Hungate纯培养技术,从采出水样品中成功筛选到了28株SPB纯菌株.经NCBI测序比对结果显示,这28株纯菌株属于4个不同的“种”,分别包含16个、4个、7个和1个菌株.从包含菌株数量最多的组别中挑选1个菌株作为优势菌株进行后续研究,优势菌株编号为WX-1.
2.2 菌株WX-1的细胞形态、系统发育关系及生理生化特性
WX-1在固体培养基M上生长时外观为黑色圆形菌落;扫描电镜结果如图1所示,WX-1细胞呈球形,平均直径约为0.48μm.

图1 扫描电镜下硫化氢产生菌菌株WX-1细胞形态Fig.1 Scanning electron micrograph of SPB strain WX-1

图2 以16S rRNA基因序列为基础的菌株WX-1的系统发育树Fig.2 Phylogenetic tree of strain WX-1 constructed by neighbor-joining method with 16S rRNA gene sequences
图2为基于16S rRNA基因序列信息构建的系统发育树.WX-1与Anaerosolibacter carboniphilus16S rRNA基因序列的序列相似性最高达99%.该结果表明两者的亲缘关系最近.
如表3所示,本试验选取了12种电子供体及6种电子受体进行评测.结果显示:菌株WX-1能利用12种电子供体进行生长代谢,其中最适碳源为丙酸钠;能利用Na2S2O3、单质硫为唯一电子受体产H2S,当Na2SO4、Na2SO3、NaNO3和NaNO2作为唯一电子受体进行试验时,菌株WX-1不能生长代谢;菌株WX-1具有运动性,胞内氧化酶及过氧化氢酶均为阳性,能产生吲哚,可以利用柠檬酸盐,糖发酵试验为阳性.

表3 菌株WX-1的基本生理生化特性Tab.3 Physio-biochemical characteristics of isolate WX-1
2.3 温度、pH及矿化度对WX-1生长及产H2S活性的影响
图3所示为不同环境条件对菌株WX-1产H2S活性影响.WX-1能够在37℃~45℃生长且产生H2S;第30 d时,在37℃条件下厌氧管内WX-1产H2S的质量浓度最大,提示它的最适生长温度为37℃;在4℃和60℃的条件下,菌株WX-1生长非常缓慢,几乎没有H2S产生.在37℃条件下,菌株WX-1在pH为7~10的范围内均能生长且产生H2S;第30 d时,WX-1在pH为7时厌氧管内产生H2S的质量浓度最大,提示它的最适pH为7.在37℃条件下,菌株WX-1的生长不需要钠离子,在NaCl浓度为0%~5%的范围内均能生长且产生H2S,但在NaCl浓度为10%及以上条件下菌株WX-1不能产H2S;第30 d时,WX-1在NaCl浓度为3%的厌氧管内产H2S的质量浓度最大,提示它的最适矿化度为3%.

图3 温度、pH及矿化度对菌株WX-1产H2S活性的影响Fig.3 Effects of temperature,pH and salinity on the H2S-producing activity by isolate WX-1
2.4 添加不同杀菌剂对WX-1产H2S活性的影响
添加不同浓度的戊二醛对菌株WX-1产H2S活性的影响如图4 a所示.终质量浓度为40 mg/L的戊二醛仅能抑制WX-1产H2S的活性7 d,在14 d时该处理组内H2S质量浓度已经超过阳性对照组内H2S的产生量;终质量浓度为60 mg/L和80 mg/L的戊二醛均能够抑制WX-1产H2S的活性14 d,14 d后无法抑制住H2S的产生.该结果表明,终质量浓度为80 mg/L的戊二醛不能够长期抑制WX-1产H2S的活性.
添加不同浓度的次氯酸钠对菌株WX-1产H2S活性的影响如图4 b所示.添加终质量浓度为400 mg/L的次氯酸钠时,在不同时间节点厌氧管内H2S质量浓度值与阳性对照组具有显著性不同(P<0.05),但该浓度的次氯酸钠仍无法抑制住菌株WX-1生长代谢.第35 d时,添加100~400 mg/L的次氯酸钠的各处理组厌氧管内H2S质量浓度均能达到11 mg/L左右.该结果表明,菌株WX-1对次氯酸钠具有一定的耐受能力.
如图4 c所示,使用10 mg/L及以上质量浓度的溴硝醇时,菌株WX-1产H2S的活性被抑制超过35 d.该结果表明,菌株WX-1对溴硝醇比较敏感,溴硝醇具有高效抑制西北某油田微生物酸化的潜力.
添加不同浓度的THPS对菌株WX-1产H2S活性的抑制效果如图4 d所示.尽管加入50 mg/L的THPS后不同时间节点厌氧管内H2S质量浓度与对照组具有显著性差异(P<0.05),使用终质量浓度为50 mg/L的THPS仍无法有效抑制WX-1的产H2S活性.当THPS的终质量浓度高于100 mg/L时,菌株WX-1的产H2S活性被有效抑制,WX-1在35 d的实验周期内没有H2S产生.该结果表明,THPS也具有高效抑制西北某油田微生物酸化的潜力.
添加不同浓度的BTAC对菌株WX-1产H2S活性的影响如图4 e所示.添加终质量浓度高达200 mg/L的BTAC也无法抑制住WX-1的产H2S活性.

图4 不同杀菌剂对菌株WX-1产H2S的抑制效果Fig.4 Efficacies of biocides to inhibit the H2S production by isolate WX-1
2.5 添加硝酸盐及亚硝酸盐对WX-1产H2S活性的影响
添加不同浓度的硝酸盐对菌株WX-1产H2S活性抑制效果如图5 a所示.终质量浓度200~600 mg/L的硝酸钠无法抑制菌株WX-1产生H2S.尽管添加终质量浓度为1000 mg/L的硝酸钠后不同时间节点厌氧管内H2S质量浓度值与不加硝酸盐的阳性对照组具有显著性不同(P<0.05),该质量浓度的硝酸盐仍无法抑制住菌株WX-1的产H2S活性;第35 d时仍能检测到厌氧管内H2S产生,但同阳性对照组相比,H2S质量浓度大大降低.该结果表明,高浓度的硝酸盐虽无法完全抑制住菌株WX-1的产H2S活性,但可降低菌株WX-1的产H2S活性.
添加亚硝酸盐对菌株WX-1产H2S活性有显著抑制作用(如图5 b).终质量浓度为50 mg/L的亚硝酸钠仅能够短期抑制WX-1的产H2S活性;当超过7 d时,虽然各时间节点厌氧瓶内H2S质量浓度值与不加亚硝酸盐的阳性对照组具有显著性不同(P<0.05),但该浓度的亚硝酸盐仍无法抑制住菌株WX-1的产H2S活性.在35 d试验周期内,质量浓度高于50 mg/L的三个处理组(100、150、200 mg/L)瓶内未检出H2S,表明菌株WX-1的生长被亚硝酸盐强烈抑制.

图5 硝酸盐及亚硝酸盐添加对菌株WX-1产H2S的影响Fig.5 Effects of nitrate or nitrite on the H2S production by isolate WX-1
3 讨论
3.1 菌株WX-1与近缘种Anaerosolibacter carboniphilus生理生化特性的差异
本文从我国西北某油田1口油井的采出水中成功筛选了1株优势SPB菌株WX-1.WX-1与A.carboniphilus16S rRNA基因序列的序列相似性最高,达99%.该结果表明两者的亲缘关系最近.A.carboniphilus首次从韩国煤污染土壤中被分离出来[19],并以铁还原菌被报道,关于其在油田内的存在还未见报道.菌株WX-1与A.carboniphilus模式菌株IRF19T的形态及生理生化差异明显:①形态上,模式菌株IRF19T为宽度0.4~0.6μm、长度2.0~5.0μm的直杆状,而菌株WX-1为平均直径0.48μm的球状;②在温度方面,模式菌株IRF19T相对菌株WX-1具有稍加广泛的温度范围.IRF19T最低耐受温度为20℃,而WX-1在37~45℃下生长;③模式菌株IRF19T在pH为6.5~10.0的范围内均能生长,而WX-1仅能在pH为7.0~9.0下生长;④超过2%的NaCl浓度会抑制模式菌株IRF19T的生长,而菌株WX-1的最适矿化度为3%,且WX-1在NaCl浓度为0%~5%内均能生长产生H2S;⑤模式菌株IRF19T具有更广泛的电子受体,其能利用单质硫、硫酸盐和硫代硫酸盐,而WX-1不能利用硫酸盐进行生长代谢;但菌株WX-1能利用乳酸盐、甲酸盐、乙酸盐、丙酸盐作为唯一碳源进行生长,模式菌株IRF19T不能利用这四种碳源进行生长.这些研究结果提示,尽管基于16S rRNA基因序列信息初步确定菌株WX-1与A.carboniphilus具有亲缘关系,但在形态及生理生化方面的差异较大.
3.2 硫化氢产生菌对油藏酸败的贡献
目前,人们普遍认为SRB的生长代谢是导致油藏酸败的根本原因[7].但有研究表明,许多SPB不能利用硫酸盐,却能利用单质硫或者其他含硫化合物进行生长代谢,产生H2S.非洲产油井中分离出来的Thermotoga(模式菌株SEBR 7054T)能够还原硫代硫酸盐,而不能将硫酸盐或硫还原为硫化物[20].耐酸和适度嗜热的硫还原菌Desulfurella amilsi(模式菌株TR1T)能够利用单质硫和硫代硫酸盐作为电子受体,不能还原硫酸盐,亚硫酸盐,硝酸盐和三价铁,其中单质硫是实现最高硫化物浓度和最快生长的电子受体[21].Thiofractor thiocaminus(模式菌株496ChimT)将S0用作能源和硫源,其他含硫化合物尚未影响该菌株的生长[22].同以上三种菌株类似,本文筛选到的一株硫化氢产生菌WX-1能利用硫代硫酸钠、单质硫作为唯一电子受体,而不能利用硫酸盐、亚硫酸盐.该结果提示非硫酸盐还原菌的硫化氢产生菌可能是西北某油田造成油田酸败的主因.因此,非硫酸盐还原菌的硫化氢产生菌对于油藏酸败同样有着重大贡献,造成的后果不容忽视;该菌在油田中参与的硫循环过程、机制值得进一步探讨.
3.3 杀菌剂的添加对于抑制硫化氢产生菌代谢活性的差异
不同油田中,由于其环境复杂性导致微生物群落结构存在差异;即便在同一个油田中,不同地理位置也会造成微生物群落结构变化[13].因此,同一种杀菌剂抑制或杀死SPB的使用剂量显著不同.有研究结果表明,单独使用30 mg/L的戊二醛可有效抑制Desulfovibrio desulfuricanssubsp的代谢活性116 h(细胞浓度约为2.2×108CFU/mL)[23].对于加拿大Coleville油田研究数据结果显示,500 mg/L的戊二醛或者800 mg/L的溴硝醇才能抑制住SRB的代谢活性[11].而本实验中,10 mg/L的溴硝醇能抑制菌株WX-1的产H2S活性,该质量浓度远低于加拿大Coleville油田酸败控制所需的溴硝醇浓度.在尼日利亚油田中,THPS在200 mg/L质量浓度下对采出水中SRB的生长仅有明显抑制作用,在400 mg/L质量浓度下能完全抑制住SRB生长(细胞浓度约为105CFU/mL)[24].本实验中,100 mg/L的THPS即能完全抑制住菌株WX-1的产H2S活性.另有研究表明,在印度Kathloni油田中,单独添加25 mg/L的BTAC或者次氯酸钠在2 h内即可杀死从该油田采出水中得到的SRB(初始数量108CFU/mL)[25].但在本实验中,添加终质量浓度200 mg/L的BTAC和400 mg/L的次氯酸钠也无法抑制菌株WX-1的产H2S活性.该结果提示,溴硝醇和THPS可以较高效地杀死西北某油田油藏中的SPB优势菌株,在西北某油田油藏酸败控制中可能具有较大的应用潜力.
4 结论
1)通过厌氧Hungate滚管技术从西北某油田采出水中成功分离得到了1株硫化氢产生菌WX-1,其16S rRNA基因序列与A.carboniphilus的序列相似性最高达99%.该菌株能利用多种碳源进行生长代谢,仅能利用单质硫和硫代硫酸盐作为唯一电子受体产生H2S;
2)非硫酸盐还原菌的硫化氢产生菌同样可以造成油藏酸败;
3)相比硝酸盐,亚硝酸盐对WX-1抑制效果明显,亚硝酸盐是潜在的有效抑制剂;
4)终质量浓度为10 mg/L的溴硝醇或100 mg/L的THPS可单独抑制菌株WX-1,是潜在的高效杀菌剂.

