朱砂叶螨硒代谢通路基因筛选及硒磷酸合成酶TcSPS1的原核表达和特性分析
张梦宇, 戚翠翠, 胡 佳, 徐志峰
(西南大学植物保护学院, 重庆400715)
硒是哺乳动物和许多细菌、藻类等生物的一种必需微量元素,在自然界中主要以亚硒酸盐的形式存在(韩晓霞等, 2012)。在选择性取食研究中,植食性害虫在取食了富硒植物后,选择转移到低硒植物上取食,例如甜菜夜蛾Spodopteraexigua对不同形式和浓度的硒的摄食反应中,添加到饲料中的硒会影响甜菜夜蛾对宿主植物的选择,一定浓度下的硒可以作为甜菜夜蛾幼虫的拒食剂(Vickerman and Trumble, 1999)。在非选择性取食研究中,大量的植食性昆虫被迫食用富含硒的超积累体植物后都表现出中毒和高死亡率,例如蟋蟀取食富硒植物芥菜Brassicajuncea后会大量死亡(Freemanetal., 2007)。这些研究表明,植物可以通过富集硒来防御食草动物和病原体的攻击,植物硒含量的增加会影响食草动物的取食、生长、繁殖,甚至导致其死亡。硒在昆虫生理上的最适范围很窄,超过临界浓度则毒性很强,因此硒在植物对害虫的防御中具有重要意义。
耐硒的小菜蛾Plutellaxylostella取食十字花科植物醉蝶花羽叶Stanleyapinnata后同样积累了甲基硒代半胱氨酸,而对硒敏感的小菜蛾则以积累硒代半胱氨酸为主,研究人员推测出现这种差异的原因是耐硒小菜蛾具有防止甲基硒代半胱氨酸转化或降解为其他更有毒形式的能力(Freemanetal., 2006)。在甜菜夜蛾的成虫中发现了类似于三甲基硒化物的物质,表明甜菜夜蛾成虫可以通过甲基化和挥发来解毒过量的硒(Vickermanetal., 2004)。相对于其他害虫,叶螨对硒有着更强的适应能力,二斑叶螨Tetranychusurticae可以为害含有200 mg/kg硒的黄芪属植物,而该浓度对许多其他植食性害虫都是有一定毒性的,可能是由于二斑叶螨通过体内富集一种类似甲基硒代半胱氨酸的有机硒化物从而增加了对高浓度硒的耐受性(Quinnetal., 2010)。这些研究说明,面对植物的硒耐受性,植食性昆虫也通过各种方式去适应,有的通过改变取食行为,有的则通过把高毒的硒解毒为低毒形式的硒。但目前节肢动物中并未完全阐明硒代谢途径,已有的研究主要集中于生态学水平,其中硒代谢机制和产物的分析都是基于微生物和哺乳动物硒代谢通路的推测。
在微生物和哺乳动物硒代谢通路中,硒代蛋氨酸(SeMet)通过两条代谢途径转化为硒化物,由胱硫醚γ-裂解酶非特异性地转化为甲基硒醇(MeSeH),然后去甲基化为硒化物。甲基硒醇也是由某些植物中含有的甲基硒代半胱氨酸(MeSeCys)通过非特异性β消除而产生的。另一方面,转硫途径酶产生硒代半胱氨酸(Sec),随后被硒半胱氨酸裂解酶(SCLY)分解为硒化物。硫氧还蛋白(Trx)和硫氧还蛋白还原酶(TrxR)或谷胱甘肽还原酶(GSH)通过中间硒二谷胱甘肽(GSSeGS)可以催化无机亚硒酸盐还原为硒化物(Cupp-Sutton and Ashby, 2016; Tobe and Mihara, 2018)。而硒化物在硒磷酸合成酶(SPS)的作用下转化为硒磷酸(SeP),并在硒代半胱氨酸合酶的作用下结合各种因子合成硒蛋白,进而被生物体所利用(Tobe and Mihara, 2018)。
面对植物的防御体系,植食性昆虫及害螨在选择压力的作用下演化出多种反防御机制以维持种群发展,朱砂叶螨Tetranychuscinnabarinus属于蛛形纲(Arachnida)真螨总目(Acariformes)叶螨科(Tetranychidae),在我国分布广泛,是一种严重危害棉花、蔬菜等经济作物的农业害螨(洪晓月, 2012; van Leeuwenetal., 2012)。本研究所使用的朱砂叶螨对植物的硒耐受性也同样可以形成适应能力。基于朱砂叶螨普通和硒适应品系,本研究拟分析朱砂叶螨硒通路基因在短期硒处理和长期硒适应中的表达量变化,进而鉴定硒通路响应基因的功能,探究朱砂叶螨对高浓度硒耐受性的分子机制。研究结果不仅可初步明确叶螨适应植物硒耐受性的机制,也可为探索硒对植食性害螨的防控方法提供一定的理论依据。
1 材料与方法
1.1 试虫
朱砂叶螨普通品系Tc采自重庆北碚田间,一直在室内以珍珠土培育的豇豆Vignaunguiculata隔离饲养。饲养设备为恒温光照培养箱,温度控制在26±1℃,相对湿度控制在55%~75%,光周期设定为14L∶10D。
朱砂叶螨长期硒饲养品系(TcSe)为用20 μmol/L亚硒酸钠(Na2SeO3)溶液和珍珠土培育的豇豆苗长期饲喂(已超过1年)的朱砂叶螨。饲养条件为恒温光照培养箱,温度控制在26±1℃,相对湿度控制在55%~75%,光照周期设定为14L∶10D。短期硒处理朱砂叶螨为在0, 5, 20和50 μmol/L亚硒酸钠(Na2SeO3)处理的豇豆苗上接入200头朱砂叶螨成螨,处理3 d后采集雌成螨。
1.2 总RNA提取和cDNA合成
采集1.1节中Tc和TcSe品系的朱砂叶螨雌成螨以及短期硒处理3 d的雌成螨,采用Trizol(Life Technologies)法提取总RNA,150头朱砂叶螨为一个提取样本,每个样本3个生物学重复。选择OD260/OD280值在1.8~2.0的RNA用RQ1(RNA Qualified)RNase-Free DNase试剂盒(Promega)去基因组进行纯化,之后用PrimeScriptTMRT Reagent Kit 9(TaKaRa)反转录试剂盒合成cDNA。
1.3 朱砂叶螨硒代谢通路基因的克隆与序列分析
通过文献查找并结合二斑叶螨基因组(http:∥bioinformatics.psb.ugent.be/orcae/overview/Tetur)筛选获得硒代谢通路基因共8条(Tobe and Mihara, 2018)(表1)。使用Primer Premier 5.0软件设计8条目的基因的全长引物(表1)。以1.2节合成的cDNA为模板进行PCR,扩增体系: 1.1×T3 Super PCR Mix(北京擎科生物公司)2 μL, 上下游引物(10 μmol/L)各1 μL, Tc品系cDNA 1 μL。扩增条件: 98℃预变性2 min; 98℃变性10 s, Tm±5℃退火10 s, 72℃延伸5~15 s/kb, 33个循环; 72℃加尾2 min。根据已有的核苷酸和氨基酸序列,使用ExPASy-Protparam Tool(http:∥web.expasy.org/protparam/)在线软件对其基因编码蛋白质的理化性质(相对分子质量、理论等电点等)进行分析和预测。

表1 引物信息
1.4 qPCR检测朱砂叶螨硒代谢通路基因表达量
根据1.3节克隆获得的朱砂叶螨硒代谢通路基因序列,并以TcRPS18为内参基因(Sunetal., 2010),使用Primer Premier 3.0软件设计8条目的基因的定量引物并由北京擎科生物公司合成(表1)。以1.2节合成的cDNA为模板进行qPCR,扩增体系: SYBR Green Supermix(Promega公司)10 μL, 上下游引物(10 μmol/L)各1 μL, cDNA 1 μL, ddH2O 7 μL。扩增条件: 预变性95℃ 2 min; 95℃ 15 s, 60℃ 30 s, 循环40次,每个样品进行3次生物重复,每个生物重复设置3次技术重复。相对表达量使用2-ΔΔCt方法分析。
1.5 朱砂叶螨SPS1原核表达及分离纯化
根据1.3节获得朱砂叶螨TcSPS1的全长序列,以pET-28b为表达载体(pET-28b载体引物序列:F: 5′-GATGCCATGGGCATGGATATAGATGCATAAT ACTCTTGATTT-3′; R: 5′-CCGCTCGAGGCCTCTCAA TTCGGCAAA-3′),分别在5′端和3′端引入酶切位点XhoⅠ和NcoⅠ,进行PCR扩增,反应体系同1.3节。PCR产物进行双酶切(XhoⅠ和NcoⅠ)后使用通用型DNA回收试剂盒DP214(TIANGEN)回收酶切产物,回收后的pET-28b表达载体与目的片段按照试剂盒TreliefTMSoSoo Cloning Kit(北京擎科生物公司)步骤进行同源重组。
将测序正确的重组质粒TcSPS1-pET-28b转化至表达菌株大肠杆菌EscherichiacoliRosetta(DE3)(北京擎科生物公司),之后挑选含重组质粒的单菌落至3 mL LB液体培养基中,37℃培养过夜后-20℃保种;取保存于-20℃的菌种100 μL接种于100 mL LB液体培养基中震荡培养过夜;取10 mL菌液接种于200 mL LB液体培养基中,37℃扩大培养至OD600值约0.6,降低培养温度到30℃;加入IPTG诱导剂至终浓度0.5 mmol/L,30℃继续震荡培养3 h,8 000 r/min离心3 min收集菌体,重悬于50 mL预冷NTA-0缓冲液(pH 8.0)中,冰浴30 min;超声破碎菌体,参数设置为功率200 W、工作8 s、暂停4 s, 99个循环;16 000 r/min,4℃离心50 min,收集上清以及沉淀进行SDS-PAGE(康为世纪生物科技有限公司)检测。
根据上一步SDS-PAGE电泳结果,上清中出现目的条带,则表明存在可溶蛋白,接着采用Ni-NTA SefinoseTMResin Kit(生工生物工程上海股份有限公司)进行亲和层析预装柱来纯化重组蛋白上清。首先将预装柱垂直放置于试验台,取下塞子,使保存液自然流出;接着用1个柱体积的Washing Buffer平衡柱子;之后将上述含有重组蛋白的上清液缓缓加入柱中,用3~5个柱体积的Washing Buffer来洗涤柱子;最后,加1柱体积的Elution Buffer来洗脱目的蛋白,并收集纯化后的蛋白。
1.6 Western blot检测
取1.5节中镍亲和层析柱纯化后的TcSPS1重组表达蛋白样品进行SDS-PAGE(康为世纪生物科技有限公司)电泳。按照转膜操作说明书将SDS-PAGE凝胶上的蛋白通过湿转的方式转移到PVDF膜上。从电泳槽中将膜取出,用1×TBST(康为世纪生物科技有限公司)震荡洗涤3次(每次10 min),放入事先配好的5%脱脂奶粉(北京索莱宝科技有限公司)中,缓慢震荡1~2 h进行封闭。事先配制1∶10 000稀释的His-tag多克隆抗体(康为世纪生物科技有限公司),将封闭完的PVDF膜(康为世纪生物科技有限公司)用1×TBST清洗3次后,置于一抗中,4℃过夜进行一抗孵育。将过夜孵育后的PVDF膜用1×TBST洗涤3次。加入1∶20 000稀释的Goat Anti-Rabbit IgG(H+L)二抗(康为世纪生物科技有限公司),室温缓慢摇床1 h,进行二抗孵育。最后将膜用1×TBST洗涤3次;用吸水纸略吸掉过多的液体,平铺于一次性PE手套上。按照ECL化学发光底物试剂盒(Bio-Rad公司)1∶1(v/v)的比例混匀底物配制显影液,将显影液均匀涂在PVDF膜上,避光孵育2 min后,置于全能型凝胶成像系统(Bio-Rad公司)中使目的蛋白显影,观察结果并拍照。
1.7 重组蛋白TcSPS1生化特性测定
挑取约200头3日龄雌成螨,于液氮冷处理的1.5 mL离心管中,加入500 μL 40 mmol/L PBS缓冲液,置于冰上充分研磨,然后以4 ℃ 10 000 r/min离心10 min,上清即为粗酶液。依照Bradford使用的考马斯亮蓝染色法和酶标仪测定粗酶液中酶源蛋白含量(Bradford, 1976)。将1 000 μg/mL的牛血清白蛋白标准溶液用0.5 mol/L Tris-HCl(pH 7.5)稀释为5, 10, 20, 40, 60, 80和100 μg/mL 7个浓度梯度。在酶标板中加入上述各浓度梯度的牛血清白蛋白液50 μL,对照为50 μL 0.5 mol/L Tris-HCl(pH 7.5)缓冲液,再加入考马斯亮蓝G-250溶液200 μL,37℃反应10 min,在595 nm波长下测定其OD值,重复3次实验。以牛血清白蛋白浓度(μg/mL)为X轴,所测OD值与对照OD值之差(△OD值)为Y轴,得到标准曲线。
参照Ehrenreich等(1992)的方法,使用多功能微孔板分析仪测定TcSPS1的活性。把ATP标准溶液用ATP检测裂解液稀释成0, 0.2, 0.4, 0.8, 1.2和1.6 μmol/L 6个浓度梯度的标准溶液。将100 μL ATP检测工作液加入检测孔中,室温放置3~5 min,用排枪加入上述不同浓度的50 μL ATP标准溶液,迅速混匀,测定其相对光单位(relative light unit, RLU)。在TcSPS1的催化下,底物ATP与硒供体硒化物发生水解反应,生成AMP和SeP(Ehrenreichetal., 1992)。具体操作如下:在无氧条件下将5 μL 0.5 mol/L K3PO4, 5 μL 50 mmol/L醋酸镁(pH 7.0), 0.2 μL 1 mmol/L Na2SeO3, 10 μL 10 μmol/L ATP, 5 μL 20 mmol/L DTT, 22.3 μL H2O和2.5 μL TcSPS1纯化蛋白(对照组为粗酶和水两组)加入PCR管中,28℃反应30 min,通过检测ATP的减少量,来反映TcSPS1的酶活性。配制不同浓度梯度的底物(ATP终浓度为0.2~2 μmol/L),并测定重组蛋白TcSPS1的动力学参数。利用双倒数作图法计算出重组蛋白TcSPS1的米氏常数(Km)和最大反应速度(Vmax)。
1.8 数据分析
运用统计软件SPSS 8.0进行数据分析,其中基因在不同硒浓度处理下的表达量差异显著性采用单因素方差分析Duncan氏新复极差法进行分析,基因在Tc和TcSe品系之间的表达量差异显著性采用配对样本t检验进行分析。
2 结果
2.1 基因克隆
成功在朱砂叶螨中克隆得到硒代谢通路上的8条基因(表2),图1为TcSPS1的基因序列信息。

图1 朱砂叶螨TcSPS1基因序列信息
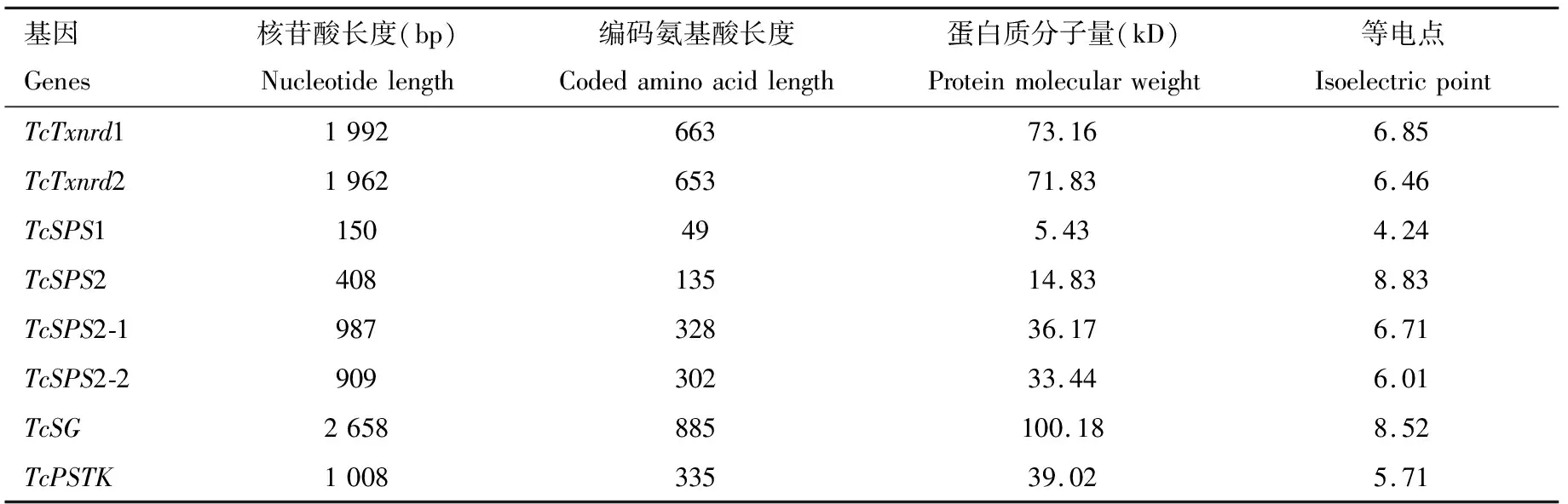
表2 朱砂叶螨8条硒代谢通路基因信息
2.2 硒代谢通路基因表达差异
为了明确硒代谢通路基因的功能,本研究检测了取食经不同浓度亚硒酸钠短期处理(处理3 d)的豇豆苗的朱砂叶螨雌成虫间以及常规豇豆饲养的朱砂叶螨普通品系与长期硒饲养品系雌成虫间硒代谢通路中8个基因的表达量差异。结果如图2显示,朱砂叶螨取食不同浓度亚硒酸钠短期处理豇豆苗后,硒代谢通路基因中的5条基因的mRNA表达水平发生不同程度的无规律变化,且总体变化幅度不大。其中,只有TcSPS1随着亚硒酸钠浓度的增大表达量不断增多,有明显的剂量效应。同样,TcSPS1在长期硒饲养品系中的表达量极显著高于在普通品系中(P<0.01),上调表达4.4倍,TcTxnrd1也显著性上调表达2.2倍(P<0.05)(图3)。结果表明相对于其他基因,TcSPS1可能在朱砂叶螨硒代谢中起着更重要作用。
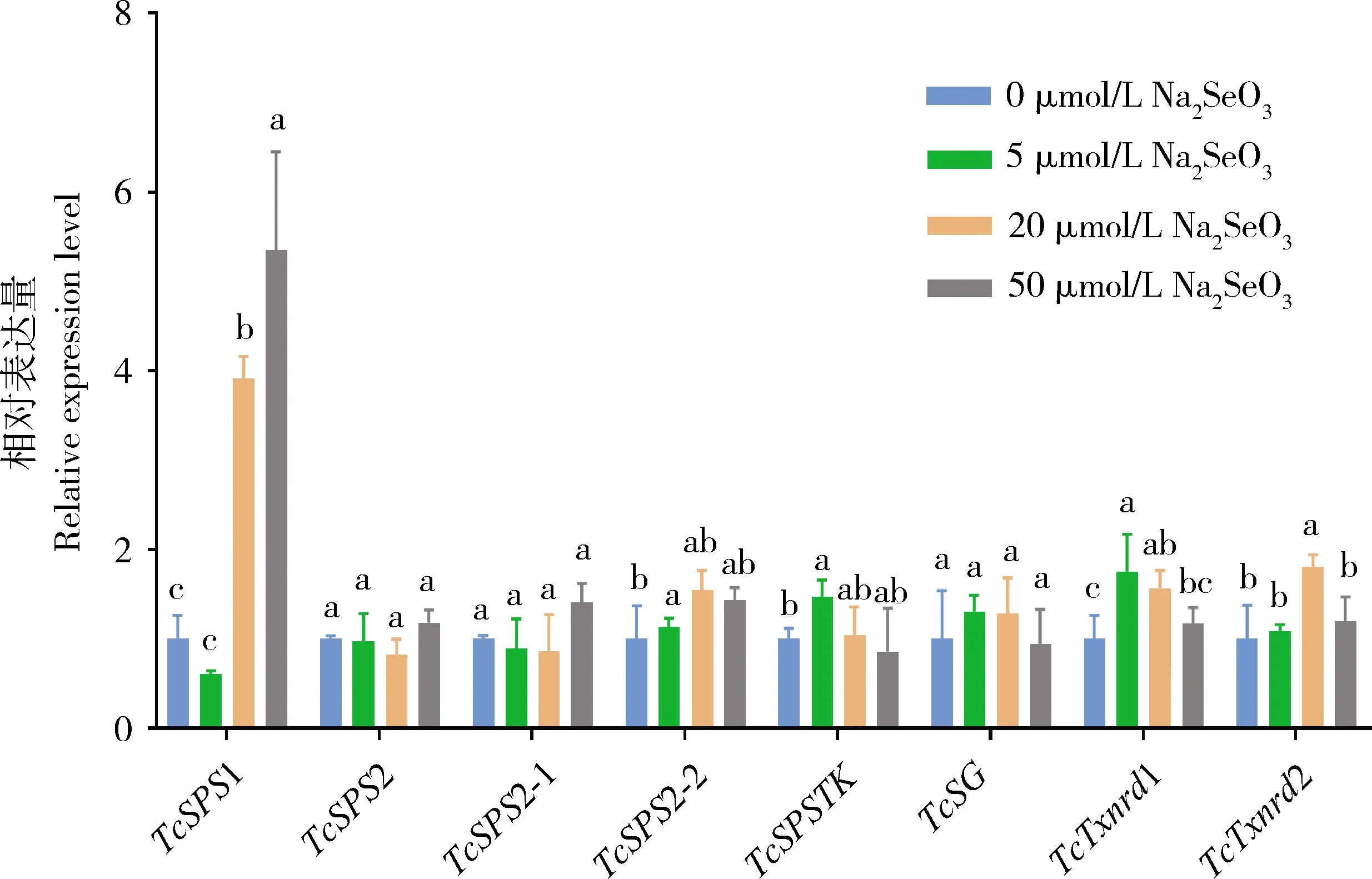
图2 不同亚硒酸钠浓度短期诱导的朱砂叶螨雌成螨中硒代谢通路基因的相对表达量
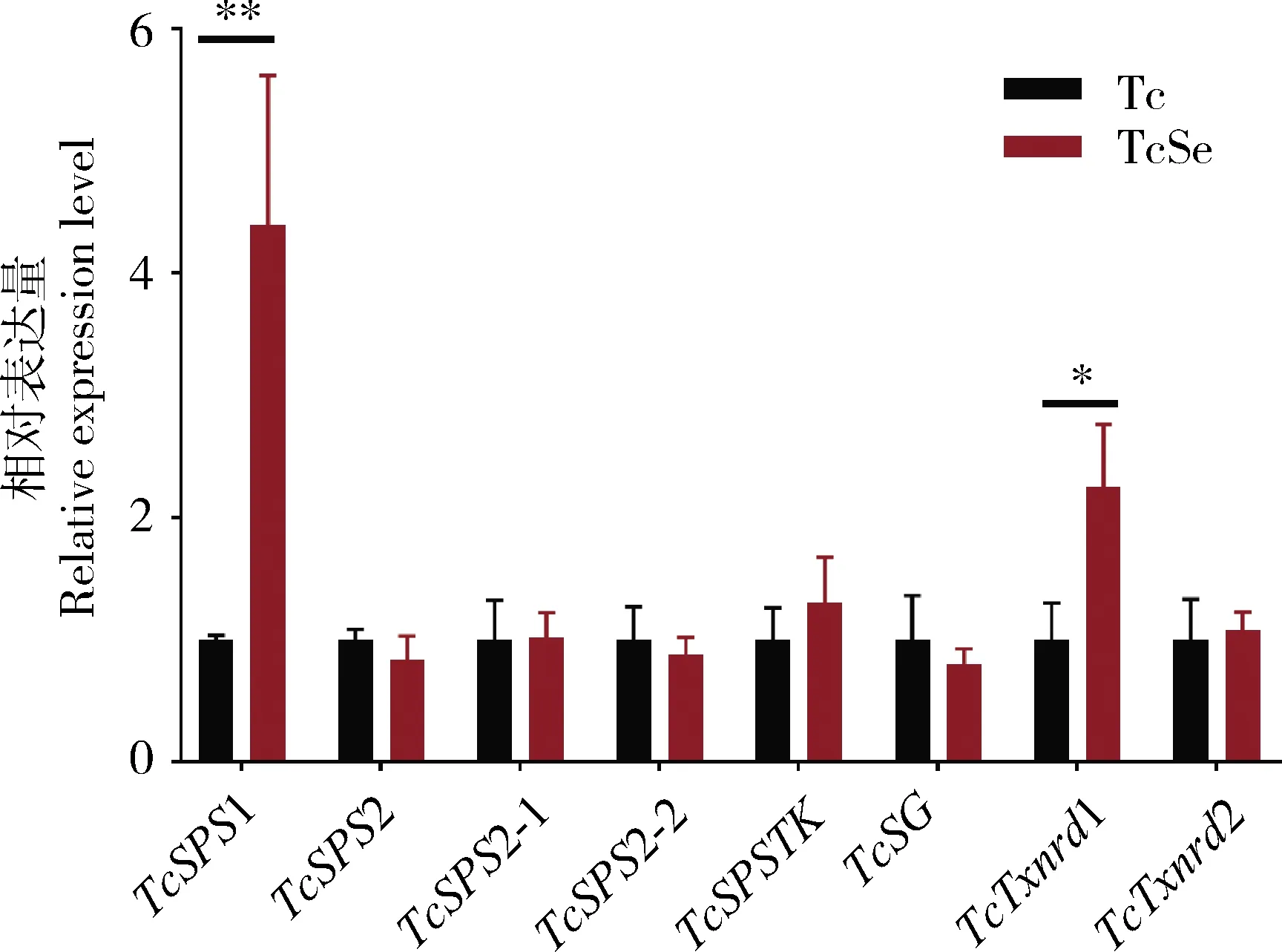
图3 两种品系朱砂叶螨雌成螨中硒代谢通路基因表达量
2.3 朱砂叶螨TcSPS1基因原核表达和重组蛋白生化特性
TcSPS1重组蛋白以可溶蛋白的形式存在,纯化检测到目的蛋白分子量大约在7 kD,与预测的蛋白分子量6.3 kD相近,Western blot也得到相同结果(图4)。为了检测重组蛋白的活性,构建了牛血清白蛋白标准曲线(图5: A)和ATP标准曲线(图5: B),其中:牛血清白蛋白标准曲线的方程为Y=0.0034X+0.1081(R2=0.9770);ATP标准曲线的方程为Y=6 417 966.2105X+199 782.9860(R2=0.9987)。重组TcSPS1蛋白比活力为2.366±0.046 nmol/mg pro·min,高于粗酶的比活力0.223±0.017 nmol/mg pro·min;动力学参数Km和Vmax值分别为10.054±0.062 μmol/L和29.633±1.777 nmol/mg pro·min。结果表明原核表达获得了具有硒磷酸合成酶活性的可溶蛋白。
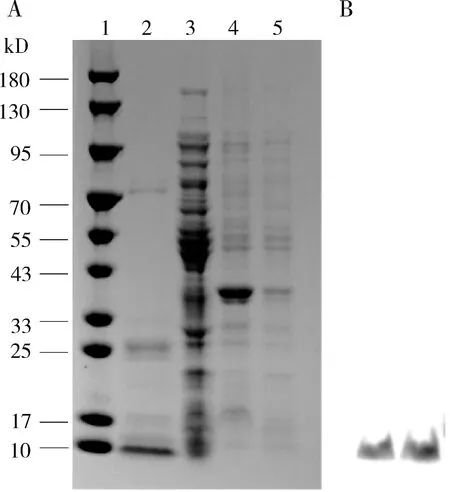
图4 重组蛋白TcSPS1的SDS-PAGE(A)和Western blot(B)分析
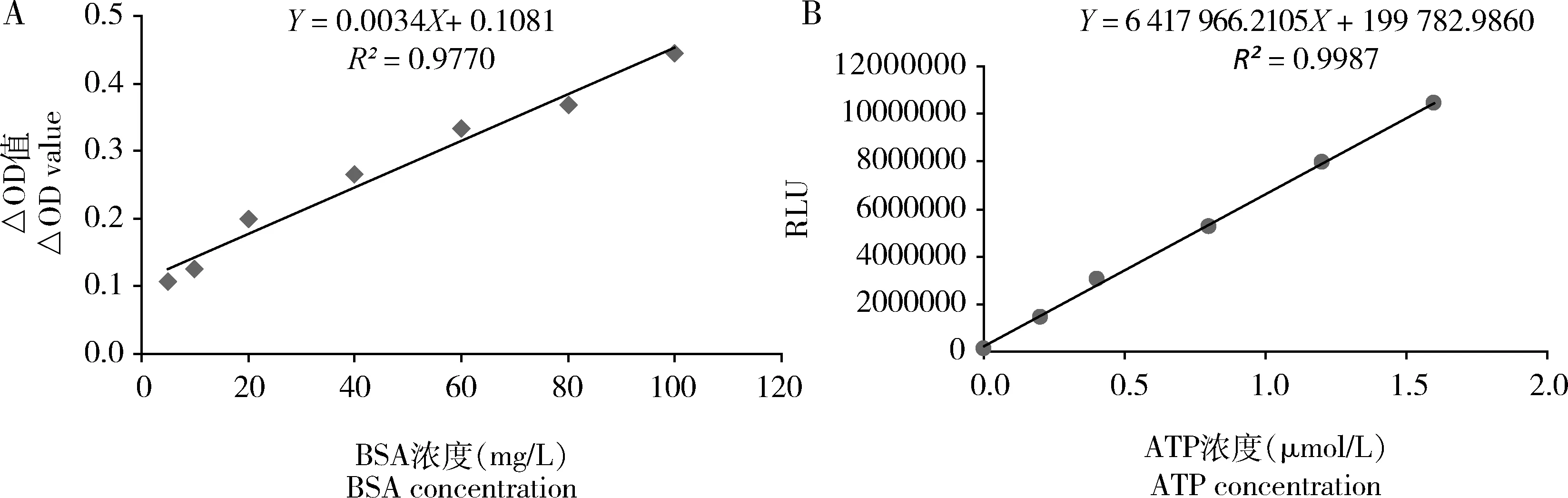
图5 牛血清白蛋白(BSA)(A)和ATP(B)标准曲线
3 讨论
自然界的硒主要以亚硒酸盐的形式存在,对亚硒酸盐代谢和生物利用度的研究主要集中在人类中,目前已被广泛和成功地用于人类疾病的治疗(Meuilletetal., 2004; Mickeetal., 2010; Jirongetal., 2012)。硒也是植物必需的微量元素之一,既可以提高农作物的营养价值,也可帮助植物抵抗害虫的危害。而植食性害虫经硒处理后,硒代谢通路基因的表达量上调是降低亚硒酸钠毒性,提高硒适应能力的关键。本研究中朱砂叶螨在不同浓度的硒短期诱导时,TcSPS1,TcSPS2-2,TcPSTK,TcTxnrd1和TcTxnrd2基因的mRNA水平发生了变化(图2),表明它们可能与朱砂叶螨对植物硒耐受性的适应性有关。因此我们推测朱砂叶螨取食高毒性的亚硒酸钠后,亚硒酸钠被TcTxnrd催化还原为具有较高毒性的硒化物;而硒化物进一步在TcSPS1的催化作用下能够催化产生一种硒的活化生物形式——硒磷酸;硒磷酸同时在L-Serly-tRNASec, TcPSTK和TcSG的作用下转化为携带硒半胱氨酸的Sec-tRNA,从而生成各类低毒的硒代氨基酸并合成硒蛋白。
但除了TcSPS1以外,其余差异表达的基因在不同高浓度硒诱导下的表达量差异并不大(图2),原因可能是这些基因只在朱砂叶螨适应较低硒浓度时发挥作用。而在长期硒饲养品系中,发现TcSPS1和TcTxnrd1显著上调表达(图3),表明TcSPS1和TcTxnrd1与朱砂叶螨对植物硒耐受性的适应力增强有关。且TcSPS1基因在短期硒处理和长期硒适应品系中均上调表达,其表达量与硒处理浓度有一定的相关性,因此我们推测TcSPS1基因在朱砂叶螨对硒的适应过程中起着十分重要的作用。随后的原核表达实验通过该酶的专一性底物ATP检测了朱砂叶螨重组蛋白TcSPS1的比活力,表明朱砂叶螨的TcSPS1能够催化亚硒酸钠生成新的硒化合物,证明了TcSPS1基因在硒代谢中有着重要的功能。但在前期哺乳动物的研究中发现只有TcSPS2能够催化硒化物合成硒磷酸,而TcSPS1可能利用了不同的底物,TcSPS1在生物体内合成硒蛋白中的作用机制并不清楚,这种TcSPS1功能的差异极有可能是螨和哺乳动物之间的物种差异导致的(Xuetal., 2007)。
本研究通过对朱砂叶螨硒代谢通路基因的克隆与分析推测了朱砂叶螨硒代谢通路关键基因,并发现多条基因对亚硒酸钠处理具有响应能力;其中SPS1在短期亚硒酸钠处理和长期硒饲养品系中均上调表达,且对亚硒酸钠具有一定剂量效应;进一步通过原核表达获得了TcSPS1重组蛋白,并测定了其部分生化特性。本研究首次在节肢动物中分析了硒代谢通路基因,并初步解释了朱砂叶螨对硒的适应的分子机制,研究结果可为节肢动物硒代谢通路的研究以及硒防控害虫的新技术开发提供一定的理论依据。

