基于TCGA数据库肝细胞癌microRNA-324-5p表达与预后危险因素分析
吴城孝, 方 婕, 周霁川, 肖永胜, 张晓光,
(1.复旦大学附属金山医院麻醉科,上海 201508;2.复旦大学附属中山医院a.麻醉科,b.肝肿瘤外科,上海 200032)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,在我国发病率较高,每年新增病例约36万例,死亡35万例[1]。由于癌细胞诊断晚、HCC耐药、复发和转移等一系列问题,目前预后仍较差[2-3]。因此,寻找新的生物标志物来预测HCC的进展和预后很有意义[4]。
MicroRNA参与细胞增殖、凋亡、迁移和侵袭等多种生物学过程[5],在许多癌症的发生、发展、转移和复发中起重要作用[6]。MicroRNA(miR)-324-5p参与结肠癌[7]、胰腺癌[8]、胶质瘤[9]等多种恶性肿瘤的生物学过程。目前,miR-324-5p对HCC病人预后影响的研究证据缺乏。本研究拟通过TCGA(The Cancer Genome Atlas)数据库,分析miR-324-5p表达水平与HCC病人总体预后的相关性,探讨其作为HCC预后标志物的可行性,为相关的机制研究提供基础。
资料与方法
一、数据来源
检索TCGA数据库(www.cancergenome.nih.gov)下载LIHC项目中的miRNAseq数据,共374例HCC组织和50例正常肝组织。50例正常肝组织包含49例为HCC组织所属病人的正常肝组织对照,另外1例HCC病人仅有正常肝组织而无HCC组织对照。共375例病人。下载相应临床资料,于2021年3月下载。某些临床参数数据缺失的病例在后续该项临床参数分析时自动剔除。根据miR-324-5p表达水平,分为高表达组与低表达组,用于后续分析。
二、表达差异分析
将RPM格式的miRNAseq数据进行log2转化后进行样本间表达的比较。正态性检验结果显示,miR-324-5p表达在两组内接近正态分布(P>0.05)。方差齐性检验显示,miR-324-5p表达方差在统计学上不相等(P<0.05)。故选择Welch t检验分析miR-324-5p在HCC组织和正常肝组织中的表达差异。使用Kruskal-Wallis检验和多重假设检验(Dunn检验)分析miR-324-5p在不同分期HCC组织中的表达。使用R软件的“ggplot2”软件包绘制差异散点图。
三、预后分析
使用R软件的 “survival”软件包进行生存分析,使用“survminer”软件包绘制生存曲线。使用单因素和多因素Cox回归分析临床参数与HCC预后的关系,并计算风险比(hazard ratio,HR)。
四、统计学分析
所有数据均用R软件(3.6.3)处理。计量资料以均数±标准差表示。P<0.05为差异有统计学意义。
结 果
一、临床特征
TCGA数据库中miR-324-5p高表达组187例,低表达组病人188例。高表达组和低表达组病人的年龄、性别、肿瘤的TNM分期、病理分期、Child-Pugh分级以及肝纤维化Ishak评分[10]、血管侵犯的差异均无统计学意义。高表达组甲胎蛋白>400 μg1L病人的比例大于低表达组,差异有统计学意义(见表1)。
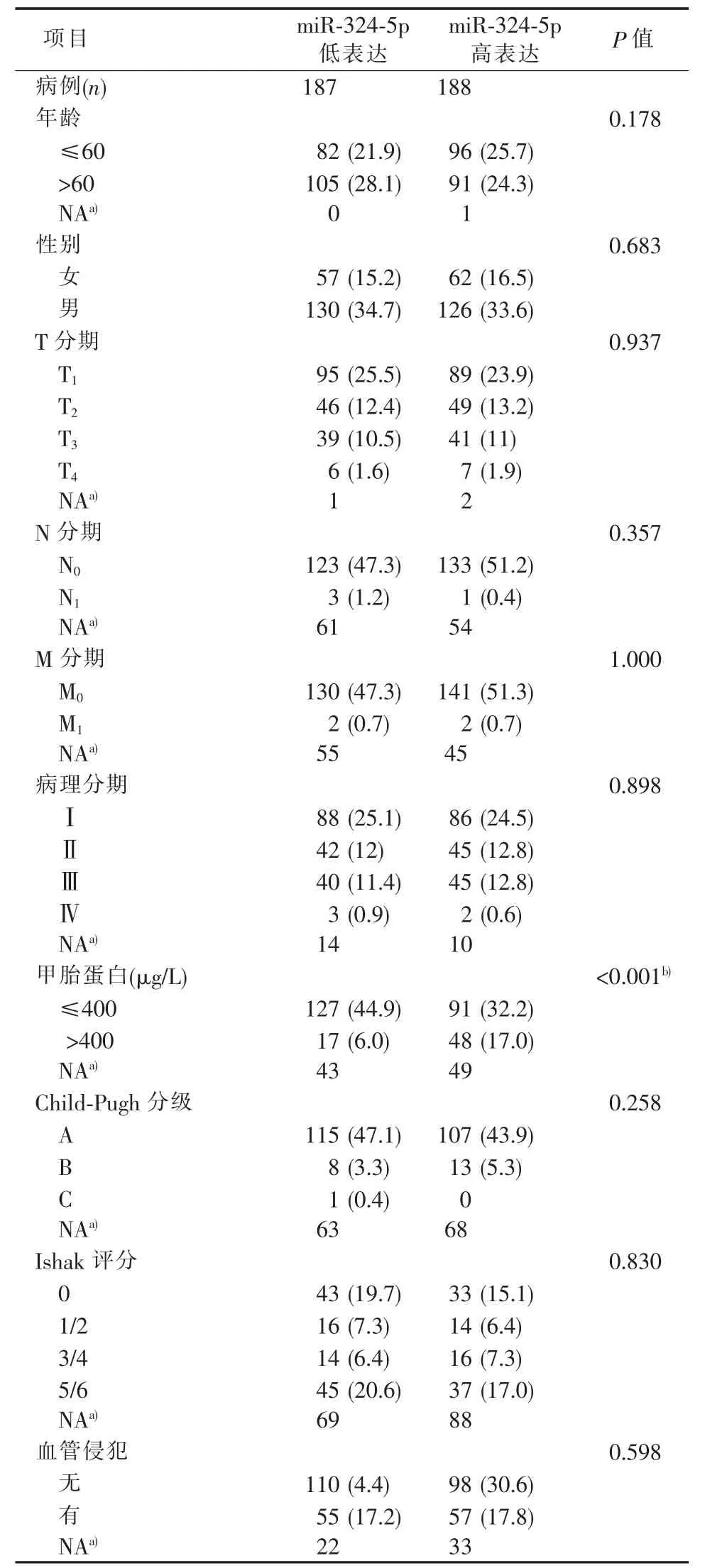
表1 HCC病人miR-324-5p表达情况与临床资料特征[n(%)]
二、miR-324-5p表达差异
HCC组织(n=374)中miR-324-5p表达(4.419±0.887)高于正常组织(n=50)(4.055±0.446,P<0.001)(见图1A)。不同分期HCC组织中miR-324-5p表达(Ⅰ期 4.439±0.873;Ⅱ期 4.362±0.806;Ⅲ期 4.553±0.959)均高于正常组织(P=0.014,P=0.031,P=0.009),但不同分期HCC组织间miR-324-5p表达差异无统计学意义(P>0.05)(见图1B)。
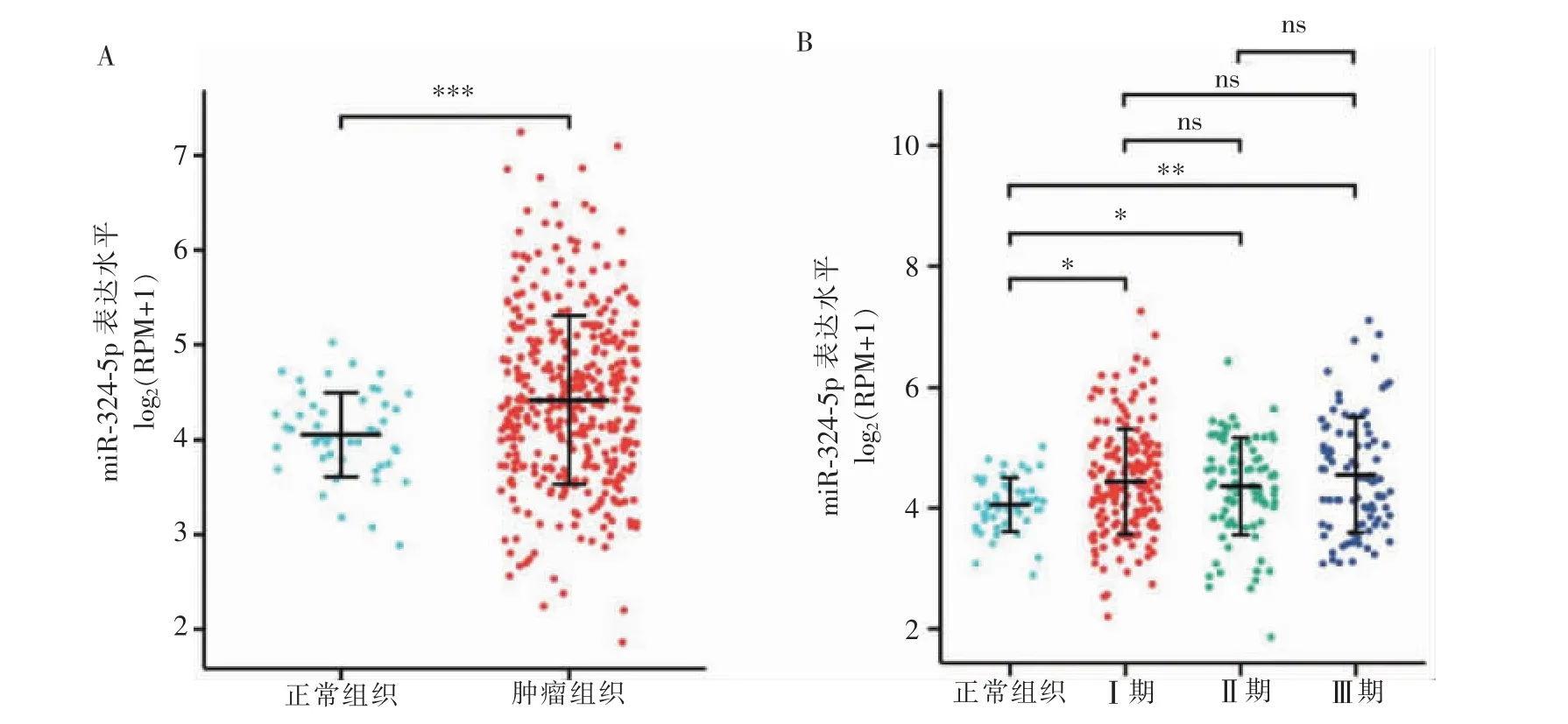
图1 miR-324-5p表达差异
三、miR-324-5p表达与HCC病人预后
本研究miR-324-5p高表达组病人总生存(overall survival,OS)期和疾病特异生存(disease specific survival,DSS)期均低于低表达组病人(见图2)。
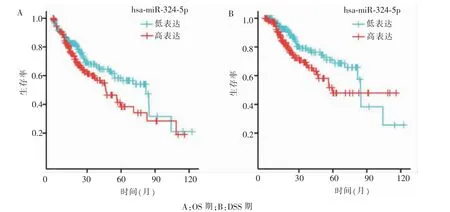
图2 miR-324-5p表达与病人预后生存的关系
单因素Cox分析显示T分期、病理分期及miR-324-5p表达与HCC病人的OS和DSS相关。进一步多因素Cox回归分析显示,miR-324-5p高表达是影响HCC病人OS的独立危险因素 (HR=1.537,95%CI:1.058~2.233,P=0.024)(见表 2)。
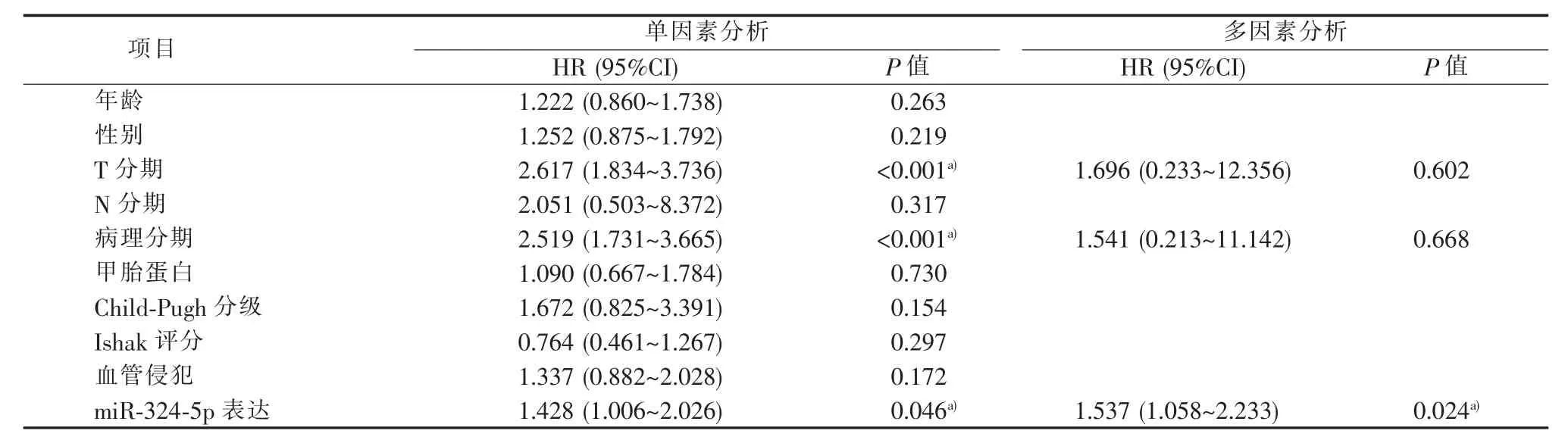
表2 OS的单因素和多因素Cox回归分析
讨 论
本研究探讨TCGA数据库中HCC组织与肝组织中miR-324-5p表达差异,并分析其表达与预后的关系,发现miR-324-5p在HCC组织高表达。HCC病人中,miR-324-5p高表达组预后明显差于低表达组。单因素和多因素Cox分析结果表明,miR-324-5p高表达可作为HCC病人的独立预后影响因素。
HCC是常见的肝脏肿瘤,具有恶性程度高、复发率高、预后差等特点,严重威胁生命健康。因此,研究肝癌的发生机制、治疗和防止复发等策略,均具有重要意义。近年来,许多研究报道了miRNA在发育、细胞增殖、凋亡和肿瘤生物学中的关键作用。
miRNA是一组进化保守的非编码小RNA,通过与靶信使 RNA(MRNA)的 3′-非翻译区(3′-UTR)互补碱基配对,精确调控基因表达[11]。miRNA在肿瘤的发生或发展过程中起到促进或抑制的作用[12]。Murakami等[13]最早研究了25对HCC和邻近非肿瘤组织以及9例慢性肝炎的miRNA表达谱。结果表明7个成熟的miRNA和1个前体miRNA(miR-18、miR-224、miR-199a*、miR-199a、miR-195、miR-200a、miR-125a和pre miR-18)在HCC和非肿瘤组织样本中表达差异明显。3个miRNA(miR-92、miR-20、miR-18)和1个前体pre-miR-18与HCC的分化程度有关,提示特异性miRNA参与HCC的发展过程,可能成为有价值的生物标志物。此外,许多报道均表明miRNA的异位表达对HCC具有致癌或抑癌作用。这些miRNA可能是HCC治疗的靶点[14]。
已有研究证实,miR-324-5p与多种癌症密切相关[15]。Bamodu等[16]研究发现,miR-324-5p在结肠直肠癌细胞中的高表达对OS的影响呈时间依赖性。高表达组5年和10年的OS率分别为52.50%和43.75%,而低miR-324-5p组5年和10年OS率分别为68.75%和36.50%。Zheng等[17]的研究还证实miR-324-5p在胃癌组织和细胞系中的表达明显高于对照组,miR-324-5p的过度表达预示着胃癌病人预后不良。对HCC的研究,有报道长链非编码RNA的Linc01134充当miR-324-5p分子海绵并与胰岛素样生长因子2的mRNA(IGF2BP1)结合,形成的Linc011341miR-324-5p1IGF2BP11YY1反馈环路可介导HCC的进展,可能成为HCC的治疗靶点[18]。研究发现一种新的DE-lncRNA、RP11-85G21.1(Lnc85),通过与miR-324-5p的靶向结合和调控,促进HCC细胞的增殖和迁移[19]。
本研究以TCGA数据库中HCC的miRNA表达谱数据为基础,样本量较大,临床资料完整,为miR-324-5p在预测HCC病人预后方面的研究提供一定的参考。但血清miR-324-5p是否与肿瘤进展水平具有相关性、miR-324-5p能否成为预测HCC病人预后的生物标志物等问题仍需进一步的研究验证。
综上所述,miR-324-5p在HCC组织表达上调,与病人不良预后相关,可能是HCC预后判断的潜在生物学标志物。

