基于网络药理学探讨苍附导痰丸治疗多囊卵巢综合征的作用机制
胡攀伟,李 嘉,刘 丹,杨 红
(上海中医药大学附属曙光医院1.妇科,2.针灸科,3.生殖医学中心,上海201203)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种生殖内分泌疾病,在临床上主要表现为少排卵或慢性无排卵、月经不调、高雄激素血症(如多毛、痤疮),高胰岛素血症和肥胖[1]。有研究表明,PCOS 流行率为8%~13%,对女性的健康和生活质量产生重大影响,合并增加罹患心血管疾病的风险,同时将子宫内膜癌风险提高了2.7 倍,还可能诱发妊娠并发症和情绪困扰等问题,严重影响家庭和谐[2]。早期诊断和治疗PCOS 具有重要意义,目前治疗PCOS 西医手段众多,但存在一定的局限性,停药后容易复发[3]。PCOS 在祖国医学宝库中并无对应的病名,但根据其临床表现可以归属“月经后期”、“不孕”等中医范畴。苍附导痰丸出自《叶天士女科诊治秘方》,主方由半夏、陈皮、苍术、胆南星、茯苓、甘草、生姜、香附、枳壳构成。全方发挥调理冲仁,化痰燥湿之功,主治经水不足,闭经,月经稀发等。临床研究[4]表明,苍附导痰丸能够促进卵泡发育,改善体内激素水平,恢复正常月经规律,最终改善PCOS 患者排卵率和妊娠率,在临床治疗PCOS 中发挥良好效果。但是目前研究中针对苍附导痰汤治疗PCOS 多以临床试验为主,动物实验及机制分析相对较少,苍附导痰汤具体的作用机制还不明确。网络药理学是近些年来新起的一门学科,将系统生物学、药理学、计算机等领域统筹结合,用当代“疾病‐药物‐靶点”网络对中医学进行科学的解释验证,为中医药研究提供科学理论支撑,为中医药的深入推广提供基奠[5]。本文使用网络药理学的方法推测苍附导痰丸治疗PCOS 的潜在机制与作用靶点,为苍附导痰丸的深入应用与研究提供理论依据。
1 资料与方法
1.1 苍附导痰丸的主要化学成分和对应靶点
检索TCMSP 中药分析平台分别获得每一味中药的化学成分,汇总导入Excel 中。根据ADME 筛选参数设置口服利用度OB≥30%,类药性DL≥0.18[6],获得方剂的化合物成分,并结合参考文献予以校正。运用筛选到的化合物在TCMSP 平台中查找对应的靶点,然后运用Perl 语言数据包对靶点名称在全球蛋白质数据库(Universal Protein,Uni‐prot)进行基因名称转换,并对其中未能识别的靶点,在Uniprot 在 线 网 站(https://www.uniprot.org/)进行补充校正,汇总得到苍附导痰丸的药物作用靶点。通过检索数据库GeneCards(https://www. genecards. org/) 和OMIM (https://www.genecards.org/),以关键词“polycystic ovarian syn‐drome”检索相关基因,并导出Excel 汇总,对汇总的基因进行查重,删除重复值,得到疾病的相关靶点。
1.2 PCOS 疾病靶点和苍附导痰丸药物靶点交集筛选
利用R 数据包对药物靶点和汇总得到的PCOS疾病靶点取交集,绘制韦恩图,得到关键作用靶点交集。
1.3 蛋白互作网络构建
利用R 语言下的org 数据包对关键靶点规范基因名称得到基因ID,同时对未能识别的基因进行PubMed 网 站(https://www.ncbi.nlm.nih.gov/)查询补充,最终得到药物作用于疾病的关键基因ID 列表,导入String 在线平台(https://string-db.org/),选择物种来源人源,设置0.9 高置信度,隐藏游离的点,将得到的文件导入Cytoscape(3.7.2)软件,最终导出蛋白互作网络,并对得到的蛋白互作网络进行R 语言分析,选择排名前14 的关键基因,绘制条形图。
1.4 疾病-药物-主要活性成分-靶点网络构建
利用得到的药物成分及靶点信息关系形成网络关系文件,导入Cytoscape(3.7.2)软件,得到PCOS-苍附导痰丸-主要活性成分-作用靶点网络可视化图形。
1.5 KEGG 通 路 和GO 富 集 分 析
利用得到的关键作用靶点基因ID 列表,结合R数据包,以P<0.05 为筛选条件对基因进行京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析和基因本体(gene on‐tology,GO)分析。
2 结果
2.1 苍附导痰丸成分和靶点收集
在TCMSP 中逐个检索中药成分,得到有效成分757 个。根据获得的主要成分列表在TCMSP 中检索对应的作用靶点,汇总得到药物靶点,去除重复值,得到苍附导痰丸中有效作用靶点167 个,生姜53 个,枳壳75 个,胆南星68 个,香附142 个,苍术50个,甘草141 个,陈皮54 个,半夏88 个,茯苓35 个。
2.2 苍附导痰丸、多囊卵巢综合症共同靶点筛选
将以上药物使用Perl 软件经Uniprot 数据库对靶点进行基因名称转换,对不能识别的靶点进行Uniprot 补充查询,得到药物靶点对应的基因名称列表。使用GeneCards 和OMIM 数据库收集到PCOS靶点2 270 个、624 个,合并后删除重复值,利用在R数据包对药物靶点基因列表和多囊卵巢综合征疾病靶点取交集,得到105 个核心交集基因并绘制韦恩图,见图1。

图1 苍附导痰丸疾病和靶点的韦恩图Fig 1 Venn diagram of disease and target of Cangfu Dao‑tan pill
2.3 核心靶点表达蛋白互作网络构建及核心靶点收集
将得到的105 个共同靶点输入在线String 数据库绘制蛋白互作网络,设置基因来源人源,进行蛋白互作分析,设置0.9 置信度,隐藏游离的点,导出含有节点信息的TSV 文件,在Cytoscape(3.7.2)中分析节点信息并绘制网络图,包含节点90 个,边234 条,见图2。通过R 语言包对节点TSV 文件进行分析,筛选前14 个核心调控基因靶点并绘制靶点数目条形图,见图3。

图2 苍附导痰丸的核心蛋白互作网络图Fig 2 Core protein interaction network of Cangfu Daotan pill
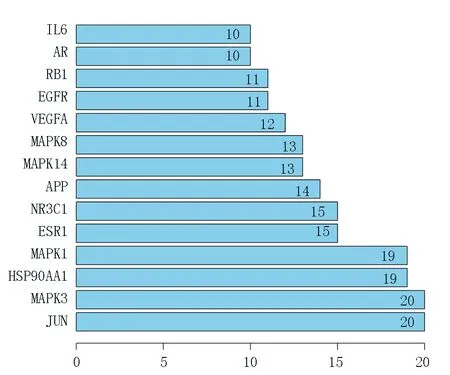
图3 苍附导痰丸的核心靶点图Fig 3 Diagram of core targets of Cangfu Daotan pill
2.4 疾病-药物-主要活性成分-靶点网络分析
将核心交集靶点基因对应的药物有效成分逐个对应,按照靶点数目从大到小排列,发现其中有8种成分是成分间共有成分,给这些成分分别按照简称命名(A-F),然后运用Cytoscape 构建疾病-药物-主要活性成分-靶点视化图形,得到网络有254 节点,2 219 边,254 个节点中包含9 种中药,140 种有效活性成分,105 个作用靶点,边表示中药分子化合物和靶点的网络关系。其中靶点排名前十的关键活性成分为槲皮素、山奈酚、木犀草素、β-谷甾醇、罗通定、卡维丁、7-羟基-2-甲基-3-苯基苯并吡喃-4-酮、美迪紫檀素、异鼠李素、植物甾醇,对应靶点数目分别为65、38、33、32、32、29、29、28、27、26,可以推测这10 种成分为苍附导痰丸治疗PCOS 的关键活性成分,见图4。

图4 疾病-药物-主要活性成分-靶点可视化网络Fig 4 Disease-drugs-main active ingredients-target visualization network
2.5 GO 功能富集分析和KEGG 信号通路分析
将得到的105 个靶点通过R 语言下的数据包进行GO 下的生物过程(biological process,BP)分析和KEGG 信号通路分析,共有1 900 条生物功能显著富集(P<0.05),1 692 个富集在BP 中。选择BP条目中排名前20 绘制条形图,主要涉及营养代谢,对药物反应,脂多糖反应,细菌来源反应,活性氧物种反应,对类固醇激素反应等,见图5。富集到KEGG 通 路143 条,选 前20 条 绘 制 气 泡 图,主 要 包括流体剪切应力和动脉硬化,晚期糖基化终产物通路,雌激素信号通路,白介素通路,内分泌阻力通路,多巴胺能突触,GnRH 信号通路,血管内皮生长因子通路等,见图6。

图5 BP 条形图Fig 5 Biological process(BP)bar chart

图6 KEGG 气泡图Fig 6 KEGG bubble chart
3 讨论
多囊卵巢综合征临床表现多为月经后期闭经、月经稀发等。痰淤互结是多囊卵巢综合征的发病重要因素,痰湿和瘀血是致病后的病理产物,不断累积,得见多囊患者肥胖、多毛、倦怠乏力等表现,形肥痰闭则经闭[7]。苍附导痰丸是祛痰湿的经典名方,以胆南星、半夏、苍术为君药化痰清热燥湿,香附疏肝解郁,茯苓健脾利湿,枳壳理气化痰,甘草调和诸药,生姜温中化痰,全方共奏健脾利湿,疏肝解郁,化痰散结之功。西药在治疗PCOS 上多采用避孕药,雌孕激素等激素疗法,容易产生副作用,而祖国医学在治疗PCOS 上有独特的优势,副作用相对较少,接受度高。目前临床上治疗PCOS 多采用苍附导痰丸为基础方,清瘀散结,力求恢复患者自身的排卵节律,恢复月经周期。本研究借助网络药理学方法探讨苍附导痰丸治疗PCOS 的可能机制,构建网络药物疾病靶点图,系统预测潜在的作用靶点和有效活性成分。
经过筛选,本研究得到了苍附导痰丸治疗PCOS 主要成分140 个,其中排名前十的关键活性成分为,槲皮素、山奈酚、木犀草素、β-谷甾醇、罗通定、卡维丁、7-羟基-2-甲基-3-苯基苯并吡喃-4-酮、美迪紫檀素、异鼠李素、植物甾醇。
其中罗通定为中枢性镇痛药物,有镇痛、镇静的作用[8]。脱氢卡维丁为季铵碱类化合物,有护肝、抗菌、止痛镇静作用[9]。美迪紫檀素为紫檀类化合物,有抗肿瘤、抗菌、抗氧化等药理作用[10]。β-谷甾醇、植物甾醇均为甾醇成分。研究表明甾醇能够抑制胆固醇吸收与合成,干扰甘油三酯吸收,改善体内血脂水平[11]。其余的关键活性成分为药用价值很高的黄酮类化合物,在自然界中广泛存在。黄酮类化合物有抗炎,改善血管通透性、降低血脂、改善凝血功能,有类雌激素作用,能发挥抗炎、抗氧化功能[12]。槲皮素能够改善PCOS 胰岛素抵抗大鼠胰岛素水平,抑制TLR/NF-κB 通路,改善PCOS 炎症微环境,逆转胰岛素抵抗[13]。研究表明山奈酚能够激活AMPK/Nrf2/HO-1 信号通路,减少细胞凋亡,降低炎性反应,改善氧化应激[14]。木犀草素为天然黄铜化合物,有抗炎、抗凋亡、类雌激素、调节免疫等多种药理作用[15]。异鼠李素可以调控一氧化氮合酶活性发挥抗炎作用,还可抑制血小板聚集减少血栓形成,能清除自由基发挥抗氧化功能[16]。血糖、高胰岛素、血脂升高是PCOS 血管内皮损伤中重要致病因素[17]。PCOS 发病与炎性因子水平密不可分,炎性因子又可以增加血脂水平,加重PCOS 患者体内炎性状态[18]。通过对蛋白互作网络中的核心基因进行筛选,发现苍附导痰丸主要通过JUN、MAPK3、HSP90AA1、MAPK1、ESR1、NR3C1、APP、MAPK14、MAPK8、VEGFA、EGFR、RB1、AR、IL6、NCOA1、RXRA 这16 个主要靶点发挥调控作用。MAPK3、MAPK1、MAPK14、MAPK8 属于丝/苏氨酸蛋白激酶(mitogen-activated protein ki‐nases,MAPK)家族,调控炎症、凋亡、生长因子等诸多生理活动。MAPK 通路能负反馈调节PI3K 通路,导致PCOS 胰岛素抵抗的形成,而胰岛素抵抗是PCOS 重要发病机制[19]。JUN 基因属于ZIP 家族核内转录因子成员之一,与众多基因启动子结合发挥基因转录调节作用。HSP90AA1 属于热休克家族成员,能够编码可诱导的分子伴侣,帮助特定的靶蛋白进行空间折叠。研究发现热休克蛋白(heat shock protein,HSP)基因编码的HSP90 主要存在于卵巢颗粒细胞,在优势卵泡中HSP90 含量明显高于非优势卵泡,HSP90 能够促进调节卵泡成熟[20]。ESR1 能够编码一种雌激素受体,通过结合雌激素配体发挥生物学效应,在卵泡发育和成熟中发挥重要作用[21]。NR3C1 能够编码两种糖皮质激素受体蛋白,通过与配体结合影响蛋白质、脂肪代谢,调节内环境稳态,介导炎症、免疫等多种生理病理过程[22]。VEGF基因编码的血管内皮生长因子在组织血管形成和许多疾病中起到关键作用,高表达的VEGF 与PCOS 密 切 相 关,且VEGF 是 控 制 卵 巢 血管生成的关键因素[23]。AR 为编码雄激素受体的基因,高雄激素水平与PCOS 的进展密切相关,高雄激素水平可导致PCOS 患者出现多毛、痤疮等临床症状。对26 例PCOS 卵巢组织与15 例正常组织的病理分析发现,雄激素受体可以间接降低PCOS 患者的生育能力,抑制卵泡发育,减少成熟卵形成[24]。IL6基因主要编码一种细胞因子,广泛参与免疫炎症反应,临床研究[25]表明高水平的IL-6 是发生PCOS 胰岛素抵抗的独立危险因素,可加重PCOS病情发展。
GO 功能富集分析结果涉及营养代谢,对药物反应,脂多糖反应,细菌来源反应,活性氧物种反应,对类固醇激素反应等生物过程。脂多糖是参与炎症代谢的关键分子,能够刺激多种炎症产生,同时还能促进胰岛素信号通路胰岛素受体底物1 磷酸化,加剧胰岛素抵抗[26]。PCOS 是一种慢性炎症表现,而肠道细菌分子反应与慢性炎症有一定的联系,细菌的异位可以让更多的脂多糖入血,导致内毒素上升,促进卵巢环境炎性改变[27]。活性氧是机体有氧代谢的重要产物,在卵泡微环境中存在着动态氧化与抗氧化平衡,过量的活性氧能对机体产生损伤,PCOS 患者的抗氧化能力水平明显低于正常对照组,提示PCOS 患者抗氧化能力降低,活性氧代谢失衡可能是PCOS 中的重要发病机制[28]。类固醇激素包括性激素、肾上腺皮质激素,肾上腺皮质激素在糖代谢、脂质代谢、胰岛素抵抗、慢性炎症等多途径发挥调节作用,雌孕激素配合发挥募集、选择、优势化功能,促进正常排卵,雄激素介导脂质代谢、胰岛素抵抗等,多途径调节PCOS 患者体内微环境。
通过筛选得到KEGG 前20 条信号通路,主要包括流体剪切应力和动脉硬化通路,糖尿病并发症年龄通路,雌激素信号通路,白介素通路,内分泌阻力通路,多巴胺能突触,GnRH 信号通路,血管内皮生长因子通路等。PCOS 患者常伴胰岛素抵抗、脂质代谢异常,进一步增加了PCOS 患者罹患心血管疾病风险,PCOS 的心血管结局多为代谢综合征,心血管疾病和Ⅱ型糖尿病是PCOS 远期潜在的后遗症[29]。目前临床治疗PCOS 多以改善胰岛素抵抗、降低雄激素、激素治疗为主,对脂质代谢异常及伴随的动脉硬化、远期心血管风险并未予以深入研究。苍附导痰丸通过调控流体剪切应力和动脉硬化信号通路,能改善脂质代谢及动脉硬化,降低PCOS 患者远期心血管不良事件。糖尿病并发症年龄通路与糖尿病血管并发症关系密切,产生大量糖基化产物,造成血管弹性降低,严重影响血管内环境稳态[30]。相对正常人群,PCOS 患者血液系统处于高凝和低纤溶状态[31]。雌激素信号通路、内分泌阻力通路通过参与调控卵泡的生长排出,介导PCOS 患者的小卵泡形成。通过KEGG 分析可以获知,苍附导痰丸主要通过调节脂质代谢、改善胰岛素抵抗、减少炎性反应、降低动脉硬化及血管阻力等多途径来达到治疗PCOS 的目的。
通过网络药理学方法对苍附导痰丸治疗PCOS进行了系统的多成分、靶点、功能分析、信号通路分析,论证了苍附导痰丸通过参与调控脂质代谢、胰岛素抵抗、炎性微环境、动脉硬化血管进程、雄激素水平等发挥治疗作用。本文初步阐释了苍附导痰丸治疗PCOS 的可能作用机制,为后续深入研究及反向论证提供依据,期待未来有进一步的制剂开发应用,使更多的PCOS 患者获益。

