松果体损伤大鼠模型3种制备方法的比较研究
王丹妮,宋美卿,杨 钤,冯玛莉
(山西省中医药研究院中心实验室,太原 030012)
松果体是机体调控生物钟节律的重要组成部分,是维持内源性生物钟运作的核心元件[1-2]。松果体合成分泌的褪黑素(melatonin,MT)具有促进睡眠、调节时差、抗衰老、调节免疫和抗肿瘤等多种作用,因其可促进睡眠,被称为“生理性催眠剂”[3-5]。随着年龄增长,松果体细胞会变大,有空泡改变,合成分泌褪黑素的能力下降,其调节昼夜节律作用减退[6]。目前,松果体损伤动物模型有:通过分离左颈总动脉且永久性结扎,使新生大鼠出现缺氧缺血性脑病,研究松果体对机体昼夜节律的影响[7],该手术操作复杂,成功率低;D-半乳糖致衰老大鼠松果体过氧化损伤模型,造模时间长[8];对氯苯丙氨酸(para-chlorophenylalanine,PCPA)腹腔注射是目前公认的经典失眠动物模型,PCPA通过抑制色氨酸氨化酶合成,减少5-羟色胺(5-hydroxytryptamine,5-HT)的生成,使睡眠-觉醒周期紊乱,该操作较简单,具有良好的可重复性[9];电刺激应激模型可使昼夜节律紊乱,且操作简单,可重复性强[10]。本课题组在制备PCPA致失眠大鼠模型和电刺激致睡眠-觉醒周期紊乱时发现两者均对松果体有影响,为寻找方法简便、造模时间短的松果体损伤模型,开展了以下实验。
1 材料与方法
1.1 动物
清洁级雄性SD大鼠40 只,体质量160~180g,购自北京华阜康生物科技股份有限公司[SCXK(京)2014-0004]。动物饲养于山西省中医药研究院中心实验室(符合动物实验通用要求,可开展SPF级动物实验),温度:20~23℃,湿度:40%~50%。实验经本院伦理委员会审查批准(SZYLY2020KY-0401),实验中涉及处理动物的操作均符合国家相关法规要求。
1.2 主要仪器与试剂
穿梭视屏分析系统(DB079)购自北京智鼠多宝生物科技有限责任公司;大鼠小鼠旷场活动实验系统(OFT-100)购自成都泰盟科技有限公司;全自动全封闭脱水机(Excelsior)购自美国Thermo公司;石蜡包埋机(TKY-BMB)购自湖北康泰医疗设备有限公司;万能显微镜荧光成像系统(BX51+DPT2+IPE)购自日本Olympus 公司;多功能微孔读板机(H1)购自美国BioTek公司;PCPA(批号:1002600696)购自美国Sigma公司;戊巴比妥钠(批号:57-33-0)购自美国Sigma公司;无水碳酸钠(批号:931103)和碳酸氢钠(批号:20070713)均为北京化工厂产品。MT检测用ELISA试剂盒(批号:EME174)购自德国IBL公司。
1.3 模型制备
大鼠适应性饲养1周后,随机分为空白对照组、PCPA组、电刺激组和PCPA联合电刺激组,每组10只。空白对照组不予任何操作,其余各组采用以下不同造模方法。PCPA组:在实验第4天开始腹腔注射PCPA混悬液(分别称取无水碳酸钠及碳酸氢钠3.392 g、1.512 g,分别加蒸馏水320 mL、180 mL,搅拌均匀,混合,检测pH为10.1,将PCPA溶于碳酸盐缓冲液,配制为45 g/L的混悬液,80 ℃加热30 min,超声5 min,现用现配),腹腔注射10 mL/kg,连续2 d。电刺激组:实验第1天将大鼠置于穿梭箱并给予电刺激,电刺激方法为电压30 V、电流0.8A、刺激时间30 s、间隔时间30 s、循环60次,同一时间连续电刺激5 d。PCPA联合电刺激组:电刺激方法同电刺激组,电刺激第4天加用PCPA,方法同PCPA组。
1.4 指标检测
1.4.1 旷场活动测试
旷场为100 cm×100 cm×50 cm的开口箱,将大鼠置于旷场中适应3 min,接着记录5 min活动轨迹,以检测其旷场活动。使用视频软件分析系统,将其底部划分为3×3格子并记录其活动轨迹。检测大鼠活动总路程、平均速度及中央区停留时间。每次更换动物之前,用75%乙醇溶液擦拭旷场及检测仪器,以免上次动物残留信息影响下次测试结果。
1.4.2 高架十字迷宫测试
分别将大鼠置于高架十字迷宫同一处(作为起始位置),视频分析观察其3min内活动轨迹。每次测试结束后,喷洒75%乙醇溶液,清洁大鼠活动区域以祛除残留气味,避免干扰下一只动物的测试结果。
进入开放臂次数(open arm entry,OE):大鼠四足均在开放臂内至任一足从该臂中完全退出的次数总和。进入封闭臂次数:大鼠四足均在封闭臂内至任一足从该臂中完全退出的次数总和。进入开放臂次数百分比(OE%):OE%=进入开放臂次数/(进入开放臂次数+进入封闭臂次数)×100%。进入开放臂的时间(open arm time,OT):大鼠四足均在开放臂中至任一足从该臂中完全退出的时间。进入封闭臂时间:大鼠四足均在封闭臂中至任一足从该臂中完全退出的时间。进入开放臂时间百分比(OT%):OT%=开放臂停留时间/(开放臂停留时间+封闭臂停留时间)×100%。
1.4.3 戊巴比妥钠协同睡眠实验
腹腔注射戊巴比妥钠38 mg/kg,睡眠以翻正反射消失为指标,以大鼠背向下姿势保持30 s以上者,判断为翻正反射消失。记录注射戊巴比妥钠后至大鼠翻正反射消失时间,作为入睡潜伏期;并观察记录翻正反射消失至觉醒的时间,作为睡眠持续时间。
1.4.4 血清MT检测
各组大鼠于第6天上午10∶00腹腔注射10%水合氯醛麻醉,腹主动脉取血,离心3 000 r/min,20 min,取上层血清。采用ELISA双抗夹心法检测血清MT,按照试剂盒说明书进行操作。
1.4.5 松果体病理组织学观察
取血后,大鼠沿枕骨大孔开颅,将大脑人字缝上部充分暴露,见米粒大小松果体。完整取出松果体后,脱颈椎处死大鼠。将剖取的松果体置于体积分数为10%的甲醛溶液中固定,然后行常规脱水、石蜡包埋、切片、HE染色,最后置于光学显微镜下观察。
1.5 统计分析
2 结果
2.1 一般情况
空白对照组大鼠昼夜节律及行为活动正常,被毛柔顺;PCPA组大鼠白天夜晚活动不停,易惊吓,互相打斗,被毛战栗;电刺激组大鼠白天夜晚活动不停,被毛战栗,头部震颤,放置穿梭箱时有对抗行为,对穿梭箱有抵抗;PCPA联合电刺激大鼠白天夜晚活动不停,被毛战栗,易惊吓,互相打斗,头部震颤,对穿梭箱有抵抗。
2.2 旷场活动
PCPA组、电刺激组和PCPA联合电刺激组大鼠旷场活动总距离和平均速度均显著低于空白对照组(P<0.01);PCPA组、PCPA联合电刺激组旷场活动中央区时间均显著高于空白对照组(P<0.05)(表1)。
表 1 各组大鼠旷场活动比较Table 1 Comparison of open field activities in each group of rats( ± s, n=10)
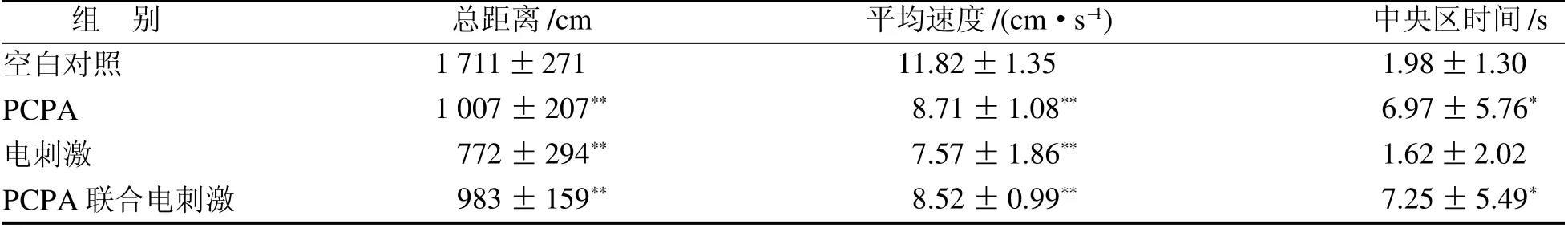
表 1 各组大鼠旷场活动比较Table 1 Comparison of open field activities in each group of rats( ± s, n=10)
注:PCPA为对氯苯丙氨酸。与空白对照组比较,*P<0.05,**P<0.01。
组 别 总距离/cm 平均速度/(cm·s-1) 中央区时间/s空白对照PCPA电刺激PCPA联合电刺激1 711±271 1 007±207** 772±294** 983±159**11.82±1.35 8.71±1.08** 7.57±1.86** 8.52±0.99**1.98±1.30 6.97±5.76*1.62±2.02 7.25±5.49*
2.3 高架十字迷宫
PCPA联合电刺激组大鼠的OE%显著高于空白对照组(P<0.05);PCPA组、PCPA联合电刺激组的OT%均显著高于空白对照组(P<0.05)(表2)。
表 2 各组大鼠高架十字迷宫实验比较Table 2 Comparison of elevated cross-maze experiments in each group of rats( ± s, n=10)

表 2 各组大鼠高架十字迷宫实验比较Table 2 Comparison of elevated cross-maze experiments in each group of rats( ± s, n=10)
注:PCPA为对氯苯丙氨酸,OE%为进入开放臂次数百分比,OT%为进入封闭臂次数百分比。与空白对照组比较,*P<0.05。
组 别 OE% OT%空白对照PCPA电刺激PCPA联合电刺激34.2±23.6 52.1±18.0 48.8±30.6 65.6±31.6*25.4±7.7 48.9±24.1*41.5±39.2 63.9±30.3*
2.4 戊巴比妥钠协同睡眠
PCPA组大鼠入睡潜伏期显著高于空白对照组(P<0.05),而电刺激组及PCPA联合电刺激组与空白对照组比较无明显差异(P>0.05);睡眠持续时间在各组间无明显差异(P>0.05,表3)。
2.5 血清MT
PCPA组、电刺激组、PCPA联合电刺激组大鼠血清MT水平均显著低于空白对照组(P<0.01)(表4)。
表 3 各组大鼠戊巴比妥钠协同睡眠结果Table 3 Synergistic sleep results of pentobarbital sodium administration in each group of rats( ± s, n=10)

表 3 各组大鼠戊巴比妥钠协同睡眠结果Table 3 Synergistic sleep results of pentobarbital sodium administration in each group of rats( ± s, n=10)
注:PCPA为对氯苯丙氨酸。与空白对照组比较,*P<0.05。
?
表 4 各组大鼠血清MT比较Table 4 Comparison of serum MT levels in each group of rats( ± s, n=10)

表 4 各组大鼠血清MT比较Table 4 Comparison of serum MT levels in each group of rats( ± s, n=10)
注:PCPA为对氯苯丙氨酸,MT为褪黑素。与空白对照组比较,**P<0.01。
?
2.6 松果体病理组织学变化
松果体组织中有松果体细胞和胶质细胞,前者占绝大多数。空白对照组松果体细胞和梭形胶质细胞排列紧密,均匀分布,清晰可见(图1A);PCPA组松果体细胞排列紊乱,数目明显减少,空泡变性增多,细胞核固缩且向周边移动,细胞界限模糊(图1B);电刺激组松果体排列紊乱,细胞数目稍减少,空泡变性稍增多,细胞核固缩,细胞核向周围移动,细胞界限模糊(图1C);PCPA联合电刺激组松果体细胞排列紊乱,数目明显减少,空泡变性增多,细胞核固缩且向周边移动,细胞界限模糊(图1D)。
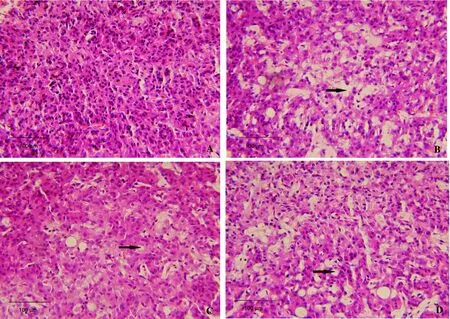
图 1 各组大鼠松果体病理组织学变化(HE染色,×100)Figure 1 Histopathological changes of the pineal gland in each group of rats (HE staining, ×100)
3 讨论
由于大鼠难以用人类所能理解的语言表达,其行为通常以行为实验来评价。行为体现了机体适应新环境的一系列反应,也体现了机体心理活动过程。心理活动在人、动物均有体现,负面心理活动主要包括抑郁、焦虑、恐惧这3类[11]。松果体调控动物的昼夜节律生物钟,也可能参与调控机体情绪。建立松果体损伤模型后,可以通过旷场、高架十字迷宫检测其行为改变。
旷场实验反映动物紧张、兴奋、探索再到适应的一系列过程,兴奋性的大鼠在适应的环境中表现为行动活跃,四处走动[12]。本研究中,PCPA组、电刺激组、PCPA联合电刺激组大鼠兴奋性有下降趋势。高架十字迷宫是大鼠由于好奇心探索新环境(开放臂),同时有嗜暗的天性(封闭臂),两者之间发生“探究-回避”相冲突的行为,产生焦虑心理[13]。本研究中,PCPA组、电刺激组、PCPA联合电刺激组大鼠均未表现出焦虑。
松果体作为调节昼夜节律的器官,其结构功能的完整性具有重要意义。松果体组织病理学结果表明,3种造模方法均造成大鼠松果体细胞不同程度浓缩、空泡变性、核固缩、向周边移动,表明细胞出现变性、凋亡和不同程度的坏死损伤,其中PCPA联合电刺激最严重,PCPA次之,电刺激细胞损伤程度较轻。松果体细胞合成分泌MT,合成后并不储存于松果体细胞中,而是被迅速地分泌到周围血液中。因此,血液中的MT水平可以准确反映松果体合成分泌MT的能力[14]。松果体细胞受损,血清中MT含量减少,入睡潜伏期增加。
综上所述,大鼠腹腔注射PCPA、电刺激及PCPA联合电刺激,这3种方法均可造成大鼠不同程度的松果体损伤,可作为松果体损伤相关疾病研究时动物模型的建立方法,但其具体机制尚待进一步研究。

