HBP21 抑制胰岛素诱导的PI3K/AKT信号通路机制
朱海珍,王鑫涛,许艳,田仁云,邓日林,王静静,陈生稳,李慧逸
(1.湖南大学 生物学院,湖南 长沙 410082;2.湖南大学 病原生物学与免疫学研究所,湖南 长沙 410082;3.湖南大学化学生物传感与计量学国家重点实验室,湖南长沙 410082)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六大常见恶性肿瘤,位居全球癌症相关死亡的第四位,一般认为肝癌的发生与慢性乙型和丙型肝炎病毒感染、酗酒或饮食中接触黄曲霉毒素有关[1-2].像许多其他癌症一样,肝细胞表型逐渐演变为发育不良的肝细胞,最后演变为肝癌,并积累了遗传和表观遗传改变.尽管人们已经对HCC 的发病机制进行了较深入的研究,但涉及HCC 发病的详细分子机制仍有待进一步研究.
胰岛素(insulin)与其受体(IR)的结合在哺乳动物细胞中启动了一系列复杂的生物学效应[3],胰岛素结合并激活IRβ 亚单位酪氨酸激酶,使IR 底物蛋白磷酸化.IRS1 和IRS2 这两个主要底物与磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)通路和Ras-丝裂原活化蛋白激酶(MAPK)通路有关,PI3K/AKT通路负责胰岛素的大部分代谢活动,Ras-MAPK 通路与PI3K 通路协同控制细胞增殖[4-5].IR 可以磷酸化至少6 种已知的底物蛋白,它们能够与5 种主要形式的PI3K 调节亚基相互作用[6-7].PI3K 被IR 磷酸化激活后,将磷脂酰肌醇二磷酸(PIP2)磷酸化生产磷脂酰肌醇三磷酸(PIP3),活化后的PIP3 进而激活丙酮酸脱氢酶激酶同工酶1(PDK1),激活后的PDK1发挥蛋白激酶功能,进而激活已知的AKT 的3种亚型[8-10].
PI3K/AKT 信号通路参与控制细胞生长和增殖,并在不同的癌症类型中表现出结构性激活,PI3K 活性受多种癌基因和生长因子受体的刺激,PI3K 信号通路的活化被认为是癌症的标志[11-12].最近对人类癌症基因组的研究结果显示,在广泛的人类癌症中,PI3K 通路的许多成分经常成为种系或体细胞突变的靶点,这些靶点已成为癌症干预治疗最有吸引力的靶点之一[13-14].
热休克蛋白HSP70 结合蛋白21(Hsp70 binding protein 21,HBP21)又叫TTC36,是TPR 基序家族的新成员,是热休克蛋白70(HSP70)的分子伴侣,研究发现特别是在热和化疗药物治疗等不利条件下,HBP21 可以促进细胞凋亡.HBP21 作为HSP70 的伴侣,可以抑制HSP70 与Bax 的相互作用,增加Bax 蛋白从胞浆到线粒体的转位,进而增加细胞色素c 的释放,最终诱导细胞凋亡[15-16].研究表明,HSP70 的上调可以抵抗各种不利条件,并抑制癌细胞的凋亡,促进PI3K/AKT 通路的活化[17].到目前为止,HBP21是否参与调节PI3K/AKT 信号通路尚不清楚.
本文研究了肝细胞癌中低表达的HBP21 与肝细胞癌中异常激活的PI3K/AKT 信号通路之间的关系,发现HBP21 参与调控胰岛素诱导的PI3K/AKT信号通路,此发现或许为未来靶向PI3K/AKT 信号通路,治疗癌症提供新的理论依据.
1 材料与方法
1.1 细胞系及细胞培养
Huh7 细胞购自American Type Culture Collection;HEK293T 细胞购买于武汉博士德公司.Huh7细胞和HEK293T 细胞在含有10% 胎牛血清、L-谷氨酰胺、非必需氨基酸、青霉素和链霉素的杜尔贝科改良鹰培养基(dulbecco’s modified eagle medium,DMEM)中增殖.所有细胞系在含5%体积CO2加湿细胞培养箱中保持37 ℃进行培养.肝癌组织样品从湖南省肿瘤医院获取.
1.2 实验试剂
DMEM 培养基底液(美国Gibco 公司),LY294002(10 μmol/mL)抑制剂(美国CST 公司),Insulin(100 mIU/mL)(美国CST 公司),MG132(美国Sigma 公司),DMSO(美国Sigma 公司),10×PBS(实验室配置),胰蛋白酶(Invitrogen 公司),免疫沉淀磁珠protein A G(德国Merck 公司),2×Laemmli Buffer(Bio-Rad 公司),β-巯基乙醇(Bio-Rad 公司),Trizol试剂(Invitrogen 公司),RT-PCR 试剂盒(Invitrogen公司),SYBR Green 定量试剂盒(Taraka 公司),全细胞裂解液RIPA Buffer(Thermo 公司),蛋白酶抑制剂和磷酸酶抑制剂(德国Merck 公司),mTOR/p-mTOR抗体(美国Santa 公司),AKT/p-AKT 抗体(美国CST公司),HBP21(英国Abcam 公司),PTEN 抗体(美国CST 公司),IRβ/p-IRβ(美国CST 公司),β-actin/Flag/V5(美国Sigma 公司),goat-anti-Mouse/goatanti-Rabbit(美国Sigma 公司),质粒提取试剂盒(上海生工),胶回收试剂盒(上海生工).
1.3 实验仪器及材料
CO2恒温细胞培养箱,细胞培养皿(美国Corning),细胞计数板(Bio-Rad 公司),移液管,细菌培养箱,37 ℃恒温水浴锅,37 ℃恒温摇床7500 荧光定量仪器,聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),滤纸,Eppendorf PCR 仪器,Eppendorf 移液枪,化学发光成像仪(Bio-Rad 公司),qRT-PCR 八联管,4 ℃低温高速离心机,电泳槽(Bio-Rad 公司).
1.4 实验方法
1.4.1 HBP21 和AKT 质粒的构建与鉴定
从美国国家生物信息中心(National Center for Biotechnology Information Search database,NCBI)找到相关基因的蛋白质编码区(Sequence coding for aminoacids in protein,CDS),利用Primer 5.0 软件设计基因的前后引物.提取Huh7 细胞的总RNA,通过逆转录试剂盒将提取的总RNA 逆转录成cDNA,按照设定好的程序通过聚合酶链式反应(PCR)仪器扩增目的基因.通过琼脂糖凝胶电泳实验验证目的基因的特异性,并对凝胶中的特异性条带进行胶回收实验.对胶回收得到的目的基因与载体(P3xFlag-CMV-vector 或PcDNA3.1a-V5-vector)进行双酶切实验,将酶切后的目的基因与载体通过T4 DNA 连接酶进行连接得到完整的质粒.采用感受态细胞(DH5α)对质粒进行转化实验,挑取生长在含有抗生素培养皿上的单个细菌菌落进行扩大培养,通过质粒提取试剂盒将扩大培养的菌落进行DNA 提取,对核酸进行酶切与鉴定实验,并提取DNA 送入公司测序.质粒HA-K48 和HA-K63 由北京大学蒋正凡教授提供.HBP21 和AKT 的前引物和后引物序列见表1.
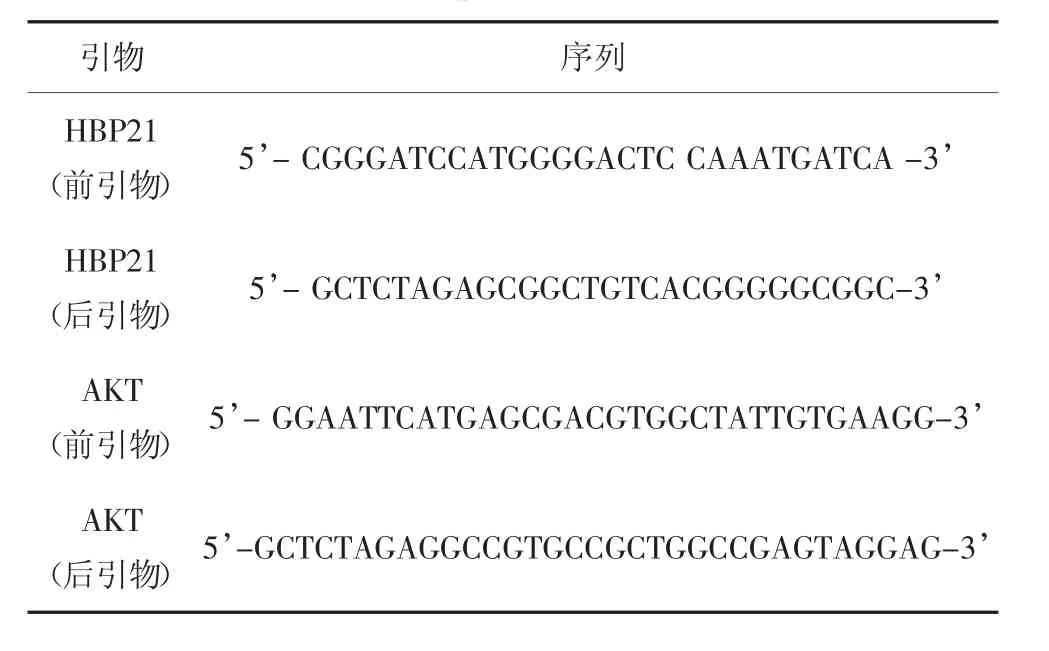
表1 PCR 引物Tab.1 Primer sequences for PCR reaction
1.4.2 实时荧光定量PCR(qRT-PCR)
利用TRizol 裂解细胞,按照试剂盒流程提取细胞RNA,通过RT-PCR 试剂盒将提取的RNA 逆转录成cDNA,参照SYBR Green 试剂盒说明书对cDNA 样品进行稀释.每个八连管中加入2 μL cDNA 模板、上下游引物各0.2 μL、5 μL SYBR 试剂、2.6 μL去离子水,每个样品做3 组重复实验,最后将装有样品的八连管放入仪器内进行定量实验.定量PCR 引物序列见表2.

表2 定量PCR 引物序列Tab.2 Primer sequences for qRT-PCR reaction
1.4.3 蛋白免疫印迹实验
处理细胞之前,先用1×PBS 清洗细胞2~3 遍,清洗完细胞之后,使用含有蛋白酶抑制剂和磷酸酶抑制剂的全细胞裂解液对细胞进行裂解,细胞裂解在冰上操作,裂解细胞时间为5 min.裂解完成之后,利用特有的细胞刮子将细胞从细胞培养皿中刮下,使用移液枪将裂解液全部转入1.5 mL EP 管中,冰上静置20 min.将全细胞裂解液放入提前降温到4 ℃的离心机中,13 200 r/min,离心15 min.将蛋白样品与上样缓冲液(2×Laemmli Buffer)同比例混匀,放入金属浴中,100 ℃煮5 min,使蛋白发生变性.利用聚丙烯酰胺凝胶(SDS-PEG)进行蛋白跑胶实验,不同目的蛋白选用不同的抗体进行孵育,最后利用化学发光成像仪对样品进行曝光处理.
1.4.4 泛素化实验
在HEK293T 细胞中转染质粒pV5-vector、pV5-HBP21、pFlag-AKT1、pHA-ub 或 者pHA-K48O 和pHA-K 63O 42 h 之后,再用MG132(25 μmol/mL)处理6 h,然后通过蛋白免疫印迹实验分析相关蛋白.
1.4.5 数据分析
采用学生t 检验(Student's t-test)对定量数据进行分析,对照组和实验组之间的显著性差异程度可以用P 值表示,其中P 值小于0.05 被认为具有统计学意义.P 值小于0.05,用“*”号表示;P 值小于0.01,用“**”号表示;P 值小于0.001,用“***”表示.所有的“*”号在图柱中表示实验组和对照组之间有显著性差异.
2 结果
2.1 HBP21 在肝癌组织中低表达
有研究表明,HBP21 在癌组织中呈低表达状态,HBP21 作为HSP70 的伴侣,可以抑制HSP70 与Bax的相互作用,增加Bax 蛋白从细胞质到线粒体的转位,进而增加细胞色素c 的释放,最终诱导细胞凋亡[18].为了检测HBP21 在肝癌组织中的表达情况,本文收集了9 例原发性肝癌与癌旁组织,借助qRTPCR 技术检测样本组织中HBP21 基因的mRNA 表达水平,发现在肝癌组织中HBP21 的mRNA 水平明显低于其对应的癌旁组织(虽然第5 和第6 组的定量数据存在一定的误差,但仍具有统计学意义,癌组织中HBP21 的mRNA 水平明显低于相对应的癌旁组织),这说明HBP21 在肝癌细胞中缺失表达,定量结果如图1(a)所示.HSP70 的上调可以抵抗各种不利条件,通过促进PI3K/AKT 通路的活化抑制癌细胞发生凋亡[18].有研究报道PI3K/AKT 信号通路在癌症中经常处于异常激活的状态[2],因此,推测在肝癌中低表达的HBP21 和HSP70 一样参与调控PI3K/AKT信号通路.胰岛素作为一种生长因子与其受体结合能够激活许多信号分子,其中PI3K/AKT 信号通路作为其下游重要的信号通路能够在胰岛素的作用下发生显著性活化[6].为研究HBP21 与胰岛素诱导的PI3K/AKT 信号通路之间是否存在联系,用胰岛素处理Huh7 细胞,检测HBP21 的mRNA 水平和蛋白水平,随着处理时间的延长,HBP21 的mRNA 水平呈下降趋势,尤其是在处理30 min 后,现象更为明显,结果如图1(b)所示.用胰岛素分别处理Huh7 细胞,随着处理时间的延长,HBP21 的蛋白水平逐渐降低,尤其是胰岛素处理细胞30 min 后,HBP21 的蛋白水平下调趋势更为明显,结果如图1(c)所示.综上所述,肝癌组织中低表达的HBP21 可能与胰岛素诱导的PI3K/AKT 信号通路之间存在联系.

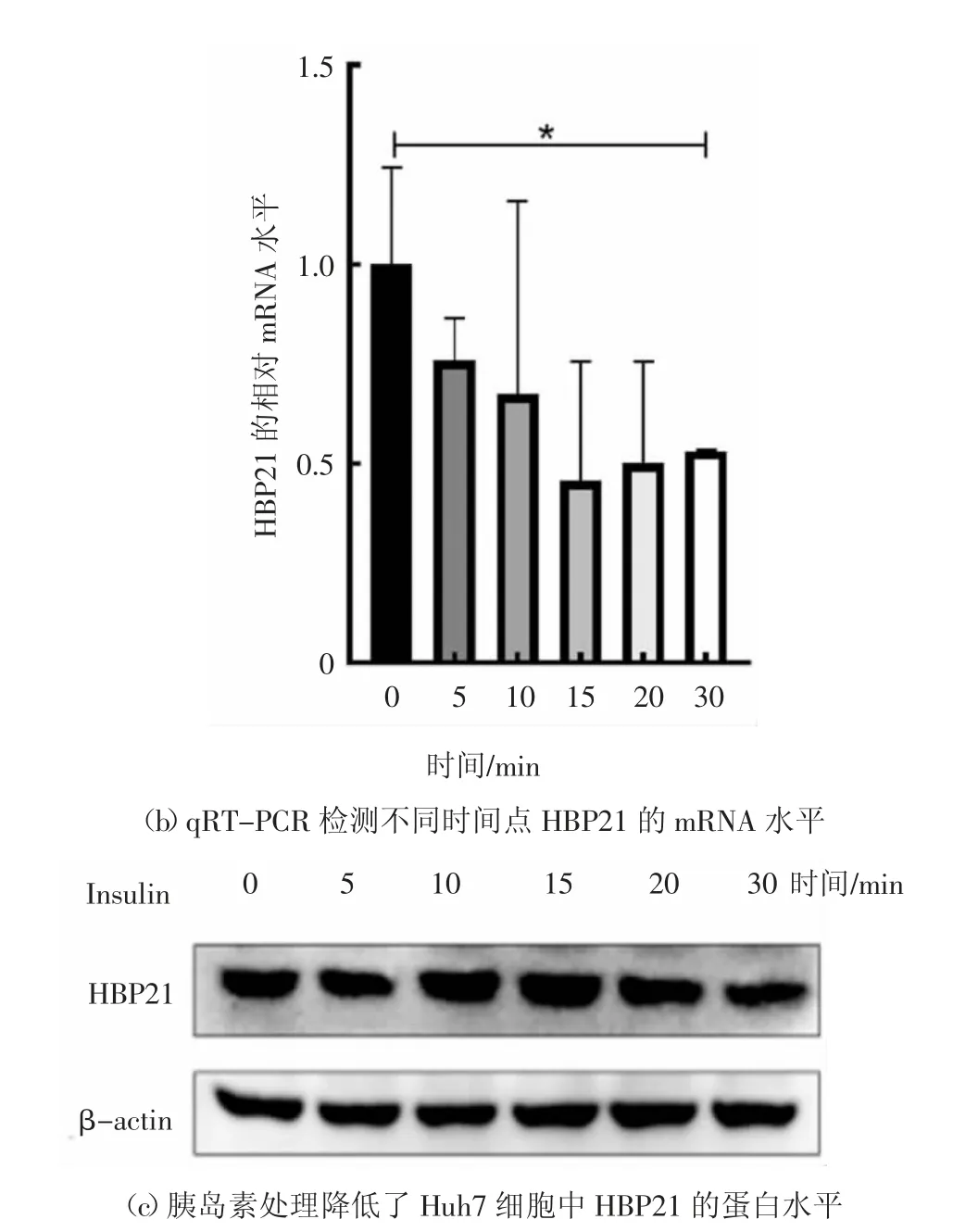
图1 肝癌组织中HBP21 表达量低于癌旁组织Fig.1 HBP21 expression in liver cancer tissues is lower than that in adjacent tissues
2.2 HBP21 抑制胰岛素诱导的AKT 和mTOR 的活化
研究表明,在20%~60%的人类HCC 中激活了5个主要途径,包括PI3K/AKT、Myc、Wnt/β-catenin、Hedgehog 和Met 途径[2].胰岛素能激活PI3K/AKT 信号通路,胰岛素及其受体在肿瘤发生发展中的作用得到了临床证据的支持,有研究表明,即使低剂量的胰岛素就可促进癌细胞生长[19-20].
为了研究HBP21 是否调控肿瘤细胞内的PI3K/AKT 信号通路,首先构建HBP21 质粒,然后在肝癌细胞Huh7 内过表达HBP21 质粒,在胰岛素的作用下,研究HBP21 对PI3K/AKT 信号通路的影响.在Huh7 细胞中转染HBP21 质粒48 h 后,采用不同时间点用Insulin(100 mIU/mL)处理Huh7 细胞,实验发现,随着胰岛素处理时间的延长,AKT Ser473 位点的磷酸化逐渐增加,但是转染了HBP21 质粒的实验组与对照组相比,胰岛素诱导的AKT 的磷酸化明显被抑制,尤其在处理30 min 后抑制更加明显,实验结果见图2(a).这一实验结果表明,HBP21 抑制了胰岛素诱导的AKT 磷酸化.为了研究HBP21 是否影响AKT 下游mTOR 的活化,同样地,在Huh7 细胞中过表达HBP21 质粒,然后用Insulin(100 mIU/mL)处理细胞,处理时间分别为0 min、15 min、30 min,实验发现,随着胰岛素处理时间的延长,mTOR 磷酸化在逐渐增加,但是转染了HBP21 质粒的实验组与对照组相比,胰岛素诱导的AKT 下游的mTOR 磷酸化明显被抑制,尤其在处理30 min 后抑制更加明显,实验结果见图2(b).这一实验结果表明,HBP21 可抑制AKT 下游的mTOR 磷酸化.综合以上结果,说明HBP21 参与调控胰岛素诱导的PI3K/AKT 信号通路的活化.

图2 HBP21 抑制胰岛素诱导的AKT 和mTOR 的磷酸化Fig.2 HBP21 inhibits insulin-induced phosphorylation of AKT and mTOR
2.3 HBP21 不影响PTEN 的蛋白水平及AKT 的泛素化
PTEN 作为一种重要的抑癌基因,它可以抑制PI3K/AKT 信号通路的活性,PTEN 发挥它的作用是通过其磷酸酶活性将磷脂酰肌醇-3,4,5-三磷酸(PIP3)变成磷脂酰肌醇-4,5-二磷酸(PIP2),因此不能使下游AKT 发生磷酸化从而抑制AKT 的活化[21-22].为了探究HBP21 是否通过影响PTEN 进而影响AKT 的磷酸化,我们在Huh7 细胞中过表达HBP21 质粒,然后用胰岛素处理细胞,通过蛋白免疫印迹实验发现HBP21 对PTEN 的蛋白水平并没有直接的影响,实验结果见图3(a).已知AKT 磷酸化的充分条件首先是要其发生K63 位的泛素化激活,而K48 位是泛素化降解[23].为了验证HBP21 对AKT磷酸化影响的具体机制,首先研究了HBP21 对AKT 的泛素化的影响.在HEK293T 细胞中转染质粒V5-vector、V5-HBP21、Flag-AKT1、HA-ub、HAK48O 和HA-K63O 42 h,再用MG132(25 μmol/mL)处理6 h 后收集蛋白,通过实验发现,HBP21 对AKT的K48 及K63 位泛素化都没有明显的影响,实验结果见图3(b),这说明HBP21 对AKT 磷酸化的影响并非是对其泛素化的影响.综合以上结果说明,HBP21 并非是通过影响AKT 的泛素化以及PTEN的蛋白水平来抑制AKT 的活化.

图3 HBP21 不影响PTEN 的蛋白水平和AKT 的泛素化Fig.3 HBP21 does not affect the protein level of PTEN and the ubiquitination of AKT
2.4 HBP21 作用于PI3K/AKT 信号通路
PI3K 是一种激酶,当它被胰岛素诱导激活后,可进一步激活下游的AKT 及mTOR.LY294002 是PI3K 的高选择性抑制剂,明显抑制PI3K 激酶的酶活,使其不能发挥激酶功能[24].使用抑制剂处理Huh7细胞,首先在Huh7 细胞内转染HBP21 质粒44 h,然后用PI3K 的抑制剂LY294002(10 μmol/mL)再处理细胞4 h,最后用胰岛素处理细胞30 min.根据蛋白结果图发现,在胰岛素处理细胞30 min 后,AKT 的磷酸化水平有明显升高,并且抑制剂能够明显抑制胰岛素诱导的AKT 和mTOR 的磷酸化,实验结果见图4(a).在无胰岛素诱导下,HBP21 也可明显抑制AKT 的磷酸化,而且抑制剂增强了HBP21 对AKT 磷酸化的抑制作用,实验结果见图4(b).综合以上实验结果,发现HBP21 作用于胰岛素诱导的PI3K/AKT信号通路,抑制AKT 的磷酸化,因此,推测HBP21 对AKT 的影响可能是作用于PI3K 的上游分子.

图4 HBP21 作用于PI3K/AKT 信号通路Fig.4 HBP21 acts on PI3K/AKT signaling pathway
2.5 HBP21 抑制胰岛素受体IRβ 的磷酸化
胰岛素与其受体(IR)的结合在哺乳动物细胞中启动了一系列复杂的生物学效应.胰岛素结合并激活IRβ 亚单位酪氨酸激酶,使IR 底物蛋白磷酸化[25].IRS1 和IRS2 这两个主要底物与PI3K-AKT 通路有关,并且PI3K-AKT 通路负责胰岛素的大部分代谢活动[4-5].通过前面的实验结果发现HBP21 抑制胰岛素诱导PI3K/AKT 通路中的AKT 磷酸化,推测HBP21 可能是通过作用于AKT 的上游分子影响AKT 磷酸化的影响,因此,主要研究HBP21 对该信号通路上游分子IRS1/2 和IRβ 的影响.在Huh7 细胞中转染HBP21 质粒48 h 后,再以胰岛素处理细胞30 min,收集细胞RNA,检测IRS1/2 的mRNA 水平.通过对荧光定量PCR 数据进行分析,在胰岛素处理细胞30 min 后,发现HBP21 对IRS1 和IRS2 的mRNA 水平并没有影响,实验结果见图5(a)和(b).HBP21 质粒在Huh7 细胞中的过表达效果得到验证,见图5(c),这一结果表明HBP21 可能不是通过作用于IRS1 和IRS2 的mRNA 水平影响AKT 的磷酸化.
由上述分析可知,推测HBP21 可能影响了胰岛素受体IRβ 亚基的活性.为了研究HBP21 是否影响AKT 上游IRβ 的活化,在Huh7 细胞中过表达HBP21 质粒,然后用胰岛素分别处理0 min、15 min、30 min,实验发现,随着胰岛素处理时间的延长,IRβ磷酸化在逐渐增加,但是转染了HBP21 质粒的实验组与对照组相比,胰岛素诱导的AKT 上游的IRβ 磷酸化明显被抑制,尤其是处理30 min 后抑制更加明显,相应地,HBP21 同样抑制了AKT 的磷酸化,实验结果见图5(d).综合以上实验结果,可以得出结论,HBP21 通过抑制胰岛素受体(IRβ)磷酸化,进而影响其下游AKT 磷酸化.
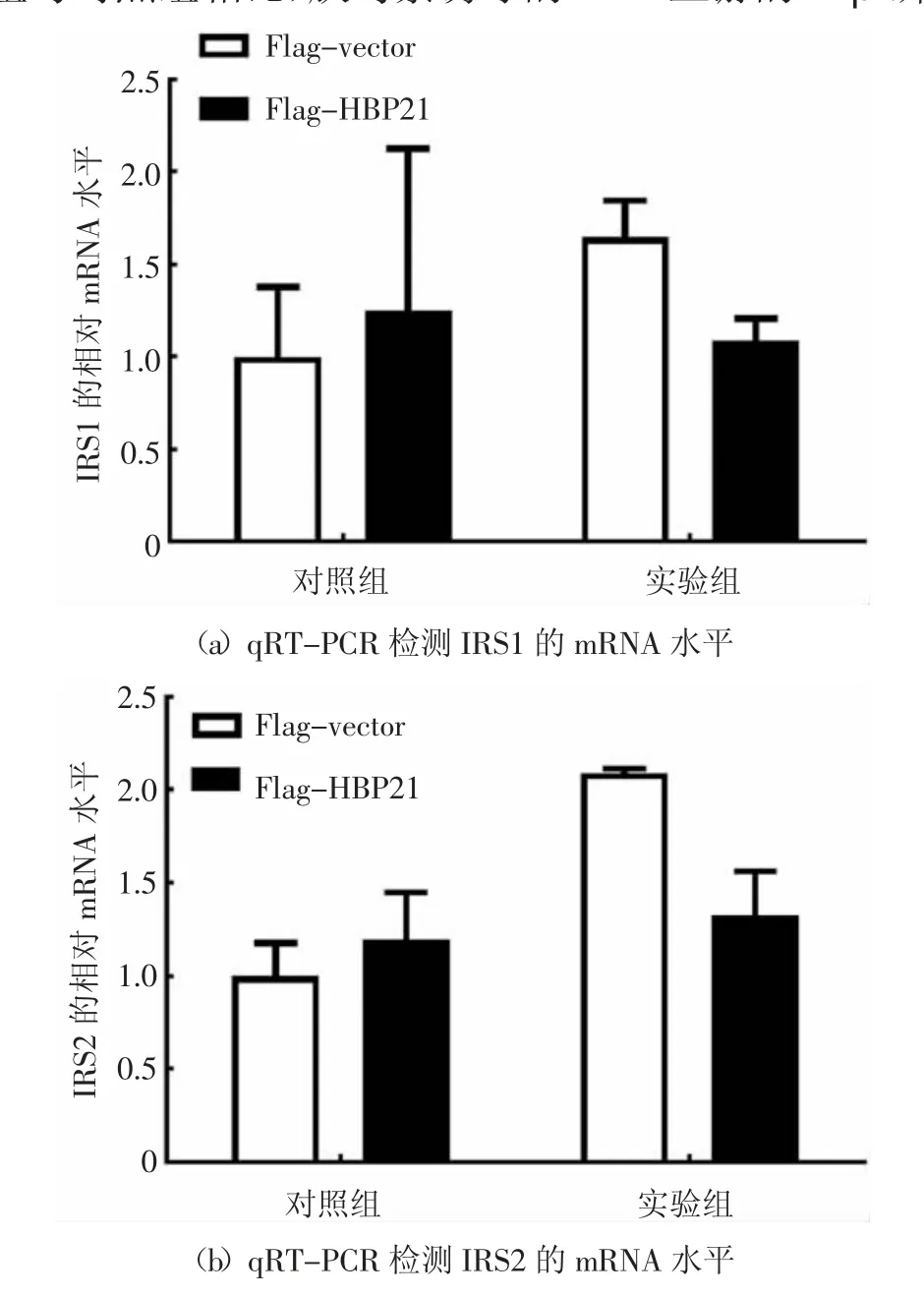
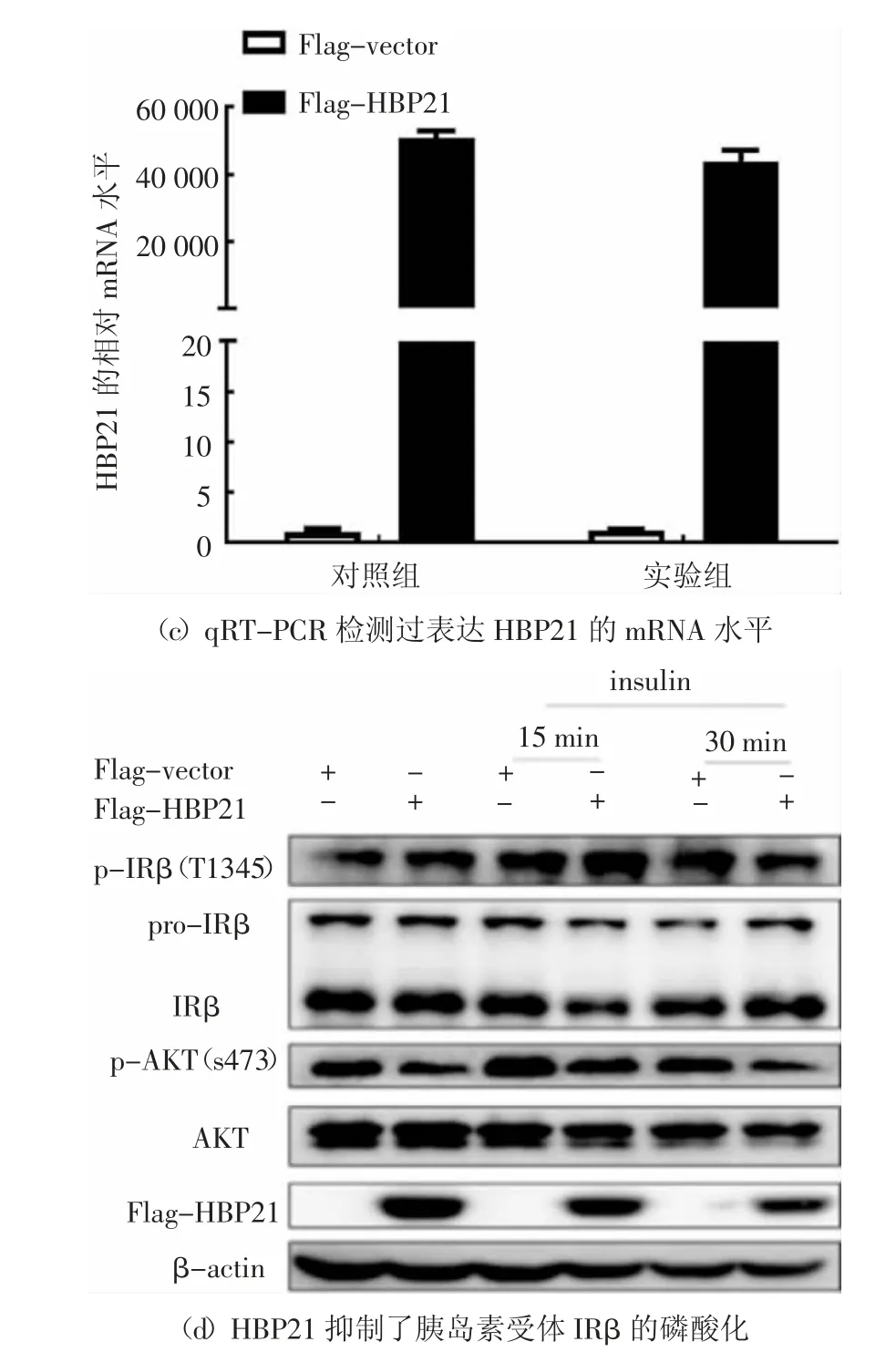
图5 HBP21 抑制IRβ 的磷酸化Fig.5 HBP21 inhibits thephosphorylation of IRβ
3 结论
通过荧光定量PCR 技术检测病人肝癌和癌旁组织中HBP21 的mRNA 水平,发现肝癌组织中HBP21 的mRNA 水平异常低于癌旁组织.用胰岛素处理肝癌细胞Huh7,目的是激活PI3K/AKT 信号通路,发现随着胰岛素处理时间的延长,HBP21 的mRNA 和蛋白水平都呈现低表达趋势.将体外构建的HBP21 质粒转染进Huh7 细胞,通过蛋白免疫印迹实验发现,HBP21 显著抑制PI3K/AKT 信号通路中AKT 丝氨酸473 位点的磷酸化及AKT 下游mTOR 的磷酸化.进一步实验发现,HBP21 抑制AKT的磷酸化的功能并不是通过影响PTEN 的蛋白水平和AKT 的泛素化来实现的.采用LY294002 抑制剂处理Huh7 细胞,确定了HBP21 作用于PI3K/AKT信号通路.通过一系列实验发现,HBP21 通过抑制胰岛素受体IRβ 的磷酸化,进而影响其下游的AKT 的磷酸化.
本研究阐述了HBP21 抑制PI3K/AKT 信号通路的机制,丰富了HBP21 作为抑癌基因的功能,但仍存在一些亟待解决的问题.例如HBP21 是如何影响IRβ 的磷酸化;是否存在其他蛋白协同HBP21 参与调控PI3K/AKT 信号通路;HBP21 是否具有磷酸酶的功能,这些问题需要进一步通过实验来解决.
本文的研究为治疗肝癌提供了新的思路,HBP21 在肝细胞癌中的缺失表达及其抑制PI3K/AKT 的活化有可能成为潜在治疗癌症的靶点.

