茉莉酸甲酯处理对‘黑比诺’和‘马瑟兰’葡萄酒酚类化合物的影响
宫鹏飞,李蔚,孙永蓉,史肖,牛见明,韩舜愈*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州,730070) 3(甘肃省葡萄与葡萄酒产业技术研发中心,甘肃 兰州,730070)
酚类化合物是植物代谢过程中重要的次生代谢产物。目前发现的天然酚类化合物有8 000余种,其中黄酮类化合物占50%以上,但在不同种类植物的不同部位,其分布、组成与含量存在着很大差异[1-2]。葡萄的酚类化合物主要存在于种子(60%~70%)和果皮(28%~35%)中,在果肉中含量较少(<10%)[3-4]。葡萄和葡萄酒的酚类物质主要分为花色苷酚和非花色苷酚(酚酸、黄酮醇类、黄烷醇类和芪类)2种[5]。花色苷酚是葡萄和葡萄酒颜色的主要承担者,非花色苷酚可以作为辅色剂与其他多酚化合物结合,可增强红葡萄酒的色度及其颜色稳定性[6]。同时它对葡萄酒的苦味、收敛性、澄清度、贮藏寿命和生物化学稳定性等也有重要作用[7]。
茉莉酸甲酯(methyl jasmonate,MeJA)作为一种重要的细胞调节因子,参与了种子萌发、根生长、育性、果实成熟和衰老等发育过程以及对生物和非生物胁迫的防御反应[8]。研究发现,MeJA处理后茉莉酸生物合成和次生代谢相关基因的表达上调[8]。近几年,MeJA也逐渐开始应用于酿酒葡萄,研究发现外源MeJA处理可以改善葡萄芳香化合物的品质,促进浆果中酚类化合物的积累[9-10]。因此,为了解决河西走廊酿酒葡萄产区葡萄酒存在的问题,如色泽较浅、颜色不稳定和老化速度快等问题,本试验以酿酒葡萄‘黑比诺’和‘马瑟兰’为原料,通过在转色初期对其进行MeJA喷施处理,待成熟后采收并进行酿酒试验,分析葡萄酒中酚类化合物的变化,为利用MeJA提高葡萄酒的品质提供技术支撑和数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
‘黑比诺’和‘马瑟兰’葡萄原料来自于甘肃省武威市林业研究院葡萄基地。
1.1.2 试剂
茉莉酸甲酯(分析纯),Sigma公司;二甲花翠素-3-O-葡萄糖苷(≥98.0%),Miragen公司;甲酸和乙酸(色谱级),Thermo Scientific公司;乙腈和甲醇(色谱级),Merck公司;水,广州屈臣氏食品饮料有限公司;酚酸类(水杨酸、香草酸等)、黄酮醇类(柚皮素、槲皮素、杨梅素、芦丁等)、黄烷醇类(表儿茶素、儿茶素、原花青素B1等)以及白藜芦醇38种非花色苷标准品,百灵威科技有限公司和上海阿拉丁生物科技股份有限公司。
1.1.3 主要仪器
1290-6460型超高效液相色谱-质谱联用仪,安捷伦科技有限公司;Genesis 10 S型紫外-可见分光光度仪,Thermo Scientific公司;RE-6000A旋转蒸发器,上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 田间处理
2种葡萄品种均选取6行生长良好和生长状况基本相同的葡萄植株,每行选择15株,处理组和对照组均做3个重复。选择时去除田间边缘的植株,尽可能避免边缘差异的影响。
MeJA采用体积分数1%的乙醇溶解后,加入体积分数0.1%的吐温-80乳化,用蒸馏水定容配制成浓度为10 mmol/L。对照组为相同浓度的乙醇和吐温-80的水溶液[11]。在转色初期对葡萄果树进行喷施处理,将配制好的药液均匀喷施于葡萄叶面和叶背及果实,至药液欲滴为止,每株大约200 mL[11]。
1.2.2 干红葡萄酒酿造工艺
原料分选→除梗破碎→添加果胶酶和SO2→低温浸渍→接种酵母→酒精发酵→酒精发酵结束→皮渣分离→接种乳酸菌→苹乳发酵→苹乳发酵结束→取样保存。
葡萄原料经筛选、除梗破碎后,将每个处理的葡萄分装在3个20 L的不锈钢罐中,共12罐。添加60 mg/L SO2和2 g/L果胶酶,4 ℃浸渍3 d后,加入活化后的红佳酿酵母进行酒精发酵,每天手动摇罐3次。还原糖的含量低于4 g/L时终止酒精发酵,之后去除皮渣,重新装入5 L棕色罐后,加入0.02 g/L乳酸菌进行苹乳发酵,结束后加入60 mg/L SO2,取样保存。
1.2.3 理化指标的测定
总酸、挥发酸、pH和酒度参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定[12]。
总酚:采用Folin-Ciocalteu方法进行测定[13]。
总花色苷:参照翦祎等[14]的方法,采用pH示差法进行测定。
1.2.4 花色苷多酚的测定
参照陈欣然等[15]优化的方法。采用1290-6460型HPLC-MS/MS进行检测。色谱柱:Poroshell 120 EC-C18(150 mm× 2.1 mm,2.7 μm);流动相A:V甲酸∶V水=0.2∶100,流动相B:V甲酸∶V甲醇∶V乙腈=0.2∶50∶50;梯度洗脱程序:0~27 min 90%A~10%B,27~28 min 44%A~56%B,28~33 min 90%A~10%B;柱温:30℃。
1.2.5 非花色苷多酚的测定
参照PORTU等[16]优化的方法。采用1290-6460型HPLC-MS/MS 进行检测。色谱柱:Zorbax SBC-18(150 mm×2.1 mm,3.5 μm);流动相A:V水∶V醋酸=0.2∶100,流动相B:纯乙腈;柱温:30℃;进样量10 μL;流速:0.2 mL/min;梯度洗脱程序: 0~5 min 2%A~7%B,5~45 min 7%A~30%B,45~46 min 30%A~65%B;46~47 min 65%A~95%B,47~50 min 95%A~2%B;平衡时间:3min。ESI离子源负离子模式下,离子源温度350 ℃,雾化气压力为30 psi;干燥气流速为10 mL/min;干燥气温度350 ℃;离子扫描范围m/z50~1 500。通过样品图谱信息与保留时间和谱库相应物质信息对比判定进行定性。通过外标法对非花色苷多酚的含量进行定量。
1.3 数据处理
利用Microsoft Office Excel 2010软件对样本(n=3)所得数据进行基本处理,并利用Origin 9.1软件进行制图。采用IBM SPSS Statistics 19.0分析软件对数据进行差异分析(Duncan法,P<0.05)和主成分分析。
2 结果与分析
2.1 茉莉酸甲酯处理对葡萄酒基本理化指标的影响
2种葡萄酒的基本理化指标见表1。总体上,MeJA处理后2种酒样总酸、挥发酸、酒度均无显著差异(P>0.05),且符合国标对于干红葡萄酒的规定。MeJA处理后,黑比诺和马瑟兰酒样中总酚的含量分别提高了0.10和0.93 g/L,总花色苷的含量分别提高了100.40和51.66 mg/L,且2种酒样中总酚和总花色苷均具有显著差异(P<0.05)。
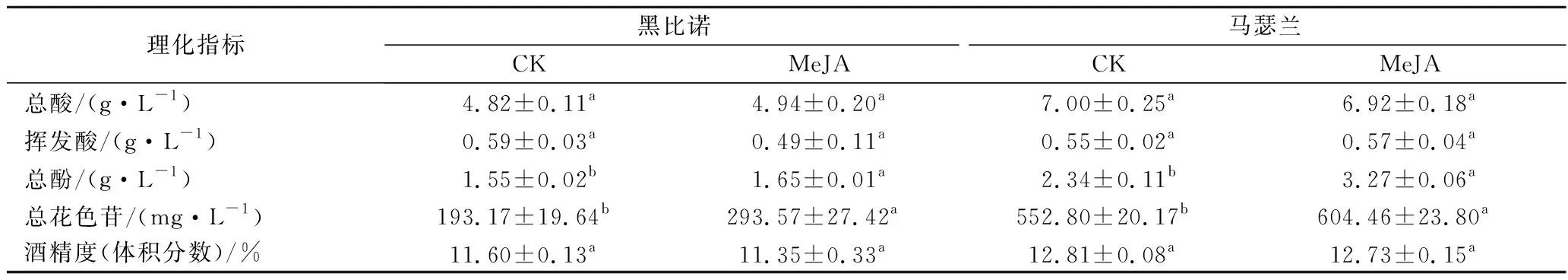
表1 葡萄酒的基本理化指标Table 1 Basic physical and chemical indicators of wines
花色苷酚是葡萄酒中主要的呈色物质,并且研究发现葡萄酒花色苷与CIELab色值中L*、b*和H*ab值呈负相关,与a*和C*ab值呈正相关,花色苷能够解释新葡萄酒红色(a*)的64.56%~81.57%[17],因此其含量的增加对红葡萄酒的颜色具有重要影响。
2.2 茉莉酸甲酯处理对葡萄酒中花色苷酚的影响
2.2.1 茉莉酸甲酯处理对葡萄酒中单体花色苷的影响
由表2可知,2种酒样中共检测出5种单体花色苷,且大部分研究也显示欧亚种葡萄中只存在5种单体花色苷及其衍生物,而花葵素-3-O-葡萄糖苷及其衍生物基本未检测到[15]。MeJA处理后,黑比诺和马瑟兰酒样中5种单体花色苷的总含量分别上升了23.46%和4.64%,但无显著差异(P>0.05)。除了黑比诺酒样中甲基花翠素-3-O-葡萄糖苷的含量显著升高(P<0.05),其他单体花色苷的含量无明显差异。
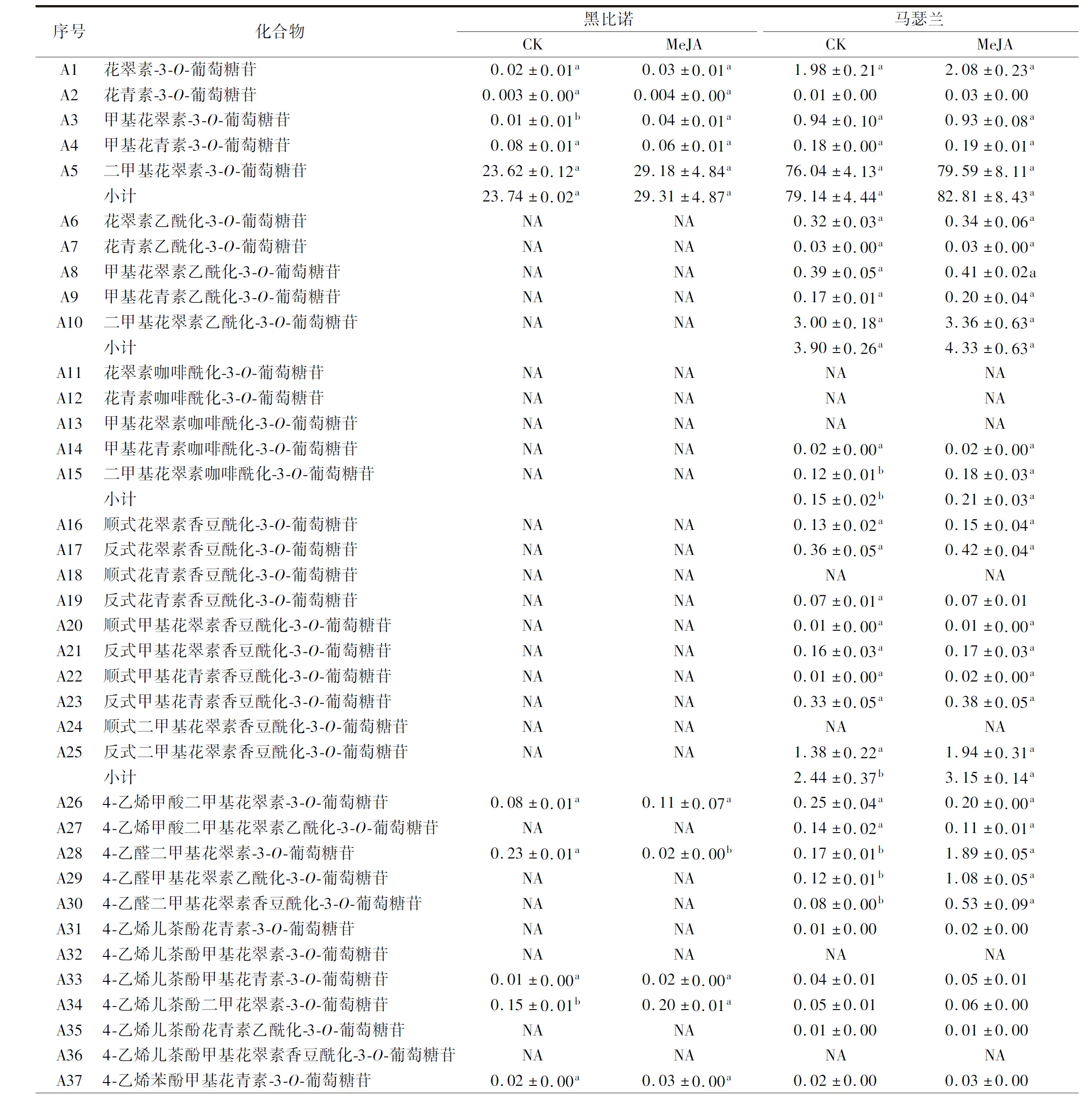
表2 葡萄酒中花色苷酚的含量 单位:mg/L
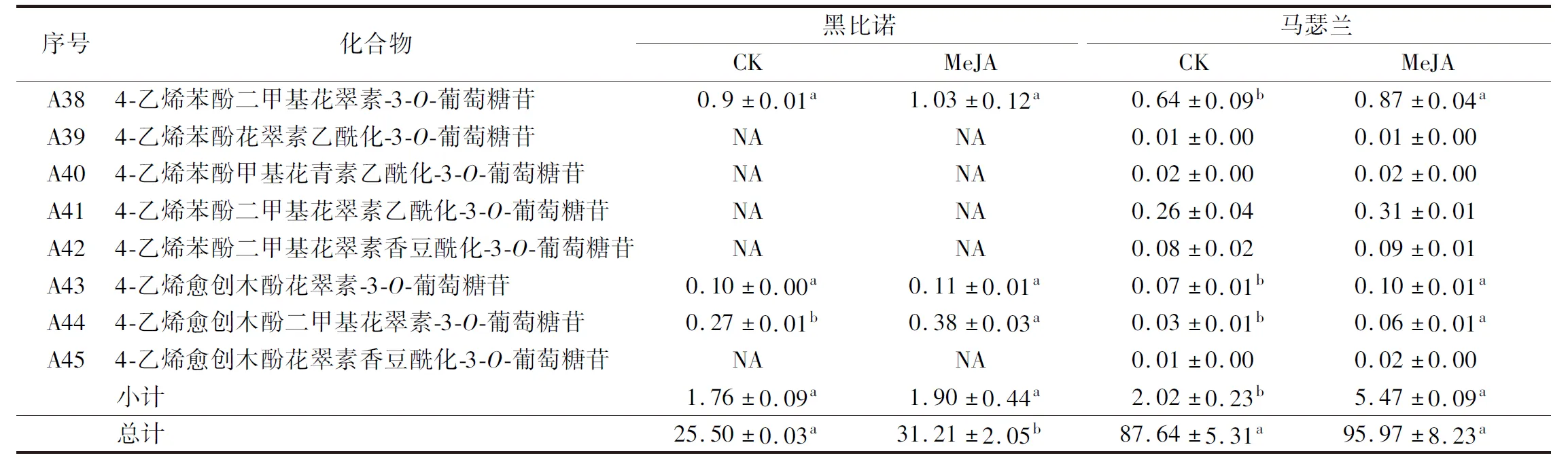
续表2
2.2.2 茉莉酸甲酯处理对葡萄酒中酰化花色苷酚的影响
乙酰、香豆酰、咖啡酰和阿魏酰等酰化基团可以和平面吡喃核的π-键堆叠或共轭进一步修饰花色苷的糖分子,保护花色苷的有色结构,形成较稳定的酰化花色苷[18-19]。MeJA处理后,马瑟兰酒样中乙酰化、咖啡酰化、香豆酰化花色苷的总含量分别提高了11.03%、40.00%和29.10%,其中咖啡酰化和香豆酰化花色苷的含量显著提高(P<0.05)。5种乙酰化花色苷的二甲基花翠素乙酰化-3-O-葡萄糖苷的含量最高,MeJA处理后其含量提高了12.00%。酒样中仅检测出了2种咖啡酰化型花色苷,经MeJA处理后酒样中二甲基花翠素咖啡酰化-3-O-葡萄糖苷的含量明显提高。总体上,处理组和对照组酒样中8种香豆酰化花色苷均无明显差异,但其总含量显著升高(P<0.05)。
2.2.3 茉莉酸甲酯处理对葡萄酒中其他花色苷酚的影响
在红葡萄酒发酵和陈酿过程中,单体花色苷及其相应的酰化花色苷通过各种反应进一步形成吡喃型花色苷,具有更强的稳定性[20-21]。此外,还有一类聚合花色苷,是花色苷通过缩合或加成一些黄烷醇类物质形成的产物[22]。MeJA处理后,2种酒样中其他类花色苷的总含量分别提高了7.95%和171%,并且2种酒样中其含量均存在显著差异(P<0.05),这一结果也能够解释前文中单体花色苷和乙酰化花色苷的含量变化小的原因。
2.2.4 基于主成分和热图分析茉莉酸甲酯处理对葡萄酒中花色苷酚的影响
为了更清楚地分析MeJA处理对葡萄酒花色苷酚的影响,选择含量大于0.01 mg/L的花色苷酚进行主成分分析(图1-a和1-c)。基于特征值大于1进行公因子提取,得到了黑比诺酒样中PC1(68.95%)和PC2(15.01%)累计方差达到83.96%,马瑟兰酒样中PC1(51.49%)和PC2(25.43%)累计方差达到76.92%,能够解释原始变异的多数信息。从图1-a可以看出,黑比诺酒样大部分花色苷酚位于PC1正半轴,包括A1、A3和A5等单体花色苷酚,而PC1负半轴仅有A4和A28这2种花色苷。从图1-c可知,马瑟兰酒样中PC1负半轴仅有A36和A27这2种花色苷,其余花色苷酚位于PC1正半轴,包括5种单体花色苷和酰化花色苷。此外,2种葡萄酒处理组和对照组明显区分开,表明MeJA处理后黑比诺和马瑟兰酒样中花色苷含量具有差异。
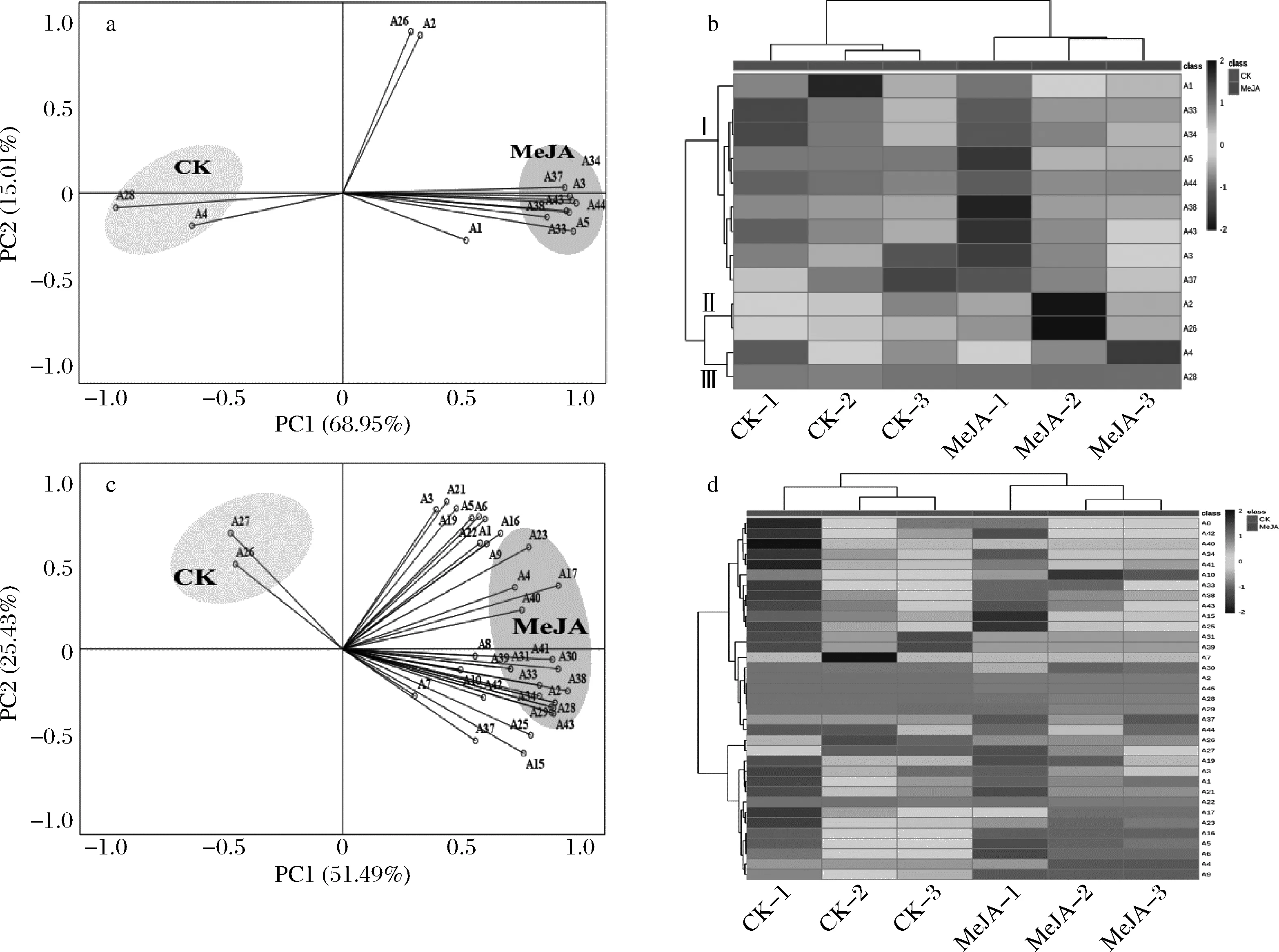
黑比诺酒样:a-主成分分析;b-热图分析;马瑟兰酒样:c-主成分分析;d-热图分析图1 两种葡萄酒中花色苷酚的主成分分析和热图分析Fig.1 Principal component analysis and heat map analysis of anthocyanins in two wines
通过热图进一步聚类分析MeJA处理后2种酒样中花色苷酚的差异。由图1-b可知,黑比诺酒样中花色苷酚分为Ⅰ类(A1-A37)、Ⅱ类(A2-A26)和Ⅲ类(A4-A28),其中处理组酒样Ⅰ类和Ⅱ类高于对照组,仅A4和A28低于对照组,表明MeJA处理能够提高黑比诺酒样中花色苷酚的含量。由图1-d可知,马瑟兰酒样中花色苷酚分为Ⅰ类(A8-A44)、Ⅱ类(A26-A27)和Ⅲ类(A19-A9),其中处理组酒样中Ⅰ类和Ⅱ类花色苷酚明显高于对照,而处理组仅A26和A27低于对照组,表明MeJA处理后马瑟兰酒样中花色苷酚的含量升高。
2.3 茉莉酸甲酯处理对葡萄酒中非花色苷酚的影响
MeJA处理对不同类型非花色苷酚的含量影响不同,且不同品种葡萄酒中非花色苷酚的种类存在差异。2个品种的酒样中共检测出35种非花色苷酚,包括13种酚酸类、14种黄酮醇类、7种黄烷醇类和1种芪类。‘黑比诺’葡萄酒中共检测出30种非花色苷酚,MeJA处理后总含量提高了9.52%。‘马瑟兰’葡萄酒中共检测出35种非花色苷酚,但总含量无明显差异。
2.3.1 茉莉酸甲酯处理对葡萄酒中酚酸类的影响
在葡萄酒中酚酸类物质有助于葡萄酒颜色的稳定和防止氧化,对葡萄酒的色泽起重要作用[23]。由表3可知,黑比诺和马瑟兰酒样中分别检测出了12种和13种酚酸类化合物。MeJA处理后,黑比诺和马瑟兰酒样中酚酸的总含量分别提高了41.86%和46.60%。
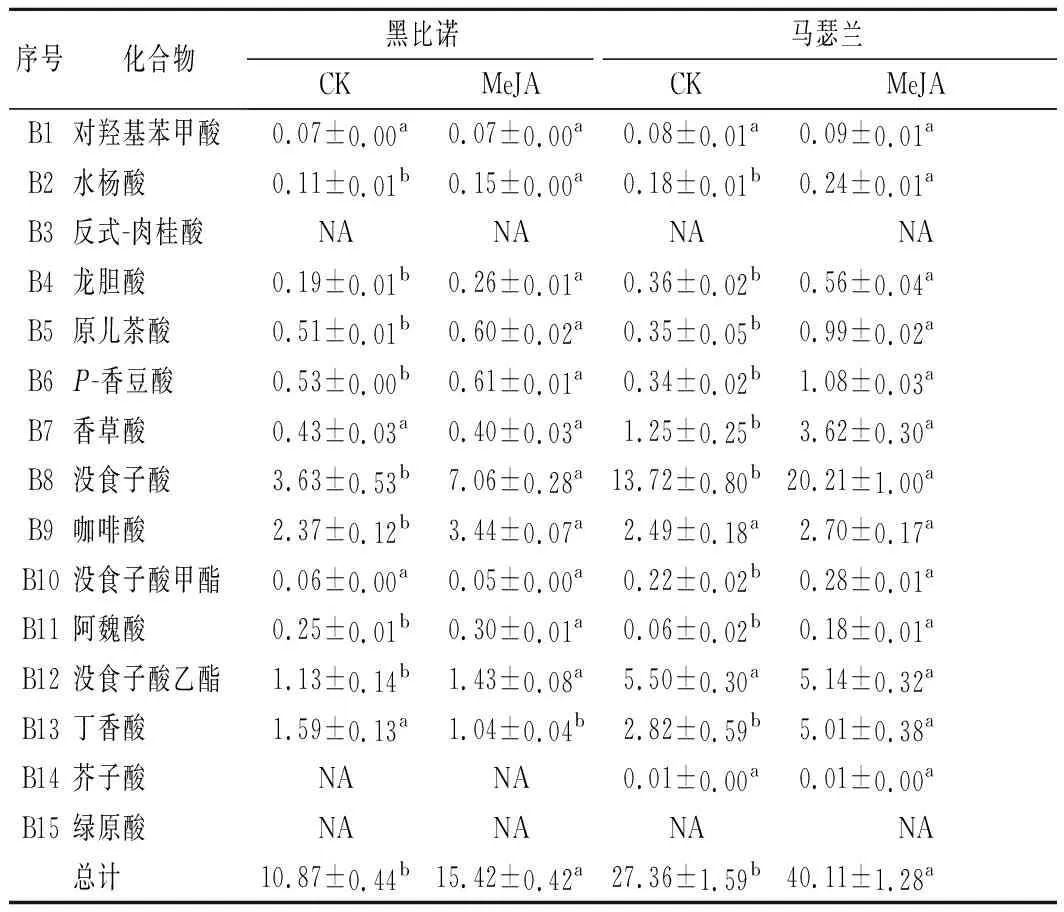
表3 葡萄酒中酚酸类化合物的含量 单位:mg/L
黑比诺酒样中没食子酸、咖啡酸、没食子酸乙酯和丁香酸的含量大于1 mg/L,MeJA处理后前3者的含量分别提高了94.49%、45.15%和26.55%,而丁香酸的含量降低了34.59%。马瑟兰酒样中香草酸、没食子酸、咖啡酸、丁香酸和没食子酸乙酯的含量大于1 mg/L,前4种化合物的含量分别提高了189.60%、47.30%、8.43%和77.66%,而没食子酸乙酯的含量降低了6.55%,但无明显差异。综上,MeJA处理后2种酒样中没食子酸和咖啡酸的含量均提高,且没食子酸的含量具有显著差异(P<0.05)。
2.3.2 茉莉酸甲酯处理对葡萄酒中黄酮醇类的影响
黄酮醇类作为一种重要的辅色物质,多以糖苷或结合态形式存在,而极少数以游离态形式存在,具有多方面生物活性[24]。由表4可知,黑比诺和马瑟兰酒样中分别检测出了11种和14种黄酮醇类。MeJA处理后,黑比诺酒样中黄酮醇类化合物的总含量降低了5.14%,而马瑟兰酒样中其总含量增加了64.41%,且具有显著差异(P<0.05)。黑比诺酒样中大于1 mg/L的黄酮醇类化合物有落新妇苷、金丝桃苷、二氢槲皮素和槲皮苷。经MeJA处理后,上述4种化合物的分别降低了2.71%、9.97%、10.59%和26.92%,但仅落新妇苷和槲皮苷的含量具有显著差异(P<0.05)。MeJA处理后,马瑟兰酒样中黄酮醇类的含量均有不同程度的提高。对照组酒样中金丝桃苷的含量高于1 mg/L,而处理组酒样中杨梅素、落新妇苷和金丝桃苷均高于1 mg/L,其中金丝桃苷的含量提升了92.09%。
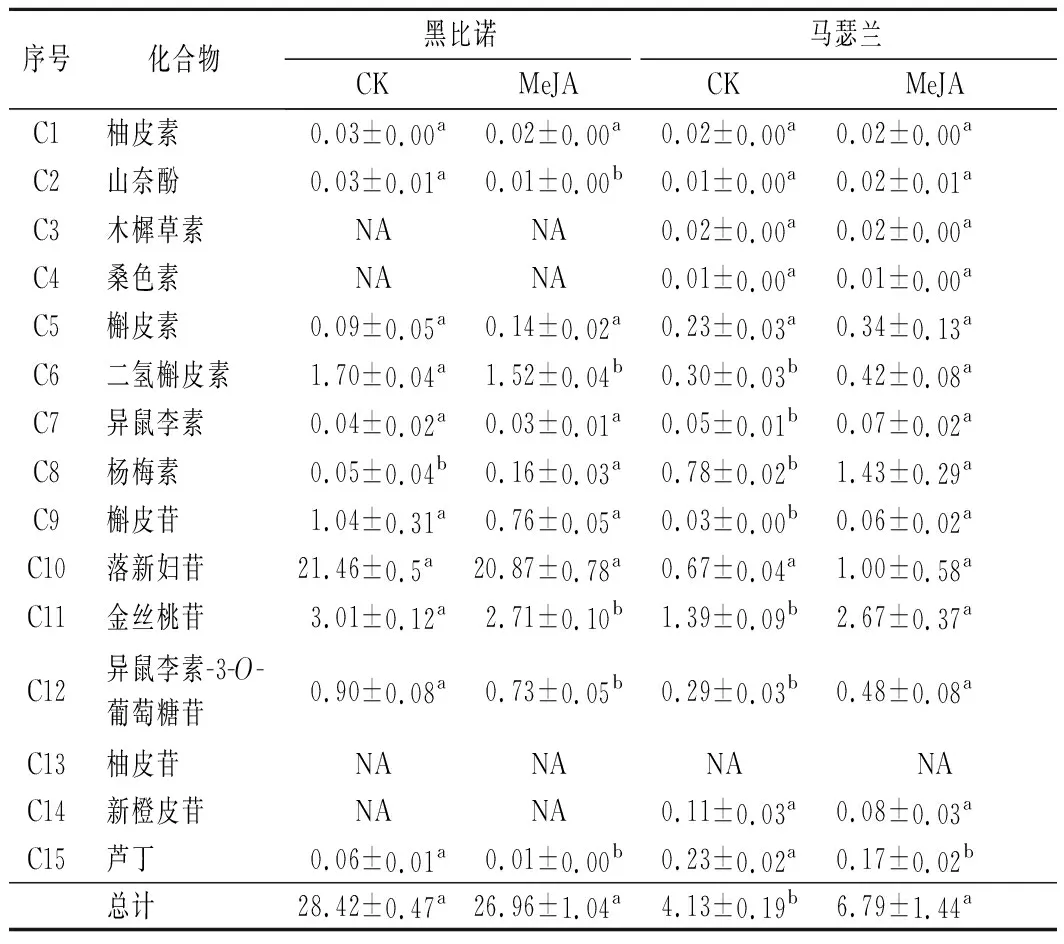
表4 葡萄酒中黄酮醇类化合物的含量 单位:mg/L
2.3.3 茉莉酸甲酯处理对葡萄酒中黄烷醇类化合物的影响
在葡萄酒中,黄烷-3-醇类的单体是提供苦味的重要物质,对葡萄酒口感有很大影响[25]。由表5可知,黑比诺和马瑟兰酒样中分别检测出了6种和7种黄烷醇类化合物。MeJA处理后,黑比诺酒样中其总含量提高了9.73%,而马瑟兰酒样中其总含量降低了8.24%,但2种酒样均无显著差异(P>0.05)。2种酒样中儿茶素的含量最高,其次为表儿茶素和原花青素B1。
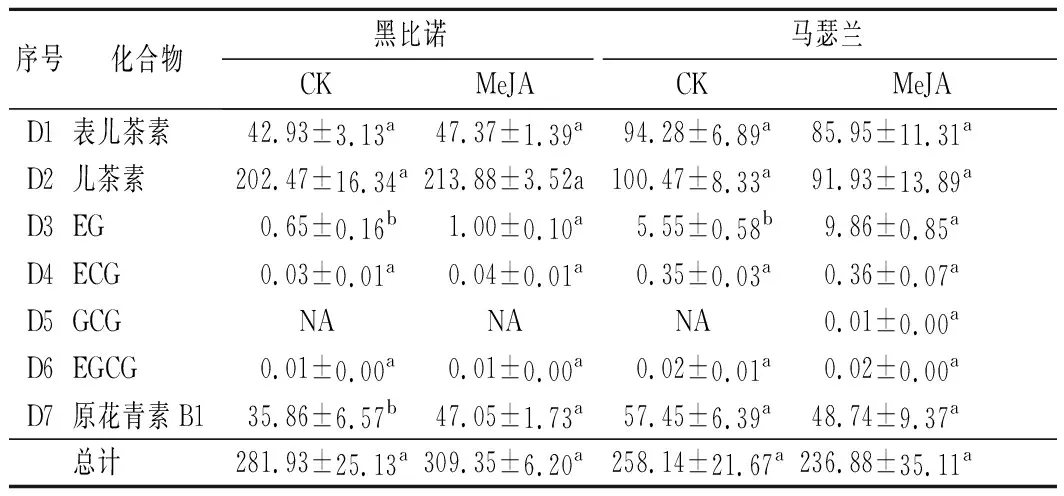
表5 葡萄酒中黄烷醇类化合物的含量 单位:mg/L
MeJA处理后,在黑比诺酒样中上述3种化合物的含量增高,分别提高了5.64%、10.34%和31.21%,而马瑟兰酒样中这3种化合物的含量降低,分别降低了8.84%、8.50%和15.16%。但马瑟兰酒样中EG的含量显著提高了77.66%(P<0.05)。
2.3.4 茉莉酸甲酯处理对葡萄酒中白藜芦醇的影响
不同品种的葡萄及其不同组织中白藜芦醇的含量存在差异,主要存在于葡萄果皮和叶子中,果肉中含量极少,新鲜葡萄果皮中大约含有60~90 mg/g[26]。由图2可知,MeJA处理后2种葡萄酒中白藜芦醇的含量分别提高了23.88%和241.66%,且均表现出了显著差异(P<0.05)。
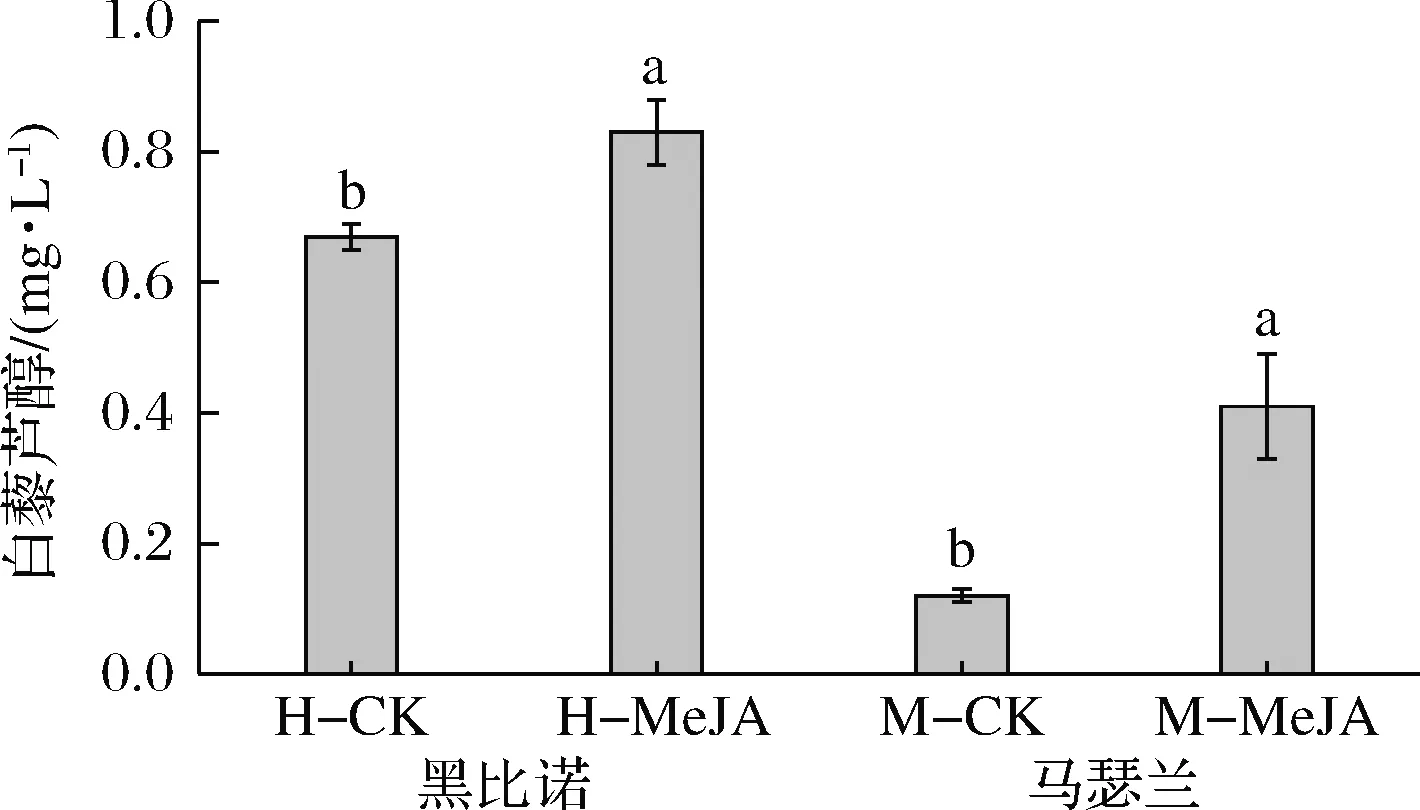
图2 葡萄酒中白藜芦醇的含量Fig.2 The content of resveratrol in wines
2.3.5 基于主成分和热图分析茉莉酸甲酯处理对葡萄酒中非花色苷酚的影响
选择含量高于0.01 mg/L的非花色苷酚类进行了主成分分析(图3-a和3-c)。基于特征值大于1进行公因子提取,得到了黑比诺酒样中PCI(69.16%)和PC2(19.12%)的累积方差贡献率达到88.28%,马瑟兰酒样中PCI(58.02%)和PC2(29.71%)的累积方差贡献率达到87.73%。黑比诺酒样的主成分分析发现(图3-a),PC1正半轴主要反映了B4、B9、D1、D2和E1等酚酸类、黄烷醇类和白藜芦醇,PC1负半轴主要反映了C6、C15、C12等黄酮醇类。从图3-a还可以看出,对照组和处理组明显被区分开,对照组在PC1负半轴表现出高的载荷系数,处理组在PC1正半轴表现出高的载荷系数,表明MeJA处理提高了黑比诺酒样中白藜芦醇、酚酸类和黄烷醇类的含量。马瑟兰酒样的主成分分析发现(图3-c),PC1正半轴主要反映了E1、B4、B8、C11和C8等白藜芦醇、酚酸类和黄酮醇类,PC1负半轴主要反映了D1、D2和D7等黄烷醇类。此外,对照组与处理组也被明显区分开,表明了MeJA处理提高了马瑟兰酒样中白藜芦醇、酚酸类和黄酮醇类的含量。
葡萄酒中的非花色酚类化合物多种多样,为进一步分析MeJA处理后其含量的变化,利用热图进行聚类分析。由图3-b可知,黑比诺酒样中非花色苷酚被分为Ⅰ类(B7-C15)和Ⅱ类(D2-D6),其中Ⅰ类主要是黄酮醇类,Ⅱ两类主要是酚酸类和黄烷醇类。结果显示,处理组酒样中黄酮醇类的含量低于对照,酚酸类和黄烷醇类的含量高于对照组。由图3-d可知,马瑟兰酒样中非花色苷酚被分为Ⅰ类(C8-D3)、Ⅱ类(B12-C15)和Ⅲ类(B1-D4),Ⅰ类主要是酚酸类,Ⅱ类主要是黄烷醇类,Ⅲ类主要是黄酮醇类。结果显示,处理组酒样中酚酸类和黄酮醇类的含量高于对照,黄烷醇类的含量低于对照组。
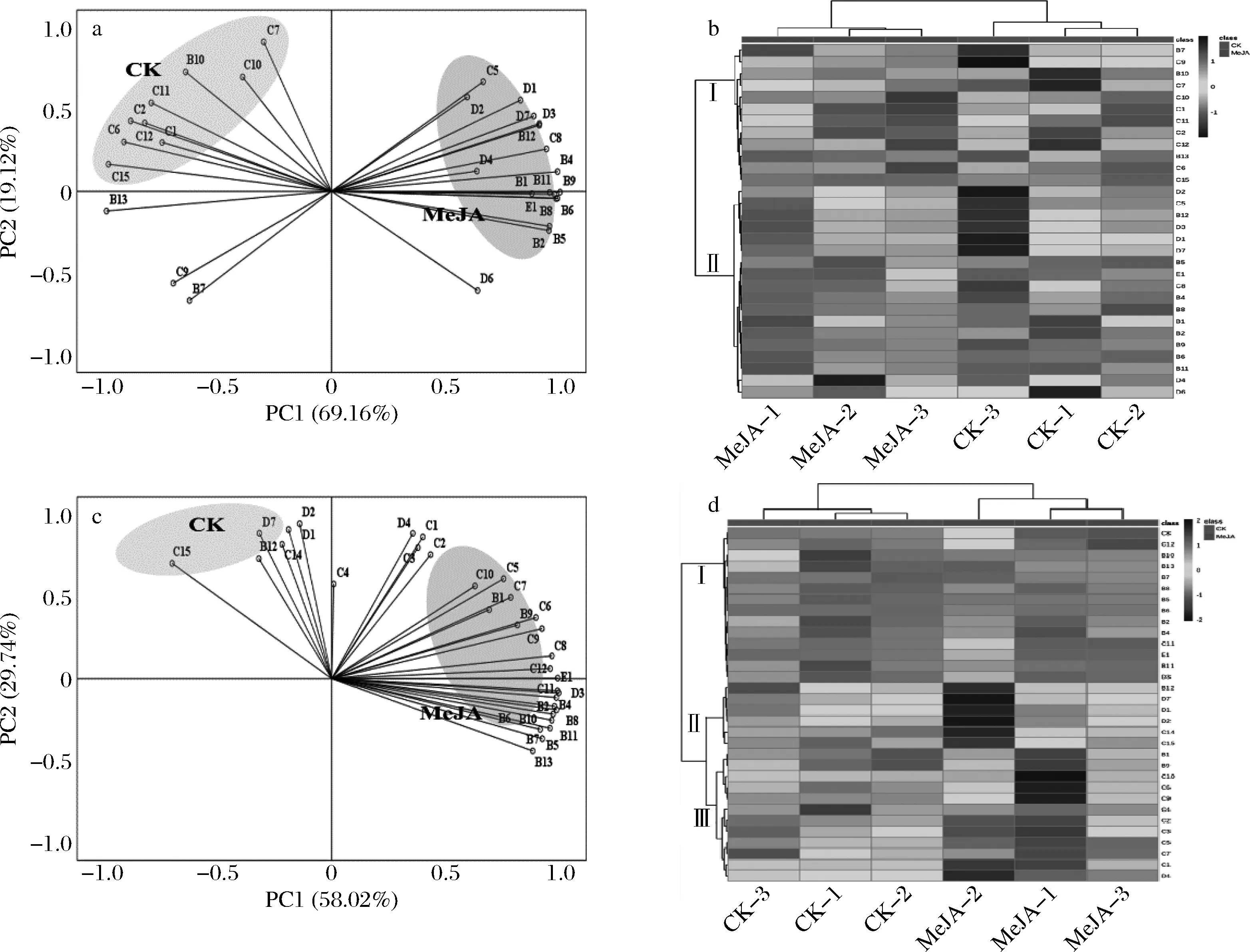
黑比诺酒样:a-主成分分析;b-热图分析;马瑟兰酒样:c-主成分分析;d-热图分析图3 两种葡萄酒中非花色苷酚化合物的主成分分析和热图分析Fig.3 Principal component analysis and heat map analysis of non-anthocyanin phenols in two wines
3 讨论与结论
本试验发现MeJA处理后2种葡萄酒中总酸、挥发酸和酒精含量均无显著变化,但总酚和总花色苷含量显著提高。与赵婉珍[27]研究发现MeJA处理后‘美乐’干红葡萄酒的酒精度和总酸含量无明显差异,总酚的含量显著增加的结果相似。也有文献报道,MeJA处理后‘丹魄’葡萄酒中发现酒精度、总酸和挥发酸含量无明显差异,花色苷的含量增加[28]。
酚类化合物能够通过辅色作用增强葡萄酒的颜色[27]。因此,通过MeJA处理提高葡萄酒中的酚类的含量,能够改善发酵结束时葡萄酒的色泽品质。本试验结果表明,MeJA处理后2种葡萄酒中5种单体花色苷无显著变化,但马瑟兰酒样中香豆酰化以及与其他化合物加成形成的花色苷含量显著增加,这个结果可能是由于进行了苹乳发酵,使花色苷发生了转化。有研究表明,在葡萄酒进行酒精发酵和苹乳发酵过程中5种单体花色苷的变化趋势不同,酒精发酵和苹乳发酵前期5种单体花色苷的含量逐渐增加,而在苹乳发酵后期它们的含量降低[29]。PORTU等[16]也发现MeJA处理后葡萄酒经过苹果酸-乳酸发酵后,5种单体花色苷之间无明显差异。本研究发现2种葡萄酒中酚酸类和白藜芦醇的含量均显著提高,但黑比诺酒样黄酮醇类的含量降低,黄烷醇类的含量升高;马瑟兰酒样黄酮醇类的含量升高,黄烷醇类的含量降低。造成这种现象的原因可能是葡萄品种和酿造工艺的差异,也可能是在发酵过程中葡萄酒非花色苷酚通过加成、转化和聚合作用形成了其他化合物。但也有学者研究发现MeJA处理增加了葡萄酒中黄烷醇的含量,并且黄酮醇类和芪类物质的含量显著增加[30]。因此,MeJA处理对葡萄和葡萄酒黄烷醇和黄酮醇类化合物的影响还有待进一步研究,还需要研究葡萄酒酿造过程中黄烷醇和黄酮醇类化合物的变化规律及其作用机制。

