非编码小RNA 200家族及U78在老年口腔鳞癌病人组织中的表达及功能分析
房旭 黄郁晶 阮强 刘维贤
口腔鳞状细胞癌(oral squamous cell carcinomas,OSCC)是头颈部发病率最高的恶性肿瘤,老年人群发病率较高,容易发生侵袭和转移,严重影响晚年生存质量。尽管OSCC的临床诊断及治疗不断进步,病人术后5年的存活率仍低于50%[1]。
核仁小RNA(small nucleolar RNA,snoRNA)是一类真核细胞核仁中60~300个核苷酸长度的非编码RNA,主要参与核糖体RNA(rRNA)转录后的成熟加工过程。近年来研究表明,snoRNA与肿瘤的发生、发展密切相关[2]。微小RNA(microRNA,miRNA)是一类长度约22个核苷酸的小分子非编码RNA, 转录后调节靶基因的表达水平[3]。通过调节靶基因的表达, 在细胞的分化、增殖、迁移等过程中具有重要作用[4]。开展snoRNA和miRNA与OSCC关系的研究有可能为OSCC的诊断和治疗提供新线索[5]。本研究通过筛选老年OSCC病人的snoRNA及miRNA,选定与OSCC各临床指征相关、可作为对其诊断或预后具有参考价值的肿瘤生物标志。
1 材料与方法
1.1 样本收集 选取2016年1~8月盛京医院口腔外科手术治疗OSCC病人9例,以及病理科保存石蜡包埋OSCC组织标本35例,合计44例。病人年龄均≥60岁,均经病理学诊断为OSCC。病人不合并其他疾病,无器质性疾病和既往恶性肿瘤史。新鲜及石蜡鳞癌样本TNM分期Ⅰ~Ⅳ期分别为21、9、4、10例。根据肿瘤病理分级低、中、高分别为3例、8例、33例。另外选取正常口腔组织作为对照,包括2016年1~8月13例手术治疗病人术中切取口腔正常黏膜或舌组织0.5 cm3,以及病理科保存石蜡包埋正常口腔组织标本10例,合计23例。
本研究经盛京医院伦理委员会批准,得到所有病人允许并签属知情同意书。
1.2 RNA提取 (1)新鲜组织总RNA的提取:用经焦碳酸二乙酸处理过的剪刀将新鲜组织标本剪碎,采用AxyPrep公司的组织细胞总RNA提取试剂盒提取新鲜组织标本总RNA。 (2)石蜡包埋切片组织标本总RNA的提取:采用Applied biosystem公司的石蜡包埋组织总核酸提取试剂盒提取石蜡包埋切片组织标本总RNA。提取操作步骤如下:二甲苯溶解石蜡包埋组织切片,50 ℃ 20 min,脱蜡;100%乙醇洗脱二甲苯2遍,室温挥发60 min;蛋白酶消化组织块30 min;洗液清除残余蛋白酶等,提取总核酸;采用DNA酶消化DNA成分,室温30 min;过滤柱洗脱3遍,加水溶解,离心,保留洗脱液电泳备用。
1.3 RNA芯片检测 采用芯片技术对RNA标本进行非编码miRNA芯片检测,所用芯片可以检查。使用生物素标记的miRNA进行芯片杂交:每张Affymetrix芯片加入提取的RNA样本10μL;将杂交液置于恒温金属浴上,99 ℃温育5 min,然后45 ℃温育5 min;从恒温金属浴上取出杂交混合液,微型离心机13 200 r/min离心5 min,除去杂交液中的不溶性物质;注入相应的杂交液;将芯片平衡放置于杂交炉中,48 ℃,60 r/min旋转杂交16 h。清洗、染色及扫描芯片,使用AGCC软件(Affymetrix GeneChip Command Console Software)将芯片的荧光扫描图像保存成.DAT文件进行分析。
1.4 TaqMan荧光定量PCR检测
1.4.1 探针的设计与合成:使用内参U6进行miRNA-200家族(miR-200a、miR-200b、miR-200c、miR-141及miR-429)及U78的反转录。荧光定量PCR TaqMan探针均由Applied biosystem公司设计并合成。
1.4.2 反转录反应:每个样本均做3个复孔。配制反应体系如下:含有脱氧胸苷三磷酸(dTTP)的脱氧核糖核苷三磷酸(dNTPs) 0.15μL,逆转录酶50 U,双蒸水8.16μL,RNase抑制剂0.19μL,RNA样本1μL。反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃ 保存。
1.4.3 TaqMan荧光定量PCR:TaqMan© 2×通用PCR Master Mix 10.00μL,双蒸水7.67μL,Custom TaqMan© Small RNA Assay (20×)1.00μL,反转录产物1.33μL。反应条件:95 ℃ 10 min,60 ℃ 60 s,40个循环。
1.4.4 结果分析:单个标本检测值由该标本复孔实验值均数得出。相对表达量由ΔCT值计算得出(ΔCT=CT被检测基因-CTU6);OSCC组织与正常口腔组织的表达量相对倍数由2-ΔΔCT法计算得出(ΔΔCT=ΔCT口腔鳞癌-△CT正常组织)。
1.5 生物信息学预测 通过miRNA靶基因预测软件TargetScan(http://www.targetscan.org)、PicTar (http://pictar.mdc-berlin.de)和 mirnaviewer (http://cbio.mskcc.org)预测miRNA-200家族的靶基因。
1.6 统计学分析 荧光定量PCR结果均由≥3次试验结果统计得出,具有可重复性。采用SPSS 13.0软件进行相关统计学分析。应用独立样本t检验分析样本组间差异;采用多元线性回归方法分析检测值与OSCC各临床指征的相关性;采用ROC曲线分析U78值对OSCC的识别和诊断能力。P<0.05为差异具有统计学意义。
2 结果
2.1 非编码miRNA芯片检测结果 非编码miRNA芯片共对人基因组544个snoRNA与624个miRNA的表达水平进行了检测,结果见图1。经杂交信号比较及统计学分析,与正常口腔组织相比,OSCC组织标本中共有65个snoRNA及63个miRNA表现为表达水平上调;仅有2个miRNA表现为表达水平下调。依据筛选条件(在组织中具有较高的表达水平;统计学分析具有显著差异性),分别选取snoRNA U78与miRNA-200家族(miR-200a、miR-200b、miR-200c、miR-141及miR-429)进行进一步鉴定及相关研究。
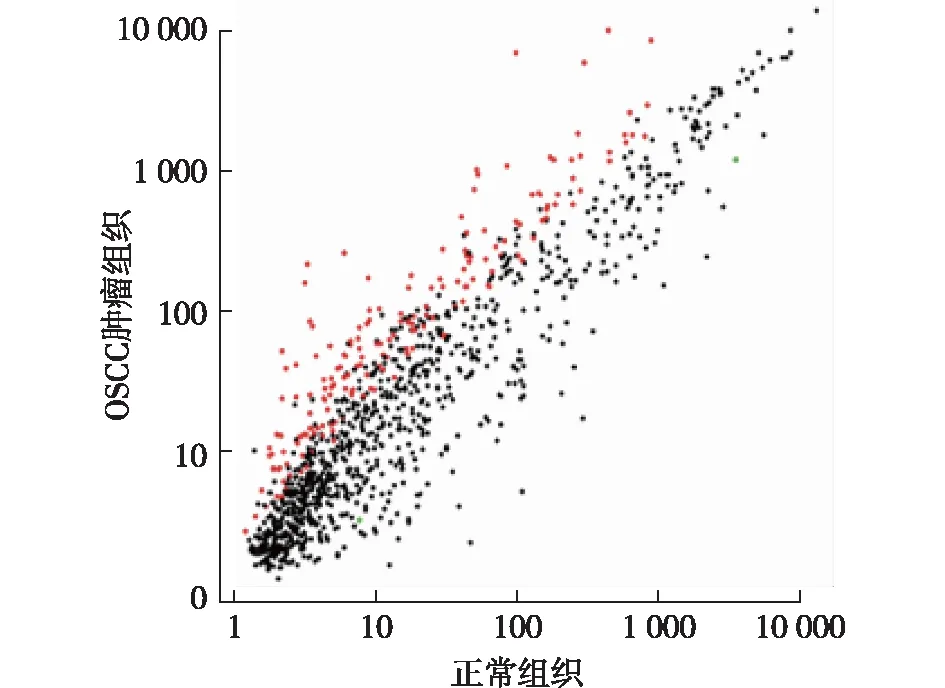
图1 芯片检测结果散点图
2.2 snoRNA U78在OSCC组织中的表达水平 采用TaqMan荧光定量PCR方法对snoRNA U78在OSCC及口腔正常组织中的表达水平进行检测。由于组织标本分别来源于新鲜组织和石蜡包埋组织,因此,首先对不同标本来源的U78检测值进行了统计学分析,以排除因标本保存方式不同造成的实验结果偏差。经分析,不同保存方式的相同组织间检测值差异无统计学意义(P>0.05),结果见图2。因此,不同保存方式的相同组织的检测值可以合并分析。通过2-ΔΔCT法计算得出U78表达量的(OSCC组织/正常口腔组织)相对倍数,即22.061=4.17倍,且差异具有统计学意义(见图3,P=0.019)。

图2 U78在新鲜组织和石蜡包埋组织中的表达
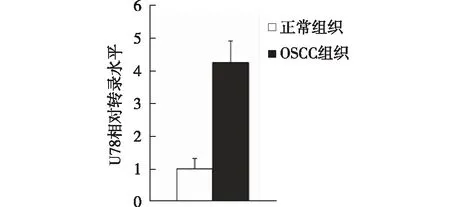
图3 U78在OSCC组织及正常组织中的表达
接下来将OSCC组织中U78的表达量与OSCC各项临床指征(包括临床分期、病理分级及有无转移)进行多元线性回归分析。多元线性回归分析结果表明,U78的表达量与肿瘤组织病理分级具有显著相关性(P=0.023);与临床分期及有无临床转移等临床指征无相关性(P=0.159;P=0.711)。ROC曲线分析结果显示:AUC为0.996,同时具有较高的敏感性和特异性(敏感度=100%; 特异度=90.2%),提示U78表达量具备对OSCC的识别和诊断能力。可作为OSCC生物学诊断的一个辅助检测指标,参与OSCC的临床诊断。
2.3 OSCC组织中miRNA-200家族的表达水平 芯片检测结果中, miRNA-200家族中有4个成员(miR-200a、miR-200b、miR-200c和miR-141)均有较高水平表达。采用TaqMan荧光定量PCR方法分别对miRNA-200家族共5个miRNA在OSCC组织及口腔正常组织中的表达水平进行检测。ΔCT计算结果表明,OSCC组织中miR-200a、miR-200b、miR-200c和miR-141的表达量与芯片结果一致,均高于正常口腔组织。芯片结果未提示miR-429表达异常,但是经过荧光定量PCR检测,发现miR-429在OSCC组织中也具有较高的表达水平。见图4。
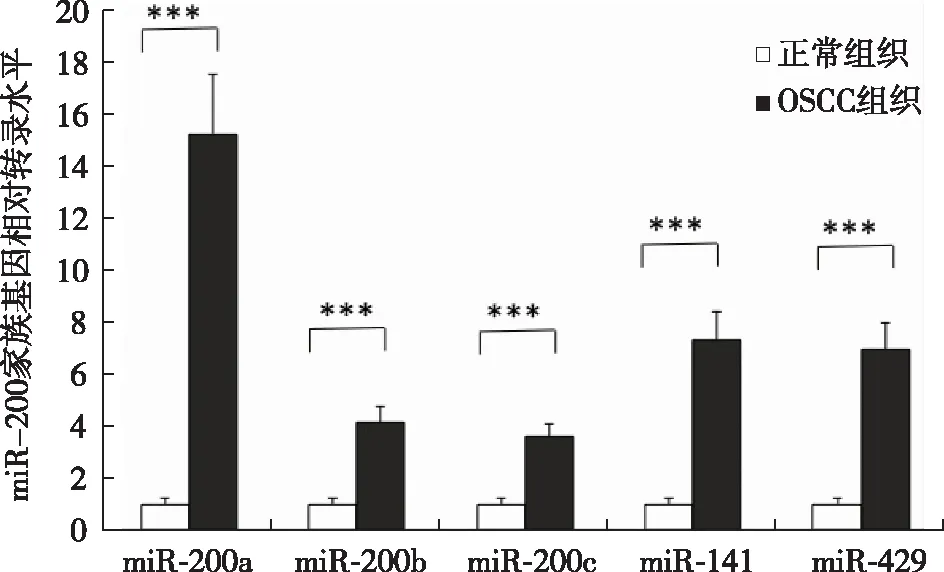
注:***P<0.001图4 miRNA-200家族在口腔鳞癌组织中的表达水平
2.4 miRNA-200家族靶基因预测分析 采用miRNA靶基因预测软件对micRNA-200家族(miR-200s)的靶基因进行预测,结果发现多个与细胞增殖及肿瘤迁徙转移相关的候选靶蛋白。见图5。
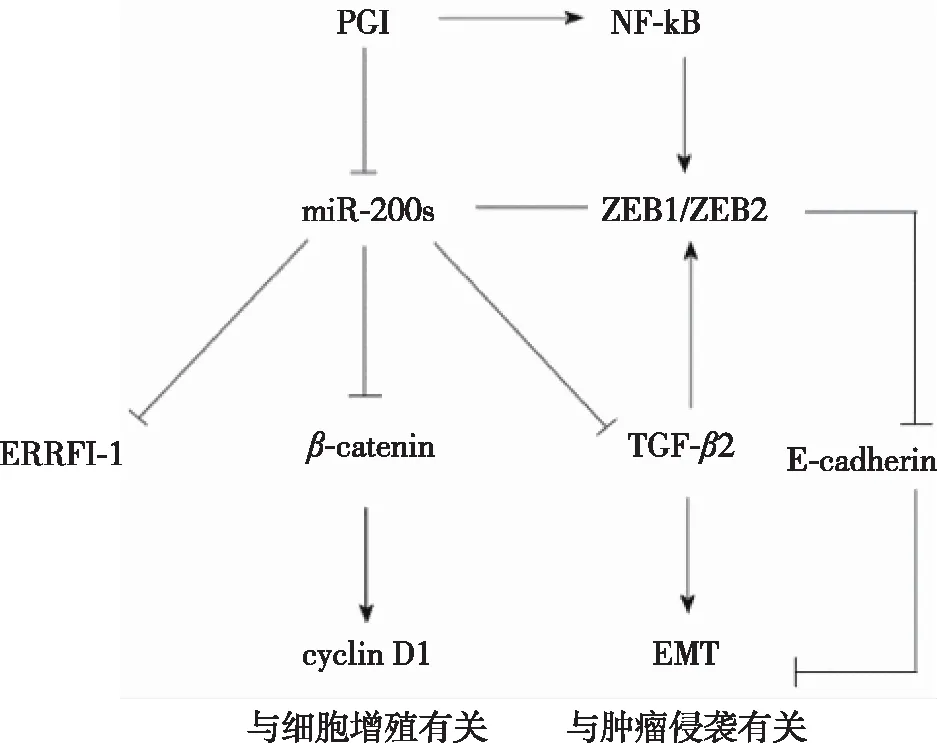
图5 miRNA-200家族生物学功能预测
3 讨论
老年人是OSCC的高发人群。口腔恶性肿瘤因发病机制尚不明确,给预防带来极大困难。烟龄较长的老年人好发,此外,随着老年人缺牙增多,佩戴可摘或全口义齿,造成口腔局部不良刺激也是致病因素之一。由于OSCC细胞有转变为浸润性癌的危险且常发生区域淋巴结转移及远处转移,手术采用将肿瘤所在部位的舌、颊、牙龈、腭等黏膜及组织结构彻底清除的治疗方法,对其深方的肌肉、神经等均会造成不同程度的损伤[6]。大多数的病人会因为年龄因素造成全身基础疾病较多且复杂,部分由于家人疏忽,也可导致OSCC确诊时,病人已处于中晚期。早前的研究发现snoRNA以多种方式参与肿瘤的发生[7]。一些snoRNA如:SNORD12、snoRNA U50等具有抑癌活性,而另一些snoRNA如:SNORD33、snoRNA U70C等的表达水平与病人预后明显负相关[8]。肿瘤组织中的一些snoRNA能够提高细胞的增殖能力和克隆形成[9];相反,癌细胞内U50水平明显增强,可以减少前列腺癌的形成[10]。Yoshida等[11]发现snoRNA21高表达于结肠癌组织中,而且其表达水平还与病人预后呈负相关。本研究发现,snoRNA U78在老年OSCC病人癌组织中呈高表达状态,可作为生物诊断指标辅助OSCC的临床诊断。
miRNA主要通过与靶mRNA结合,或促使mRNA降解,或阻碍其翻译,从而抑制目的基因的表达。本研究发现多个miRNA-200家族基因的靶基因与细胞增殖及肿瘤迁徙转移密切相关,例如β-链蛋白与转化生长因子β2(TGF-β2)。多种肿瘤的发生发展均与β-catenin密切相关,β-catenin在细胞浆聚集并进入细胞核, 与TCF/LEF家族成员形成复合物, 在其他共激活因子的协同下, 激活下游基因的转录,如细胞周期蛋白D1 (cyclin D1)基因等。TGF-β2可参与上皮间质转化(epithelial mesenchymal transition, EMT),重组其细胞骨架,使细胞显示出侵袭特性的横向分化过程。EMT在上皮来源肿瘤的转移与侵袭过程中均发挥着重要作用[12]。近年来大量研究证实,在多种肿瘤组织中存在miRNA-200家族表达失调,并表现出一定的组织特异性[13-14]。
此外, Li等[15]发现miR-200a和miR-200b在胰腺癌组织和大部分胰腺癌细胞系中高表达。Skok等[16]发现,与正常结肠黏膜相比,miR-200c在结肠癌组织中也异常高表达。本研究发现,在OSCC组织中,miR-200a、miR-200b、miR-200c、miR-141和miR-429的表达量均高于正常口腔组织,且经预测可靶向调控多个与细胞增殖、肿瘤迁徙转移相关的蛋白表达,因此推测miRNA-200家族可能参与OSCC的发生、发展与转移等多个环节。以上对老年病人OSCC组织的snoRNA与miRNA的表达情况进行的研究,为OSCC的临床诊断与治疗提供了新的信息与资料。

