ASFV解旋酶D1133L蛋白表达和抗体检测方法的建立及初步应用
侯 景,申超超,张大俊,杨 博,史喜绢,张 婷,杨泽晓,张克山*,郑海学*,李 丹,党 文,刘湘涛
(1.四川农业大学 动物医学院,四川 成都 611130;2.中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室/农业农村部 畜禽病毒学重点开放实验室/国家口蹄疫参考实验室,甘肃 兰州 730046)
非洲猪瘟(African swine fever, ASF)是由ASF病毒(ASFV)引起的猪的一种急性、热性、高度接触性传染病。ASFV属非洲猪瘟病毒科(Asfarviridae),是虫媒病毒中唯一的DNA病毒[1,2]。ASF的临床症状和病理变化与猪瘟很相似,表现为发热、皮肤发绀和淋巴结、肾、胃肠黏膜明显出血,强毒株感染的病死率可高达100%[3]。非洲猪瘟于1921年在肯尼亚被首次报道,随后发生在非洲的南部、中部和西部;自20世纪中期起该病在欧洲和拉美一些国家广泛流行,造成了严重的经济损失,因而被世界动物卫生组织(OIE)列为实时通报的动物疫病,我国将其列为一类动物疫病[4]。早在1995年西班牙科学家发现了ASFV P54蛋白反应性非常好,并将P54融合到大肠杆菌MS2聚合酶的N端,因其特异性强,利用Western Blot技术检出了ASFV[5]。近几年,研究发现在毕赤酵母中真核表达P72并建立的间接ELISA检测方法效果也不错[6]。此外,原核表达P30所建立的间接ELISA也获得了较好的免疫原性[7]。ASFV血清学检测方法主要有酶联免疫吸附试验、双抗体夹心ELISA法、直接免疫荧光试验、间接免疫荧光试验、免疫印迹试验、胶体金免疫层析法、荧光量子点免疫层析法等[8-12]。
ASFV编码150~200个蛋白,其中包含5个解旋酶。D1133L蛋白是ASFV解旋酶之一,位于病毒基因组中心,其开放阅读框(Open Reading Frame, ORF)全长3402 bp,可编码非常保守的氨基酸序列[13]。D1133L是DEAD-box家族解旋酶[14],具有水解ATP的功能[15,16],从而促进ASFV DNA双螺旋的形成[17];此外它还与mRNA结合抑制宿主细胞的转录水平[18],进而抑制翻译。D1133L蛋白可刺激天然免疫应答[19],广泛激活天然免疫系统的相关信号分子转导,并呈剂量依赖抑制,与我们之前报道的MGF-360-9L基因一样有抑制天然免疫应答的作用[20]。前期研究证明敲除D1133L后ASFV无法形成病毒粒子;Si-RNA敲低D1133L可抑制ASFV复制,因此该蛋白是ASFV复制的关键酶之一(数据未发表)。本研究通过原核表达了此蛋白,并通过ELISA方法检测发现该蛋白与ASFV阳性血具有良好的特异性且灵敏度可达到1∶1280,变异系数均控制在10%以下,说明该蛋白的稳定性很好;此外我们对200份未检测血清进行了检测,并与市售检测试剂盒的检测结果相比较,结果表明符合率达100%;ASFV感染第5天可检测出D1133L的抗体,第7天抗体水平达到顶峰。因此,此蛋白可以用于检测ASFV抗体水平。本研究结果可为ASFV血清学检测提供参考。
1 材料与方法
1.1 试剂和血清
Primer Star Mix、卡那霉素、胶回收试剂盒、T4连接酶、BL21表达工程菌株、HRP标记的羊抗鼠IgG(HRP-IgG)均购自Sigma公司;引物合成与测序由兰州天启基因公司完成;镍柱购自GE公司;口蹄疫、塞内卡、小反刍兽疫及猪大肠杆菌(E.coli)阳性血清、ASF阴性和阳性血清、ASF间接ELISA抗体检测试剂盒及ASFV感染的模型血清均由兰州兽医研究所口蹄疫与流行性病创新团队提供。
1.2 质粒构建
根据NCBI上公布的D1133L ASFV Georgia 2007/1(LR743116.1),通过Primer 5.0设计引物F:GTGTAGTATGAGAAGTAAGCATGTGATGGCGCACC CCAAAGCAAGAATAGCAATA,R:ATCATTTTGGCA AAGAATTCCTCGAGATGTTATCTATGATTGTATTGC TATTCTTGCTT。PCR扩增程序:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 1 min,共40个循环;72 ℃ 5 min。50 μL体系:25 μL Primer Star Mix、20 μL ddH2O、F/R 1.5 μL、样品2 μL。将扩增片段用胶回收试剂盒回收(参考说明书),经PET-28a酶切(酶切位点: BamHI、EcoRI)后把扩增片段与PET-28a通过T4连接酶连接(参考说明书),最后经琼脂糖凝胶电泳鉴定并测序比对。
1.3 原核表达
测序结果完全正确后将D1133L重组质粒转化BL21表达工程菌株,4 ℃冰浴30 min,42 ℃热激90 s,4 ℃冰浴5 min,在37 ℃下以220 r/min的转速离心1 mL无抗LB 1 h;转接200 mL卡那霉素抗性的LB,37 ℃ 220 r/min振荡12 h;加入0.1 mg的IPTG,过夜诱导16 h以上;以5000 r/min离心10 min,收集菌体;加入2 mL细胞裂解液[50 mmol/L Tris-HCl (pH 8.0)、2 mmol/L EDTA、100 mmol/L NaCl、0.5%(体积分数)tritonX-100、4 mol/L尿素],经超声破碎(W=20%,工作3 s,停止2 s,共计5 min)后以5000 r/min离心10 min;通过原核鉴定为包涵体表达并通过镍柱纯化蛋白(参考说明书);取1 μg纯化蛋白进行SDS-PAGE检测。
1.4 SDS-PAGE和WB
SDS-PAGE检测:取1 μg D1133L重组蛋白,将其混入loading buffer[5倍loading buffer: Tris-HCl 60 mmol/L (pH 6.8)、SDS 2%、溴酚兰0.1%、甘油25%、β-巯基乙醇14.4 mmol/L],于PCR仪上95 ℃变性5 min;以12000 r/min离心5 min;蛋白上样量为20 μL。将电压调至80 V,电流大约为40 mA,待样品压齐为1条直线时,时间约为30 min;分离时电压为120 V,待样品完全分离时,用时约120 min;将胶放入考马斯亮蓝中,在室温下放置1 h,然后用脱色液褪色,最后经全自动成像系统曝光检测。
WB检测:将SDS-PAGE胶浸于转移缓冲液中平衡10 min;依据胶的大小剪取膜,将转移槽置于冰浴中,放入三明治(黑色面对黑色面),加转移缓冲液,插上电极,在100 V下电泳1 h,然后用5%脱脂奶粉封闭1.5 h。以D11333L单克隆抗体(1∶2000)为一抗,在4 ℃下孵育12 h以上,用TBST洗涤3次;以羊抗鼠HRP-IgG为二抗,在室温下孵育1.5 h,用TBST洗涤3次;显色后在全自动成像系统中曝光获取目标条带。
1.5 间接ELISA方法的建立
采用方阵滴定法,将抗原和血清按不同浓度进行倍比稀释,确定最佳包被浓度、最佳血清稀释度和最佳二抗稀释度。抗原蛋白D1133L的稀释终浓度分别为1、0.5、0.25、0.125、0.0625、0.03125、0.015625、0.0078125 μg/mL,血清稀释度依次为1∶40、1∶80、1∶160、1∶320、1∶640、1∶1280、1∶2560、1∶5120;依据测定的最大P/N值,筛选出最优实验条件。同时对抗原包被时间、封闭液的选择及作用时间、最佳一抗作用时间、酶标二抗稀释倍数和作用时间、底物显色时间等进行优化。
1.5.2 特异性试验 采用建立的间接ELISA方法分别检测口蹄疫、塞内卡、小反刍兽疫及猪大肠杆菌(E.coli)阳性血清,每种血清各取2份进行ELISA检测,检测该方法的特异性。
1.5.3 灵敏度试验 将ASFV阳性血清按1∶80、1∶160、1∶320、1∶640、1∶1280、1∶2560、1∶5120、1∶10240进行倍比稀释,按最佳反应条件进行ELISA试验,以测得阳性结果的最大稀释度为敏感倍数。同时设立阴、阳性对照。
1.5.4 重复性试验 选取5份不同血清,利用同一批次和不同批次的D1133L蛋白包被酶标板。按照优化的ELISA条件进行检测,评估方法的稳定性和重复性。
1.5.5 符合率 取本实验室中待检猪血清200份,利用建立的ASFV D1133L间接ELISA方法和本实验室的ASFV间接ELISA检测方法分别进行检测,对比两种方法检测结果的符合率。
1.6 初步应用
将检测为ASFV阴性的生猪饲养在三级生物安全实验室(BSL3)中,待猪只适应环境后,设置1组阴性对照组,将100MOI的ASFV经肌肉注射给猪只;分别取ASFV感染后1、3、5、7、9、11、13、15、18 d的血清(100 μL),同时采集阴性血清和8只感染模型猪的血清,利用建立的间接ELISA方法检测攻毒后D1133L在猪体内的抗体水平。
2 结果与分析
2.1 重组质粒鉴定
按照1.1节中的方法将PET28a原核表达载体与D1133L片段进行BamHI、EcoRI双酶切,并通过T4连接酶连接酶切D1133L片段和PET28a,获得了PET28a-D1133L表达质粒(图1)。
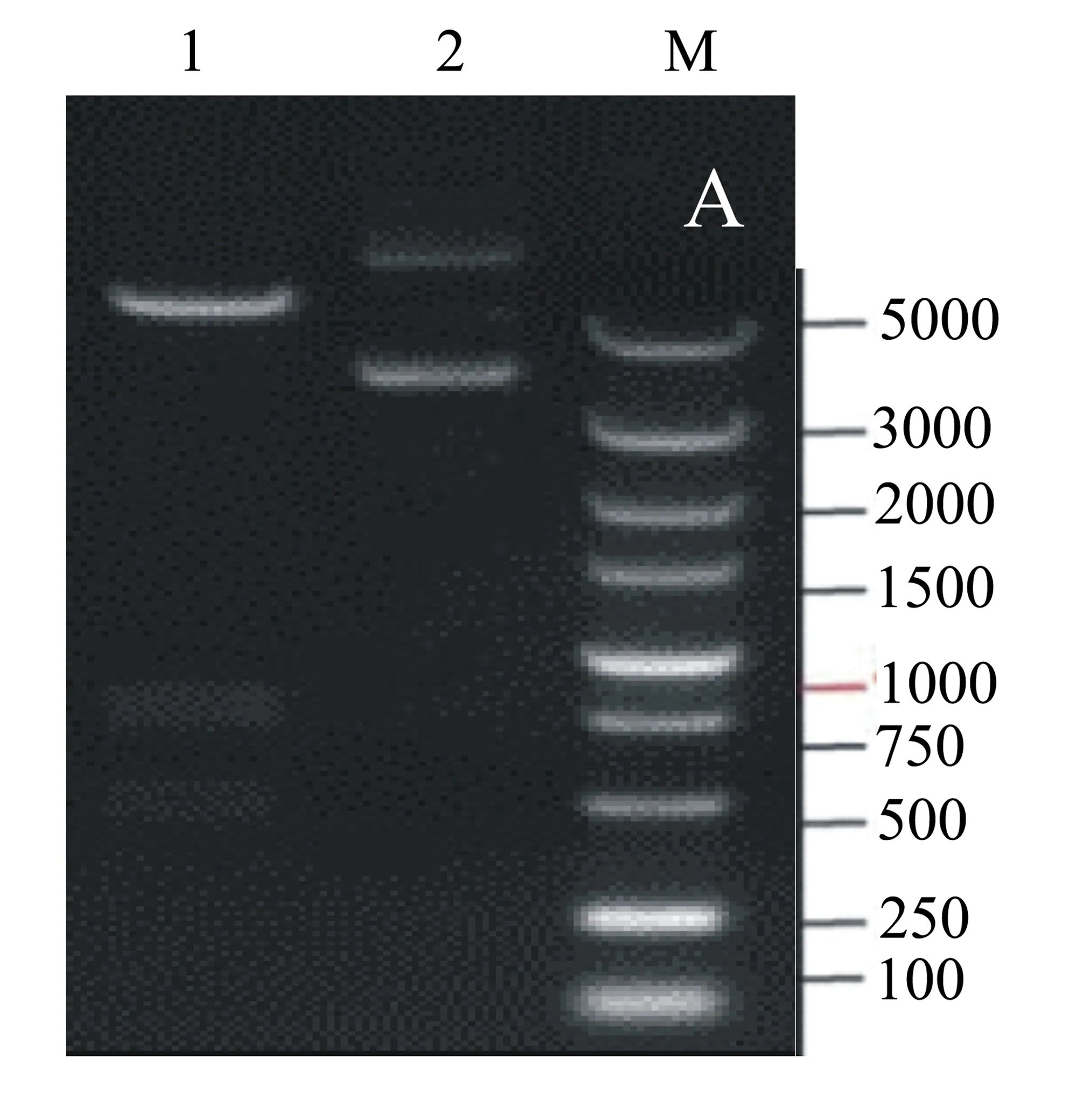
M: DNA Marker;泳道1:D1133L片段;泳道2: BamHI、EcoRI双酶切鉴定。图1 琼脂糖凝胶电泳检测结果
2.2 SDS-PAGE和WB
按照1.4节中的方法对pET28a-D1133L进行SDS-PAGE和WB检测,结果显示有45 kDa的蛋白条带,与预期结果相符,表明D1133L得到了表达(图2A)。Western blot检测结果显示诱导表达的重组蛋白可以与ASFV阳性血清发生特异性反应(图2B),表明重组蛋白具有良好的反应原性。
2.3 间接ELISA方法的建立
2.3.1 最佳反应条件的确定 通过方阵试验优化反应条件,筛选出最优试验条件(表1)。在 37 ℃条件下显色10 min。

表1 间接ELISA检测方法的反应条件优化结果

在A图(SDS-PAGE分析)中,M为蛋白Marker,泳道1为pET28a-D1133L重组蛋白。在B图(Western blot检测)中,M为蛋白Marker,泳道1为细胞裂解产物,泳道2为pET28a-D1133L重组蛋白表达产物与单抗的杂交产物。

图3 阴性样品检测结果的正态分布
2.3.3 特异性试验 利用建立的ELISA方法检测FDMV、SVV、PPRV、E.coli的阳性血清,并以ASFV的阳性血清、阴性血清作对照。结果显示,除ASFV的阳性血清为阳性外,其余均为阴性(表2),表明所建立的ASFV抗体间接ELISA方法的特异性较好。

表2 间接ELISA特异性试验结果
2.3.4 灵敏度试验 将ASFV阳性血清按1∶80、1∶160、1∶320、1∶640、1∶1280、1∶2560、1∶5120、1∶10240进行倍比稀释,以最适反应条件进行ELISA试验。结果显示,该方法可以检测到的血清最低稀释倍数为1∶1280,表明该ELISA方法的敏感性良好。
2.3.5 重复性试验 选取5份不同的血清,采用同一批次和不同批次的D1133L蛋白包被酶标板。按照优化的ELISA条件进行检测。结果显示,批内重复和批间重复性试验所得OD450nm值的变异系数分别为3.0%~3.2%和4.2%~4.7%,均小于10%(表3),表明所建立的ELISA方法具有良好的重复性。

表3 间接ELISA重复性试验结果
2.3.6 符合率 取本实验室中待检猪血清200份,分别利用本研究建立的间接ELISA检测方法和本实验室的ELISA方法进行检测,结果全部为阳性,符合率为100%(图4A)。
2.4 初步应用
在生物安全实验室(BSL3)中随机采集8个ASFV感染模型血清,在感染后1、3、5、7、9、11、13、15、18 d分别采集血清,将这些血清按照建立的间接ELISA方法进行稀释检测,结果显示,8个ASFV感染模型血清的抗体均在第5天可被检测到,抗体水平在第7天达到最高(图4B)。

图4 符合率和攻毒模型血清D1133L的抗体水平
3 讨论
ASFV病毒分离方法具有很高的特异性和敏感性,但是耗时较长,且有些ASFV毒株不具备吸附红细胞的能力,如果采用细胞吸附试验方法则只能观察到细胞病变,但不能观察到红细胞吸附现象,因此应结合PCR检测结果进行判断。PCR检测特异性强,灵敏度高,但需要专用设备和试剂[21]。研究发现利用P54建立的胶体金免疫技术有良好的特异性,与猪的其他病原如CSFV、PRV、PRRSV和PPV不发生反应[22]。利用胶体金免疫技术进行快速检测不需要实验室设备,操作简便,特异性高,携带方便,肉眼可直接观察结果,但其敏感性较低,应用范围较窄,在感染早期有可能出现假阳性,只适用于疑似病猪或不明原因死亡猪的初步检测,其检测结果仍然需要结合PCR检测结果作出最终判断[23-25]。检测ASFV抗体方法包括间接ELISA和阻断ELISA两种,所用的包被抗原为VP72[26]。为了提高敏感性,利用p30重组蛋白(p30r)建立ELISA检测方法,用于多个地区的ASFV血清学诊断,能够准确检测ASFV抗体[27]。
本研究通过优化表达并纯化了D1133L蛋白,将该蛋白包被聚苯乙烯微量反应96孔板,通过条件优化建立了一个间接ELISA方法,其检测结果与本实验室其他ASFV间接ELISA方法的检测结果的符合率达100%。现阶段对ASFV血清免疫学检测方法的研究主要集中在编码病毒结构蛋白的p72、p54、P30等基因[14,28,29]。本研究所建立的间接ELISA方法可为ASFV的鉴定提供新的思路。本研究还发现感染模型血清的D1133L的抗体在猪体内在第5天可被检出,抗体水平在第7天达到顶峰,证明ASFV的D1133L蛋白在猪体内也可以产生较好的免疫反应,因此可以利用此蛋白建立ASFV的ELISA方法。

