干扰雄性小鼠睾丸Clock基因对胎鼠发育的影响及机制研究
梁 鑫,宋林江,刘 驰,何 煊,江 舟,陈浩然,成姝婷*,王正荣*
(1.成都中医药大学医学与生命科学学院/附属生殖妇幼医院,成都 610041;2.四川大学华西基础医学与法医学院,成都 610041)
由于环境污染、精神压力等因素的综合作用,生殖疾病的发生率逐年上升。根据世界卫生组织不完全统计,超过10%的育龄人口患有不孕症[1]。生殖疾病增加了社会负担,对患者的生理、心理和家庭幸福产生了严重的负面影响。因此,生殖疾病发病机制的研究是医学界防治的重点。
生物节律是人体适应环境和调节身体功能的最重要机制之一[2]。生物节律与许多疾病的发生直接相关,特别是一些节律基因,如近日节律基因,直接参与多种生理和病理过程[3]。因此,一旦人体的节律基因发生改变,可能引起生理功能障碍和各种疾病。
近日节律基因已经在生理学和行为学领域得到了广泛的研究。最近的研究表明,近日节律基因、生殖行为和内分泌生理学之间存在某种特定的关系[4-5]。在众多的近日节律基因中,Clock发挥着重要的作用,Clock是近日节律的核心基因,Clock突变的小鼠,机体的近日节律遭到严重破坏,导致生育力下降[6-7]。近年来研究发现,在精子生成过程中,CLOCK蛋白限制性地表达于圆形精子的顶体,值得关注[8]。众所周知,精子顶体在受精过程中发挥重要的作用,CLOCK蛋白在对受精起重要作用的顶体部位限制性地表达,提示Clock与生殖功能有密切关系,值得进一步探索。前期研究发现,利用RNA干扰(RNAi)技术,干扰小鼠睾丸中Clock基因的蛋白质表达后,导致顶体酶活性、体外受精率和囊胚形成率下降[9]。本研究拟进一步研究Clock基因对胚胎着床及胎鼠发育的影响,检测甲基转移酶表达水平及各阶段胎鼠甲基化水平的差异,揭示影响胎鼠发育异常的可能机制或原因。
1 材料和方法
1.1 试验材料
1.1.1 实验动物分组与处理
ICR 小鼠,雄性 8~10周龄,雌性 4~6周龄,购自四川省成都达硕实验动物有限公司。使用标准小鼠笼具分笼饲养于光暗循环箱内(光/暗=12 h∶12 h),自由进食和饮水,保持室温为24℃±1℃。以随机分组原则将小鼠分为2组,一组为干扰组,注射Clock干扰质粒于睾丸内,另一组为阴性对照组,注射武汉晶赛公司提供的通用阴性HK质粒于睾丸内。注射方法:雄性小鼠乙醚麻醉后,将小鼠腹腔内的两侧睾丸推入已经松弛的阴囊,固定后,用微量注射器分别将干扰质粒和阴性质粒溶液20 μL注射入干扰组和对照组小鼠的双侧睾丸里。实验动物及方案已通过四川大学华西基础医学与法学院研究伦理委员会审查。
1.1.2 试验材料与仪器
材料:切片刀,温台,蜡杯,酒精灯,包埋盒,染色缸,树胶,树胶瓶,温度计,熔蜡炉,无菌塑料组织培养皿等。
仪器:高效液相色谱仪,PCR仪,凝胶成像系统,纯水仪,离心机,体视显微镜,倒置显微镜,切片机,恒温箱,水浴锅,电子天平,微量注射器,眼科剪、眼科镊等手术器械。
1.1.3 试剂
Clock干扰质粒和阴性质粒;动物体内转染试剂In vivo-jetPEITM为Poly Plus公司产品;孕马血清促性腺激素(PMSG)和绒毛膜促性腺激素(HCG)购于宁波市第二激素厂;质粒提取试剂盒购于OMEGA公司;Trizol(美国,Invitrogen);First Strand cDNA Synthesis Kit(美国,Fermentas);动物体内转染试剂In vivo-jetPEITM为Poly Plus公司产品;Taq酶(美国,Fermentas);芝加哥天蓝 6B(Sigma C8679)。引物序列如下:

1.2 试验方法和步骤
1.2.1 早期胚胎着床点的观察
雄鼠睾丸内注射干扰质粒、阴性对照质粒。注射质粒16 d后,雌鼠注射PMSG 10 IU/只促超排卵,18 d后注射雌鼠hCG 10 IU/只,将雄鼠与雌鼠1∶2合笼。合笼后第二日清晨取出雌鼠,观察其阴道栓以确定交配,筛选出具有阴道栓的孕鼠。取交配后5.5 d(5.5 dpc)的妊娠小鼠,尾静脉注射0.1 mL 1%的芝加哥天蓝染液。注射后3 min,处死小鼠,分离子宫,分别记录干扰组和对照组着床点数目。
1.2.2 检测妊娠小鼠各阶段胎鼠生长情况
分别获取 10.5、11.5、12.5、13.5、14.5、15.5、16.5、17.5、18.5 dpc期胎鼠做检测,包括大体形态、体重和有无死胎等。
1.2.3 胎鼠组织细胞生长发育和观察
将胎鼠用固定液固定,石蜡切片,HE染色,镜下观察胎鼠组织结构。做整体矢状面切片,以及对其大脑、心、肝、脾、肺、肾等各自位置的水平面切片。
1.2.4 测定胎鼠总甲基化水平和甲基转移酶表达量
分别获取 9.5、10.5、11.5、12.5、13.5、14.5、15.5、16.5、17.5、18.5 dpc期胎鼠,将获取的不同阶段胎鼠于冻存管中,-80℃保存。从胎鼠组织中提取并水解DNA,用高效液相色谱仪测定胎鼠总甲基化水平;从胎鼠组织中提取RNA,逆转录合成cDNA并进行PCR扩增,用1%琼脂糖凝胶电泳检测扩增结果。用高效液相色谱仪测定胎鼠甲基转移酶转录表达量。
1.3 统计学处理
使用SPSS 24.0和GraphPad Prim 8软件进行统计学分析,数据采用均值±标准差(x±s)表示。两组数据之间比较采用t检验,多组间比较采用One way ANOVA的分析方法进行数据统计学分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 干扰小鼠睾丸Clock基因表达对胚胎着床的影响
干扰组小鼠和对照组小鼠分别注射干扰质粒和阴性质粒,然后与雌性小鼠交配。交配后5.5 d处死妊娠小鼠(5.5 dpc),尾静脉注射芝加哥天蓝染色液。注射3 min后,处死小鼠,分离子宫,观察子宫内胚胎着床部位的数量(图1)。

图1 胚胎着床点Figure 1 Study of embryo implantation
结果表明,干扰组平均胚胎植入量为14.50±2.93,对照组平均胚胎植入量为20.33±3.32。两组比较有统计学意义(P<0.05)。表明对雄性小鼠睾丸内Clock基因的干扰显著改变了小鼠胚胎的植入(图2)。
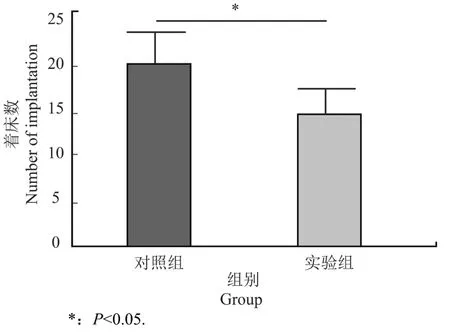
图2 干扰小鼠睾丸Clock基因表达对胚胎着床的影响Figure 2 The influence of interfering gene Clock on embryo implantation of mice
2.2 干扰小鼠睾丸Clock基因表达对胎鼠生长发育的影响
干扰组雄性小鼠和对照组雄性小鼠分别注射干扰质粒和阴性质粒,然后与雌性小鼠交配。本组分别取 12.5、14.5、16.5 dpc期胎鼠,观察其形态、体重、有无死胎等,用固定液、石蜡切片、HE染色固定胎鼠,并在显微镜下观察胚胎的胎鼠组织结构。结果发现,随着天数的增加,干扰组死胎/畸形儿发生率明显高于对照组,而不同发育阶段的体重均低于对照组,差异有统计学意义(P<0.001)(图 3,表 1,2)。
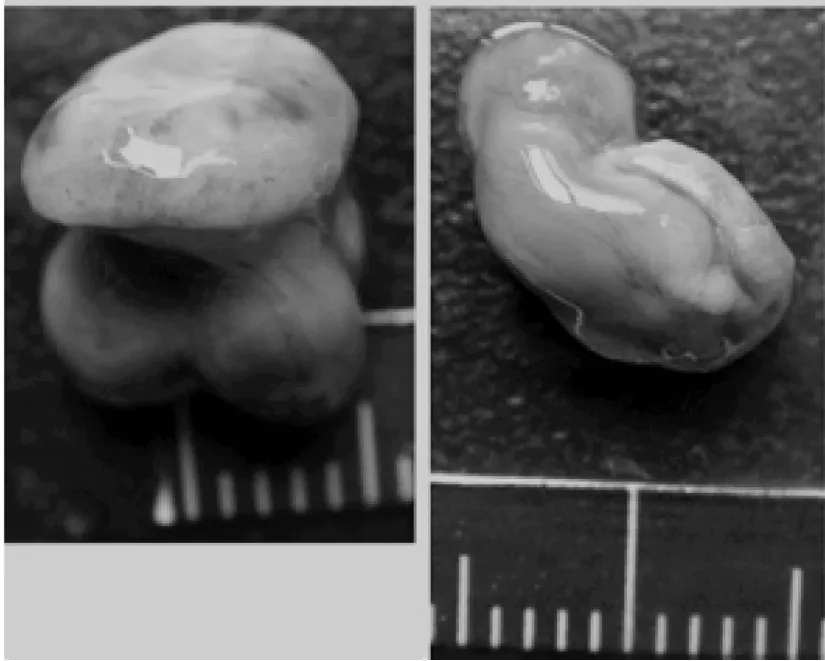
图3 发育畸形的胎鼠Figure 3 The malformation of mice fetus

表1 干扰小鼠睾丸Clock基因表达后死胎与异常胎的比较Table 1 The comparation of dead fetus and abnormal fetus after interfering of gene Clock

表2 干扰小鼠睾丸Clock基因表达后对胎鼠体重的影响Table 2 The effect of interfered Clock on weights of mice fetus g
2.3 干扰小鼠睾丸Clock基因表达对胎鼠组织结构的影响
在干扰小鼠睾丸内时钟基因的表达后,观察到小鼠心脏发育不良(包含组织疏松、薄壁等异常),脊柱发育分段性差。随着发育时间的延长,发育缺陷更加明显(图4)。

图4 胎鼠组织结构图Figure 4 The organizational chart of mice fetu
2.4 干扰小鼠睾丸Clock基因对胎鼠总甲基化水平及甲基转移酶的影响
干扰组雄性小鼠和对照组雄性小鼠分别注射干扰质粒和阴性质粒,然后与雌性小鼠交配。收集不同发育阶段的胎鼠,用高效液相色谱法测定胎鼠总甲基化水平,用RT-PCR法检测甲基转移酶的表达。发现在胎鼠发育的11.5~16.5 dpc阶段,干扰组内的甲基化水平显著低于对照组(图5)。两组间DNMT3B-4有显著性差异,干扰组低于对照组,其他甲基转移酶无显著性差异。这表明,在干扰小鼠睾丸内Clock基因表达后,可能是由于DNMT3B-4的水平降低,导致胎鼠的总甲基化水平降低,从而影响妊娠期间胎鼠的发育(图6)。

图5 干扰小鼠睾丸Clock基因表达后对胎鼠总甲基化水平的影响Figure 5 The effects of interfered Clock on total methylation levels of mice fetus

图6 交配后11.5~16.5 d胎鼠甲基转移酶水平Figure 6 The levels of all kinds of methyltransferase on 11.5 dpc to 16.5 dpc
3 讨论
胚胎着床过程非常复杂,涉及母体子宫内膜与孕体之间大量基因的协同作用,以达到相互识别和黏附,最后胚胎植入子宫内膜[10]。胚胎着床是哺乳动物生殖过程中的关键环节,直接关系到妊娠的成败。近年来关于近日节律基因与着床的关系鲜有报道。C.K.Ratajczak等人曾报道,与野生型小鼠相比,bmal1-/-小鼠的植入失败率较高[11]。本研究发现,在睾丸Clock基因表达受到干扰后,小鼠着床数下降。
有关近日节律在胚胎发育方面的作用仍不清楚。研究发现,排卵后延迟受精4~6 h对小鼠胚胎的存活有明显的影响[12]。近日节律基因在小鼠母体内发育的二细胞期胚胎中有表达[13],而在桑椹胚期表达量降低[14]。胚胎在通过输卵管时可能受到母体节律信号的影响。在大鼠的输卵管发现24 h内有近日节律基因或其控制的基因表达[15]。目前有报道子宫也存在近日节律基因表达[16]。将小鼠置于22和26 h非节律性的光暗周期环境下,小鼠胚胎的重吸收率较高,胎仔的存活率很低[17]。
近日节律基因的敲除将导致其生殖功能紊乱。早期的研究表明,Clock△19突变的小鼠具有生殖缺陷,表现为动情周期延长、产仔率下降[18]。2004年,B.H.Miller等研究发现Clock△19突变的小鼠排卵容易紊乱,且流产、胎鼠的再吸收情况比例增高,仔鼠的存活率降低[19]。2006 年,H.Dolatshad 等[20]进一步证实了Clock△19突变的小鼠有较高的难产率。纯合子Clock△19突变Balb/c小鼠与野生型比较,胎仔数显著降低,其存活率由94%下降到84%[21]。D.J.Kennaway等研究发现Clock△19+MEL的小鼠与野生型比较,怀孕时间延迟,存活率低(80%∶96%),胎仔数略有降低[15]。因此,目前研究显示,Clock△19的突变与生殖功能存在某种联系,引起生殖能力下降,但并没有引起完全不育发生。研究表明,精子质量参数与流产等存在必然联系[22-25]。在我们之前的研究中发现,使用RNA干扰(RNAi)技术降低小鼠睾丸内Clock基因的表达时,顶体酶活性、体外受精率和囊胚形成率降低[26]。本研究进一步发现,干扰睾丸Clock基因后,小鼠死胎和异常胎增多,胎鼠的体重较对照组显著下降,与已有报道一致。另外研究发现,Clock△19突变的小鼠Clock在肝、心脏、肾脏和肌肉的表达明显下调,并呈非节律性表达[26-27]。暗示Clock基因表达异常,可能会影响小鼠某些组织结构的异常,而导致胎鼠死亡或畸形。本研究显示,干扰Clock基因表达后,胎鼠显示心脏发育不良,脊柱发育分节不良。这说明干扰Clock基因表达后,胎鼠的发育受到影响。
胚胎发育是一个复杂的过程,是基因在一定时空顺序上的选择性表达[28]。基因在特定阶段的稳定表达对发育中的胚胎细胞的生长和分化起着关键作用[29]。基因表达的变异决定了胚胎和生命的发育过程。DNA甲基化是一种早期确定的基因表观遗传修饰方式,在细胞分化过程中调控基因状态[30-31],并在早期胚胎发育中发挥重要作用,是最常见的修饰[32-33]。DNA甲基化可以改变染色质的结构,抑制基因的表达[34]。基因将保持“沉默”。如果转录活性需要恢复,DNA去甲基化就会发生[35]。在胚胎发育过程中,过早的甲基化或不完全的去甲基化可导致胚胎死亡或产后遗传性疾病。早期胚胎的终止可能是由于DNA的甲基化不完全所致[36]。鉴于DNA甲基化对早期胚胎凋亡的重要性,本研究测定了妊娠不同阶段胎鼠的总甲基化水平。结果发现,干扰组11.5~16.5 dpc胎鼠甲基化水平显著低于对照组。因此,我们推测,小鼠睾丸Clock基因表达受到干扰后,在11.5~16.5 dpc阶段出现DNA甲基化水平下降,导致胎鼠发育异常。
DNA甲基化是在DNA甲基转移酶(DNMTs)的作用下,CpG二核苷酸5′端的胞嘧啶转化为5′甲基胞嘧啶[37]。研究表明,胚胎的正常发育得益于基因组DNA的适当甲基化。例如,缺乏任何类型的甲基转移酶对小鼠胚胎的发育都是致命的[38-39]。因此,在DNA甲基化的过程中,DNA甲基转移酶的作用至关重要。目前发现存在多种DNA甲基转移酶,主要有以下几种:①DNMT 1:维持性甲基转移酶,确保每个细胞的DNA甲基化模式的正常复制[40]。主要是催化新生链上DNA甲基化的发生,维持原来的甲基化,是组织中含量最为丰富的甲基转移酶。DNMT l在哺乳动物中的作用研究,已经在鼠科类动物中得到广泛的开展。有研究发现,失去DNMT l基因的胚胎干细胞和鼠类个体,都表现出一些明显的变化,其中最为明显的是,基因组发生严重的甲基化缺乏,导致胚胎致死[41]。② DNMT 3:主要是DNMT 3a和DNMT 3b,另外还有DNMT 3L。DNMT 3a和DNMT 3b也称从头甲基酶,主要介导从头甲基化。主要功能是在配子形成期和胚胎早期建立甲基化模式[42]。研究表明,破坏DNMT 3a对小鼠是致死的,DNMT 3a和DNMT 3b双突变时不能甲基化新整合的反转录病毒DNA序列[43],DNMT 3b可能与胚胎附植后经典的卫星DNA序列和失活X染色体上CpG岛的甲基化有关。DNMT 3L是一种与甲基转移酶相关的蛋白,它不具有甲基转移酶的活性,主要是与DNMT 3a和DNMT 3b结合调节两者的催化活性。③DNMT 2是体外甲基转移酶,低水平存在于小鼠的所有组织,由于该基因缺失不影响胚胎干细胞整体甲基化水平,因此推断DNMT 2可能不涉及DNA的甲基化。
在本研究中我们发现,胎鼠发育的11.5~16.5 dpc阶段,干扰组DNMT3B-4水平较对照组明显下降。因此,我们推断,干扰小鼠睾丸Clock基因表达引起胎鼠发育异常的原因,可能是DNMT3B-4水平下降,导致胎鼠总甲基化水平下降,从而影响了胎鼠的发育。但其深层次原因,有待于进一步深入研究。

