Selvester QRS 评分与急性心肌梗死患者室性心律失常及近期主要不良心血管事件的相关性
元洋洋 李波
急性心肌梗死(acute myocardial infarction,AMI)是由冠状动脉急性、持续性缺血缺氧所引起的心肌坏死。 根据心电图ST 段改变,可将AMI 分为ST 段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)和非ST 段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI)。Selvester QRS 评分(Selvester QRS score,SQs)系统是一种基于标准12 导联心电图定量标准的评分系统,可用于评估左心室心肌瘢痕的大小和位置,与心室壁运动异常的严重程度和左室射血分数(left ventricular ejection fraction,LVEF)密切相关。 相较于心脏磁共振,SQs 系统更简单经济,可用于估计再灌注后梗死面积[1-2]。 该评分系统将心电图测得的心室去极化的细微变化转化为心肌瘢痕位置及大小的信息,通过评估AMI 患者出院时的SQs,可以提高对其死亡风险的预测能力。
本研究通过分析468例AMI 患者的临床资料,利用SQs 评估心肌梗死面积,结合动态心电图及6 个月主要心血管不良事件(major adverse cardiovascular events,MACEs)发生情况等指标,进一步探讨SQs 与AMI 患者发生室性心律失常及MACEs 的相关性,对评估AMI 患者危险程度具有一定的临床意义。
1 材料和方法
1.1 研究对象
共纳入2018年1 月至2020年4 月在昆明医科大学第二附属医院心内科首次因胸闷、胸痛确诊为AMI,并接受经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗的患者468例,其中男349例、女 119例,平均年龄(60.97 ±12.42)岁。 根据SQs 将 AMI 患者分成两组:SQs < 3 分组 179例,其中男126例、女53例,平均年龄(61.18 ±13.02)岁;SQs≥3 分组 289例,其中男 223例、女 66例,平均年龄(6.84 ±12.05)岁。
1.2 排除标准
严重的呼吸系统疾病、消化系统疾病、脑血管疾病、血液系统疾病、感染性疾病、肾脏疾病、自身免疫性疾病、神经内分泌疾病、恶性肿瘤、各类心肌病及先心病、相关数据缺失者和失访者。
1.3 研究方法
1.3.1 一般资料的收集 收集的一般资料包括患者年龄、性别、用药史、既往史(糖尿病、高血压、吸烟、恶性肿瘤、精神疾病、家族遗传性疾病等)。 所有AMI 患者入院后完善相关检查及检验,记录LVEF、肌酐(Cr)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、NT-proBNP、肌酸激酶同工酶(CK-MB)、肌钙蛋白(TnT)、D-二聚体等指标。
1.3.2 超声心动图检查 根据2016年发布的《中国成年人超声心动图检查测量指南》[3],使用M 型超声心动图对PCI 治疗后第2 天的AMI 患者进行检测。 采用双平面Simpson 法,在心尖四腔心及两腔心切面测量LVEF。
1.3.3 常规心电图检测及Selvester QRS 评分计算统一采用日本光电12 导联心电图机,采集所有入选AMI 患者出院时最后一份心电图。 采集时设定振幅1 mV、走纸速度25 mm/s 进行描记,每次均由心功能科2 名以上有丰富经验的医师进行心电图的分析和判读。 根据 2011年 Loring 等[4]发布的指南(采用54 条标准),观察标准12 导联心电图 Ⅰ、Ⅱ、aVL、aVF、V1—V6导联的 Qε波、Rε波持续时间以及R/Q 和R/S 振幅之比,并计算各导联相应的分数,以总分乘以3%即得估算的心肌梗死面积。
1.3.4 动态心电图检测 所有AMI 患者PCI 治疗后第2 天行动态心电图检查。 根据Lown 分级标准,将室性心律失常分为0~Ⅲ、ⅣA、ⅣB 和Ⅴ级。①0 级:无室性早搏。 ② Ⅰ级:偶发、单个室性早搏。 ③ Ⅱ级:频发、单个室性早搏。 ④ Ⅲ级:多源、多形性室性早搏。 ⑤ ⅣA 级:成对、连发室性早搏。⑥ ⅣB 级:连续3 个以上室性早搏。 ⑦ Ⅴ级:RonT现象。 记录患者心率变异性时域指标,包括24 h 正常R-R 间期的标准差(SDNN)、相邻正常R-R 间期差值的均方根(rMSSD)、相邻正常R-R 间期差值>50 ms 的百分比(pNN50)以及三角指数。
1.3.5 主要不良心血管事件 对入选患者出院后随访6 个月。 MACEs 包括心力衰竭、恶性心律失常、再发心绞痛、心肌梗死以及心源性死亡,其中,心力衰竭依据《中国心力衰竭诊断和治疗指南2018》[5]诊断;本研究记录的恶性心律失常包括RonT、室性心动过速、三度房室阻滞。
1.4 统计学方法
所有数据均采用SPSS 26.0 统计学软件进行统计分析。 对计量资料进行正态性检验,如符合正态分布,则采用¯表示;否则采用中位数M(Q1,Q3)表示。 分类变量采用n(%)表示。 组间比较采用t检验或χ2检验,多因素相关分析采用二分类Logistic 回归分析。 进一步进行ROC 曲线分析,以确定SQs 的最佳截止值,获得该点的敏感性和特异性,从而判断AMI 患者发生心力衰竭的可能性。 以P<0.05 为差异有统计学意义。
2 结果
2.1 急性心肌梗死患者临床基线资料比较
根据SQs 中位数将入选的468例AMI 患者分为两组,其中 SQs <3 分组 179例,SQs≥3 分组289例。 两组在年龄、性别、BMI、既往史、心率及生化相关指标之间比较,差异无统计学意义(P>0.05)。 两组间心肌梗死类型为STEMI 的患者例数及所占比例比较,差异有统计学意义(P<0.05)。 见表 1。
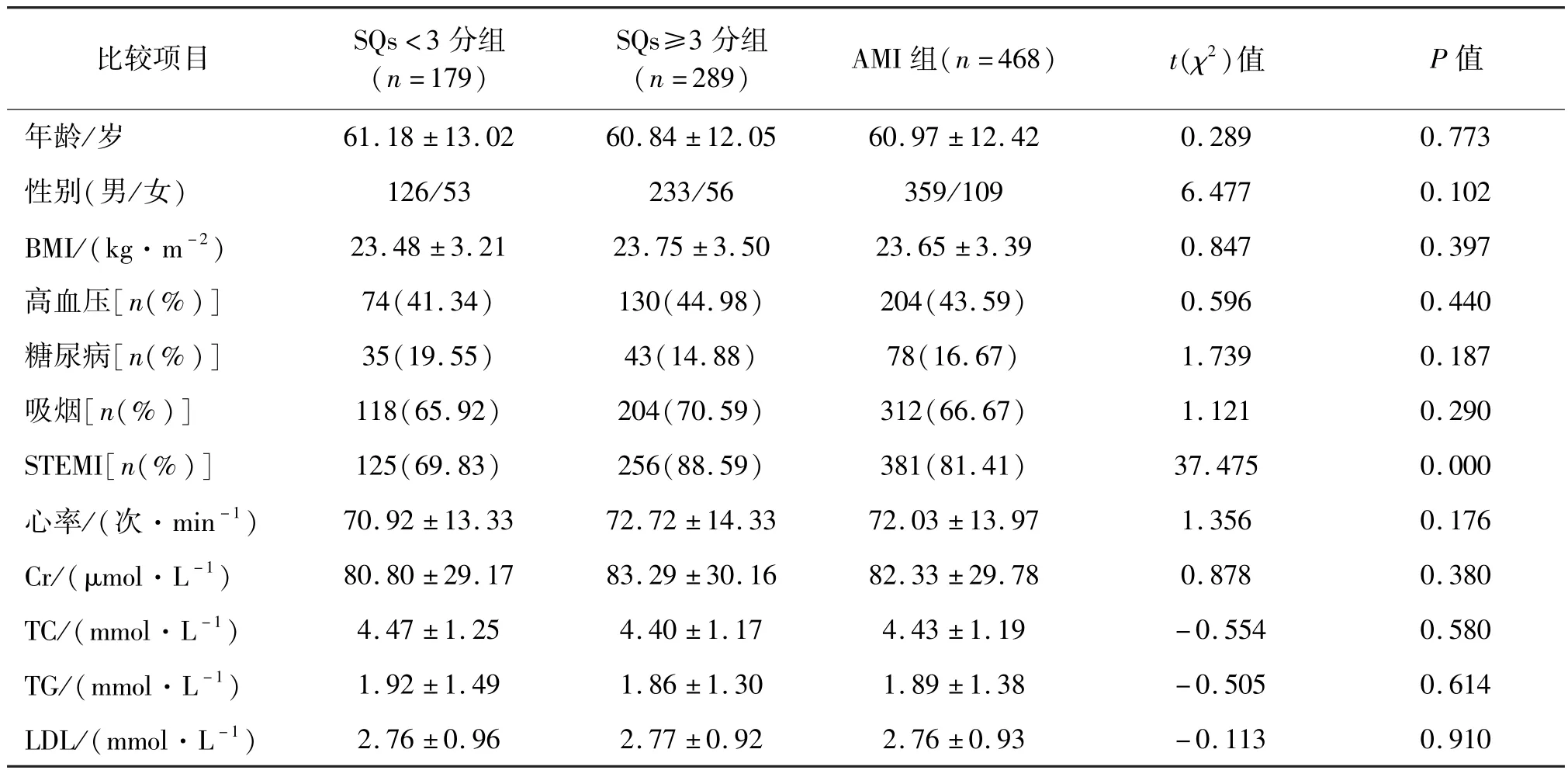
表1 两组临床基线资料比较Tab.1 Comparison of clinical baseline data between the two groups
2.2 两组室性心律失常、主要不良心血管事件发生情况比较
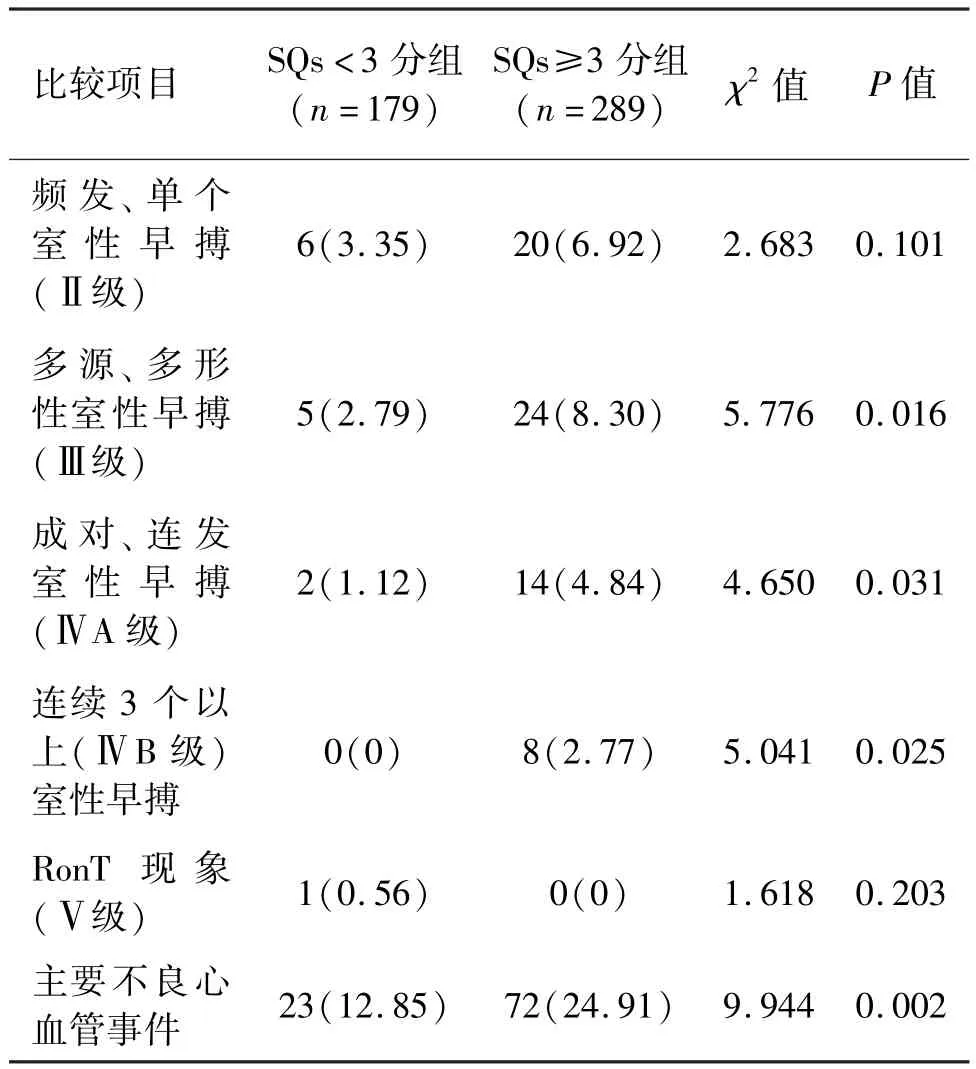
两组间0~Ⅱ、Ⅴ级室性心律失常发生率比较,差异无统计学意义(P>0.05)。 两组间Ⅲ、Ⅳ级室性心律失常发生率比较,差异有统计学意义(P<0.05)。 SQs≥3 分组中,MACEs 事件的发生率高于SQs <3 分组,且差异有统计学意义(P<0.05)。 见表 2、表 3。
2.3 两组急性心肌梗死患者心率变异性指标比较
两组间SDNN、rMSSD、pNN50 及三角指数比较,差异均无统计学意义(P>0.05)。 见表4。
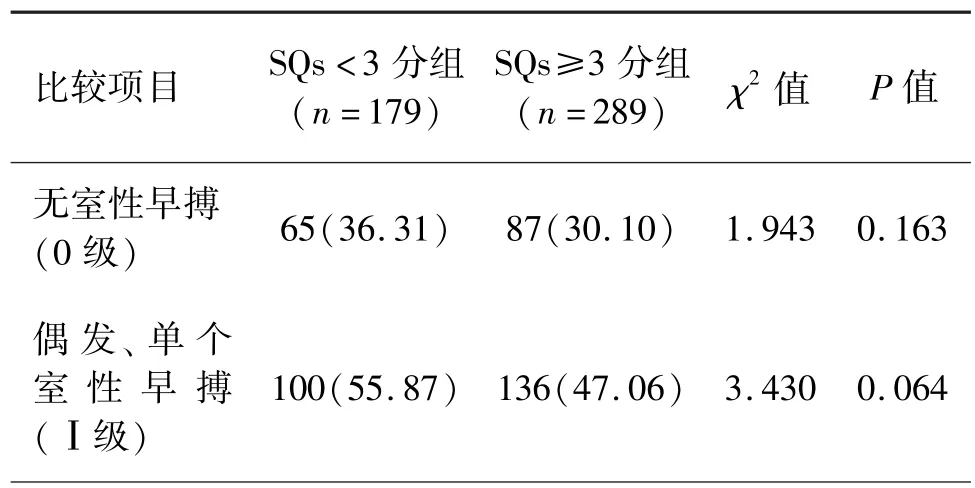
表2 两组室性心律失常、主要不良心血管事件发生情况比较Tab.2 Comparison of the incidence of ventricular arrhythmias and major adverse cardiovascular events between the two groups
____续表

表3 两组主要不良心血管事件发生情况比较Tab.3 Comparison of the incidence of major adverse cardiovascular events between the two groups
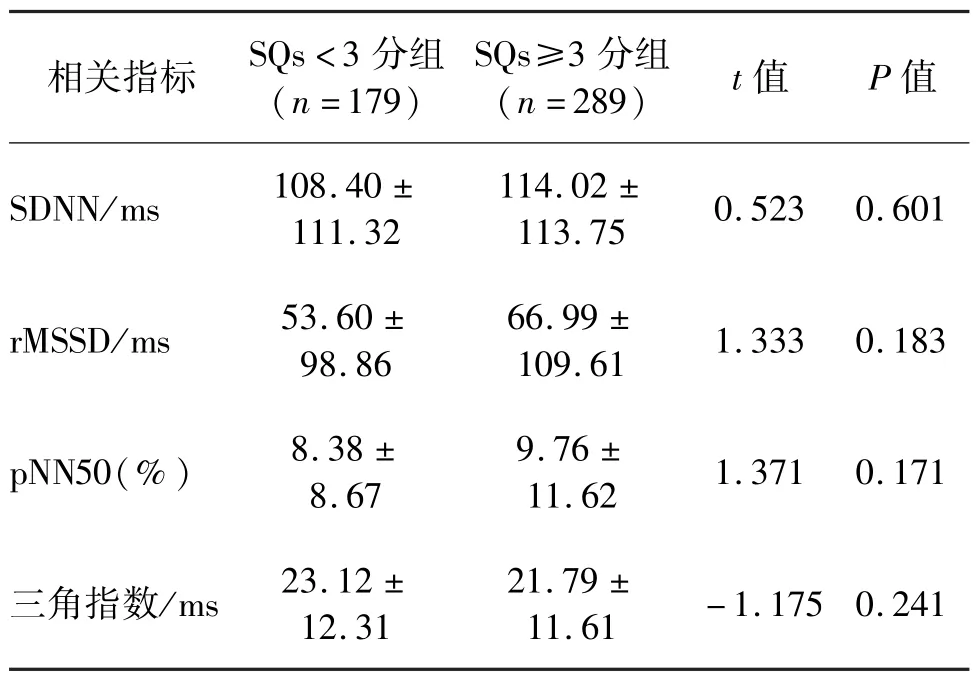
表4 两组心率变异性指标比较Tab.4 Comparison of heart rate variability indexes between the two groups
2.4 Selvester QRS 评分≥3 分的影响因素
以性别、年龄、心肌梗死类型为STEMI、糖尿病、吸烟、心率为变量进行逐步回归分析,最终得到的模型表明“心肌梗死类型为STEMI”是SQs≥3 分的影响因素(P<0.05)。 见表 5。
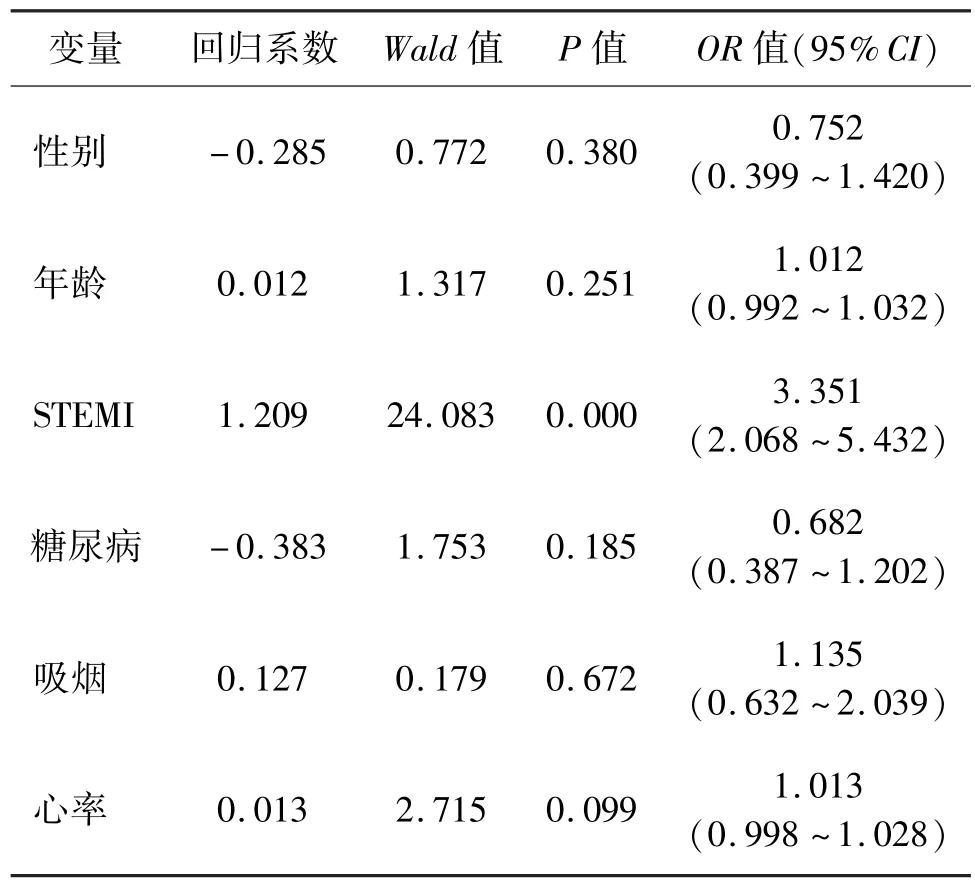
表5 Selvester QRS 评分≥3 分影响因素的二元Logistic 回归Tab.5 Binary Logistic regression of influencing factors for Selvester QRS score≥3
2.5 Selvester QRS 评分与临床资料之间的Spearman相关性分析及线性回归
SQs 不符合正态性检验,采用Spearman 相关性分析,结果显示:SQs 与 CK-MB(r= 0.110,P=0.017)、TnT(r=0.255,P=0.000)、NT-proBNP(r=0.113,P=0.014)、D-二聚体(r=0.187,P=0.000)、QRSε波时限(r=0.216,P=0.000)呈正相关,且差异有统计学意义(P<0.05)。 SQs 与 LVEF 呈负相关(r= -0.156,P=0.001),且差异有统计学意义(P<0.05)。 SQs 与年龄无相关关系(r= -0.027),且差异无统计学意义(P>0.05)。 见表6、图1。
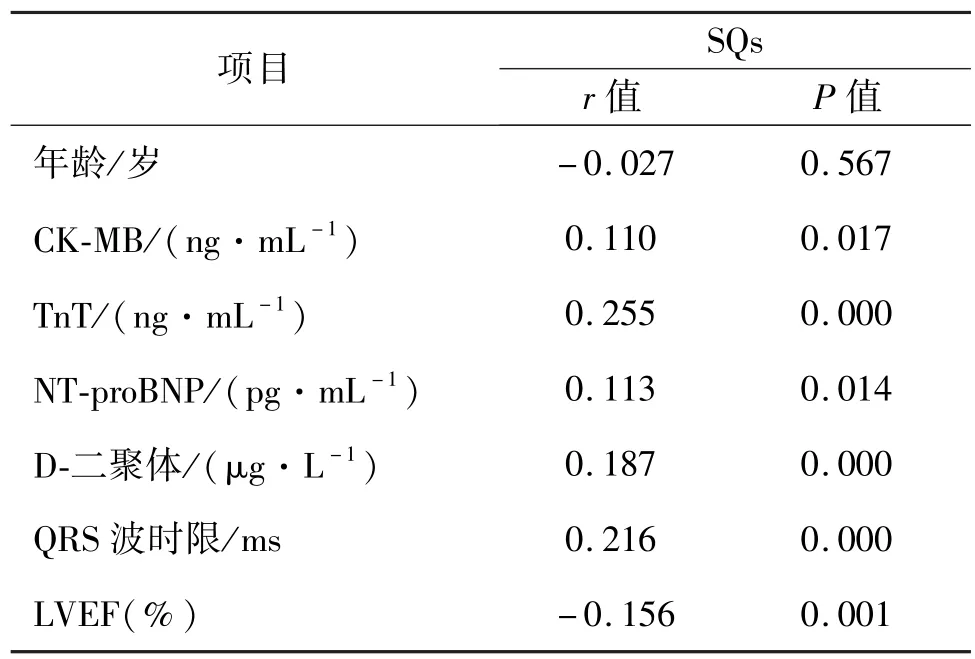
表6 Selvester QRS 评分与临床资料之间的Spearman相关性分析Tab.6 Spearman correlation analysis between Selvester QRS score and clinical data
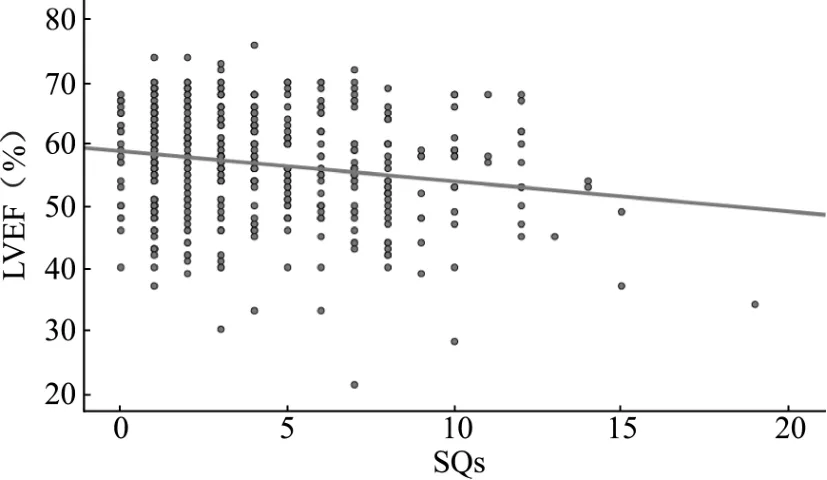
图1 Selvester QRS 评分与左室射血分数相关性分析的散点图Fig.1 Scatter plot of correlation analysis between Selvester QRS score and left ventricular ejection fraction
2.6 Selvester QRS 评分预测急性心肌梗死患者心力衰竭的ROC 分析
运用SQs 预测 AMI 患者心力衰竭的 ROC 曲线,结果提示曲线下面积为0.656(95%CI0.587~0.690)。 当 SQs 诊断截断值取 5.5 时,SQs 预测AMI 患者心力衰竭的价值最高(敏感性51.4%,特异性74.4%)。 见表7、图2。
3 讨论
SQs 是一种基于标准12 导联心电图定量标准的评分系统,可用于评估左心室心肌瘢痕的大小和位置,与心室壁运动异常的严重程度和LVEF 密切相关,还可用来简单、经济地估计再灌注后梗死面积[6-8]。 该评分系统将心电图测得的心室去极化的细微变化转化为心肌瘢痕位置和大小信息,通过评估AMI 患者出院时的SQs,可以更准确地识别其死亡风险。
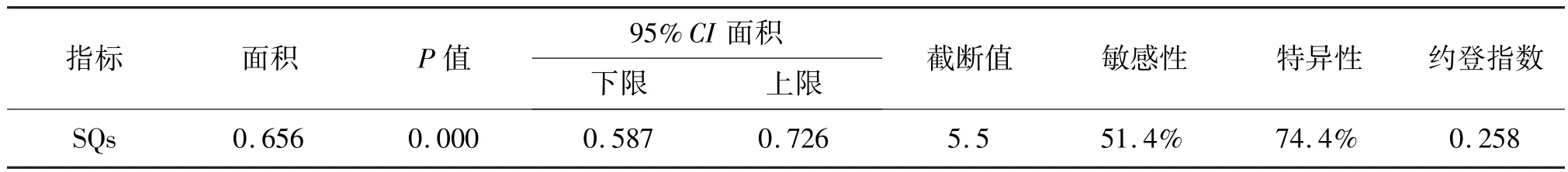
表7 Selvester QRS 评分预测急性心肌梗死患者心力衰竭的ROC 分析结果Tab.7 ROC analysis results of Selvester QRS score for predicting heart failure in patients with acute myocardial infarction

图2 Selvester QRS 评分预测急性心肌梗死患者心力衰竭的ROC 曲线Fig.2 ROC curve of Selvester QRS score for predicting heart failure in patients with acute myocardial infarction
AMI 患者易发生各种心律失常,尤其是室性心律失常。 发生恶性心律失常是AMI 患者早期死亡的重要原因[9-10]。 本研究发现,在 SQs < 3 分组与SQs≥3 分组中,0~Ⅱ、Ⅴ级室性心律失常发生率差异无统计学意义,而SQs≥3 分组的Ⅲ、Ⅳ级室性心律失常发生率显著高于SQs <3 分组,且差异有统计学意义。 本研究提示,SQs≥3 分与多源、多形性,成对室性早搏以及室速等恶性心律失常相关,提示SQs 评分高的AMI 患者可能易发生室性心律失常,特别是恶性室性心律失常事件,因此,SQs 可作为AMI 后发生室性心律失常的预警指标。 两组Ⅴ级室性心律失常发生率比较,差异无统计学意义,可能与研究样本中这类心律失常的发生例数较少有关。
心率变异性是反映自主神经系统活性、定量评估心脏交感神经与迷走神经张力及其平衡性的指标,可用于识别AMI 患者自主神经功能损伤的恢复能力[11]。 既往研究提示,心率变异性降低与心脏病患者的自主神经功能障碍和较差的预后相关[12-14]。本研究中的两组心率变异性指标(SDNN、rMSSD、pNN50、三角指数)比较,差异无统计学意义,原因可能是两组AMI 患者处在心肌梗死发病早期,自主神经功能损伤尚未完全表现出来。 二元Logistic 回归分析结果表明,SQs≥3 分与心肌梗死类型为STEMI有关。 及早识别和治疗STEMI 类心肌梗死患者,有助于改善预后,因此在临床中应多加关注。
AMI 及其并发症严重危害人类健康,其中,心力衰竭是AMI 最常见的并发症。 心肌梗死后心力衰竭是指患者发生AMI(包括STEMI 和NSTEMI 患者)后,在住院期间或出院后出现的心力衰竭[15]。我国CREATE 研究发现,STEMI 患者发生心肌梗死后7 d 内有19.3%的概率发生心力衰竭[16]。 BRIGHT研究表明,在接受急诊PCI 治疗的AMI 患者(其中88%为STEMI)中,有14.3%的患者入院后发生心力衰竭[17]。 心肌梗死后心力衰竭发病率高、预后差,严重影响患者的生存质量。 对AMI 严重程度的评价及危险分层,一直是临床医生关注的问题。 它贯穿整个疾病的发生发展,是为AMI 患者制定治疗策略和改善其短期、长期预后的基础[18]。 本研究在进行相关性分析时发现,LVEF 与SQs 之间呈负相关关系。 ROC 曲线分析表明,当SQs 诊断截断值取5.5 时, 预测 AMI 患者心力衰竭的敏感性为51.4%,特异性为74.4%,可为临床医生评估AMI患者的预后提供参考。
AMI 是严重的心血管事件,致死致残率高。 若AMI 患者合并心力衰竭、心源性休克、心律失常、机械并发症等,则提示预后不良,因此,及时、准确的危险分层和风险评估可指导治疗和改善预后[19-20],具有重要意义。 临床上可通过冠脉造影、心脏磁共振检查以及超声心动图评估心肌的病变程度、左心功能。 12 导联心电图简单实用、可操作性强,各项参数指标亦可为临床医生提供参考,对住院和长期随访患者的预后有一定的预测价值[21]。 心脏磁共振检查是目前评价心肌梗死面积的常规方法,但因其操作复杂、价格昂贵,一定程度上限制了临床推广。 SQs 已被证明与解剖测量的心肌梗死面积高度相关,相关研究也证实了SQs 对心肌梗死患者预后的预测价值。 2011年 Loring 等[4]发布的指南还将AMI 合并束支阻滞或心室肥厚患者纳入研究,将SQs 的应用范围扩大到更广泛的人群。
SQs 作为一种基于12 导联心电图定量标准的评分系统,可用来评价AMI 患者室性心律失常和预测近期MACEs。 本研究存在一定的局限性:①本研究为单中心、回顾性研究,今后需进一步开展多中心、前瞻性研究;② AMI 患者的心电图处于动态演变中,本研究采用出院时心电图计算SQs 存在一定的偏倚;③随访时间相对较短,应延长随访时间,进一步探讨SQs 与AMI 患者长期预后的关系。

