姜黄素催化生姜提取物的光化学反应及抗菌活性研究*
黎晓菊,张晓梅△,庹呈杰,张科涛,秦杰琛,张 冰,黄之镨,赵 庆△
(1.云南中医药大学,云南 昆明 650500;2.昆明医科大学,云南 昆明 650500)
病原微生物耐药性一直是全世界关注的重大问题。随着抗生素的滥用和超级耐药菌的出现,细菌耐药性对人类的危害越来越严重,感染性疾病死亡率也越来越高[1]。耐甲氧西林金黄色葡萄球菌(MRSA)是一种最常见的耐药病原菌,是临床上非常棘手的治疗难题。患者一旦感染MRSA,因其对目前临床常用的抗生素多具有耐药性,仅万古霉素等少数有效,死亡率较高。然而,临床已出现耐万古霉素或敏感性下降的菌株[2-3]。所以,从天然产物及其衍生物中挖掘对MRSA安全有效的新型抗感染药物,是人类面临的紧迫任务。近年来,从传统药用植物中寻找新的抗菌成分,并对其抗菌机制进行研究已经成为医学界的研究热点。
姜属(Zingiber)为姜科植物,我国有14种,多分布于西南部至东南部。姜属植物大多以根茎入药,具芳香或辛辣味[4]。生姜(Zingiber officinale Roscoe)是姜科姜属植物,各地均产,至今已3000年的栽培历史,是传统的药食同源植物。生姜性温,味辛,归肺、脾、胃经,具有解表散寒、温中止呕、温肺止咳等功效[5-7]。药理研究表明,生姜具有抗炎、抗菌、抗肿瘤、抗氧化、促进消化、改善血液循环、健胃止痛等功能[8-10]。生姜的化学成分主要包括黄酮类、姜辣素类、二苯基庚烷类、挥发油等[11-12]。已有研究表明,生姜提取物和精油具有较好的抗菌活性[13-15]。生姜的乙醇提取物能通过抑制铜绿假单胞菌的生物膜形成而抑制其生长[16]。生姜中的[10]-姜辣素和[12]-姜辣素对3种与口腔牙周炎有关的厌氧菌有较强的抗菌活性[17]。此外,姜属植物阳荷的挥发油对金黄色葡萄球菌、大肠杆菌、白色念珠菌、粪肠球菌和铜绿假单胞菌均有较强的抑菌活性[18]。姜属植物Zingiber neesanum对肠球菌、鲁西毛霉具有抑菌活性[15]。
课题组前期研究发现,药材姜黄和紫色姜提取液经光照后,其化学成分可能在姜黄素的催化下发生了光化学反应,生成了新的产物,同时抗菌活性明显增强[19]。这提示其它姜科植物的化学成分在姜黄素的催化下,有可能发生光化学反应,并得到抗菌活性增强的产物。为探究其它姜科植物是否也会在姜黄素的催化下发生光化学反应,本研究拟对生姜提取物进行光照前后的化合物检测及抗菌活性测试。前期通过薄层色谱分析生姜的化学成分,未检测到姜黄素,因此在本实验中创新性地加入姜黄素,并检测光照前后的生姜提取物成分及抗菌活性变化。
1 材料与方法
1.1 药材与药品 市售的云南罗平生姜经云南中医药大学马伟光教授鉴定。生姜洗净、切成薄片,晾干,粉碎后备用。姜黄素购买于阿拉丁试剂公司。
1.2 仪器与试剂 打粉机、研钵、超声波清洗器(上海科导超声仪器有限公司);FA2004电子天平(上海舜宇恒平科学仪器有限公司);OSB-2100旋转蒸发仪(上海爱朗仪器有限公司);ES-315高压蒸汽灭菌锅(TOMY公司);恒温培养箱、电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);SW-CJ-2FD洁净工作台(AIRTECH公司);LED灯(功率100 W,口径8.5 cm,波长410~780 nm)。Agilent 1260高效液相色谱仪(安捷伦科技有限公司);色谱柱(Agilent TC-C18(250 mm×4.6 mm,5 μm));光二极管阵列检测器(DAD)。培养基配料等常用试剂、耗材均购自雅云生物科技有限公司。有机溶剂:丙酮、乙酸乙酯、石油醚等均为分析纯。
1.3 指示菌 革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus ATCC 29213),枯草芽孢杆菌(Bacillus subtilis ATCC 6633),肺炎链球菌(Streptococcus pneumoniae),耻垢分枝杆菌(Mycobacterium smegmatis1037),粪肠球菌(Enterococcus faecalis ATCC-29212),耐甲氧西林金黄色葡萄球菌(MR SA):1450,1505,2024,1957,1591,28299,I-20,I-67,28300。革兰氏阴性菌:大肠杆菌(Escherichia coli ATCC 25922),鲍曼不动杆菌(Acinetobacter baumannii ATCC 19606),克雷伯氏菌(Klebsiella pneumonia ATCC 13883)。真菌:白色念珠球菌(Candida albicans),白色念珠球菌耐药菌(Drug-resistant Candida albicans):23#、63#、1730#、1725#、1732#。以上供试菌株均由课题组前期研究保存。
1.4 培养基 病原细菌培养基LB:胰蛋白胨10 g,酵母提取物 5 g,氯化钠 10 g,琼脂 15 g,水 1 L,pH 7.2~7.6。真菌培养基沙保氏培养基:蛋白胨10 g,葡萄糖 40 g,琼脂 15 g,水 1 L,pH 6.0。
1.5 实验方法
1.5.1 样品处理 取姜黄素2份(各1.5 mg)于1 mL试样瓶中,分别加入300 μL丙酮溶解(编号分别为Cur1、Cur2),加盖密封。将Cur2精密称重并记录重量,用LED灯光照4 h后再次称重,用丙酮补重至原来的重量。Cur1放置暗处贮存。
取生姜干燥粉末30 g置于棕色瓶中,加入180 mL丙酮置于暗处浸泡12 h,超声30 min,过滤,滤渣加90 mL丙酮超声10 min,过滤,合并2次滤液,避光浓缩得浸膏。精密称取3份浸膏,每份0.300 g,第1份浸膏用60 mL丙酮溶解,盛于250 mL锥形瓶,用LED灯光照4 h,浓缩,编号为ZO1。第2份浸膏中加入15.0 mg姜黄素,加入60 mL丙酮溶解,避光浓缩,编号为ZO2,置于暗处保存。第3份浸膏中加入15.0 mg姜黄素,加入60 mL丙酮溶解,盛于250 mL锥形瓶,用LED灯光照4 h,浓缩,编号为ZO3。
另取生姜干燥粉末10 g置于棕色瓶中,加入60 mL丙酮置于暗处浸泡12 h,超声30 min,过滤,滤渣加30 mL丙酮超声10 min,过滤,合并2次滤液,避光浓缩得浸膏。精密称取2份浸膏,每份0.150g。在第1份浸膏中加入7.5 mg姜黄素,加入20 mL丙酮溶解,浓缩,用甲醇溶解,定容于25 mL棕色容量瓶中,编号为ZO2a,置于暗处保存。第2份浸膏中加入7.5 mg姜黄素,加入20 mL丙酮溶解,盛于150 mL锥形瓶,用LED灯光照4 h,浓缩,用甲醇溶解,定容于25 mL棕色容量瓶中,编号为ZO3a。
1.5.2 抗菌活性测试 病原菌接种至液体LB培养基,37℃、200 r/min黑暗培养12 h;白色念珠菌及其耐药菌接种至液体沙保氏培养基,28℃、200 r/min黑暗培养24 h。用液体培养基将各菌液分别稀释至1×106~1×107cfu/mL备用。采用抗菌纸片扩散法[20],对 1.5.1 的 5 个样品(Cur1、Cur2、ZO1、ZO2、ZO3)进行抗菌活性测试。
将稀释后的指示菌菌液均匀涂布在固体培养基上,称取1.5.1中的ZO1、ZO2、ZO3各90 mg,分别加入 900 μL 丙酮溶解至质量浓度为 100 μg/μL,分别取10 μL溶液于直径5 mm的圆形滤纸片上,直至滤纸片将提取液完全吸收后贴于接种好指示菌的固体培养基上,每份提取液平行做3组。以10 μL丙酮做空白对照,以抗生素做阳性对照(革兰氏阳性菌以苄基青霉素为阳性对照,革兰氏阴性菌以卡那霉素为阳性对照,真菌以氟康唑为阳性对照;每个滤纸片上的抗生素质量为50 μg)。真菌在28℃下培养,其余病原细菌于37℃培养,恒温培养12 h后测量抑菌圈直径。
分别取1.5.1中的Cur1、Cur2溶液10 μL于直径5 mm的圆形滤纸片上,直至滤纸片溶液完全吸收后贴于接种好指示菌的固体培养基上,每份溶液平行做3组,按照2.2.1的方法进行抗菌活性测试。
1.5.3 TLC检测加入姜黄素的生姜提取液光照前后化学成分变化 将1.5.1中的样品ZO2、ZO3各取2 mg,溶于0.5 mL丙酮,用毛细管分别吸取上述溶液各5 μL,在硅胶GF254板上点样后,以石油醚∶乙酸乙酯(5∶1)展开,分别以过氧化物显色剂[21]及10%硫酸-乙醇显色,拍照记录薄层色谱结果。
1.5.4 HPLC检测加入姜黄素的生姜提取液光照前后化学成分变化 将1.5.1中的样品ZO2a与ZO3a用高效液相色谱分析。流动相乙腈(A)-水(B),梯度洗脱(0~30 min,35%~70%A;30~50 min,70%~90%A;50~60 min,90%A)。体积流量 1 mL/min,柱温 30℃,进样量 5 μL。
2 结果
2.1 抗菌活性测试结果 采用纸片扩散法,对未经光照的姜黄素溶液Cur1和经过光照的姜黄素溶液Cur2进行抗菌活性测试,采用23种病原菌菌株。测试结果表明:无论是否经过光照,姜黄素试样对所测试的23株病原菌均未显示抑菌活性,结果见表1。
采用纸片扩散法,对未加入姜黄素、经过光照的生姜提取物ZO1,加入姜黄素未经光照的生姜提取物ZO2,加入姜黄素并经光照的生姜提取物ZO3,进行抗菌活性测试,采用23种病原菌菌株。测试结果见表1 和图 1。测试结果表明:(1)ZO1、ZO2、ZO3 对所测试的23种病原菌具有广谱抗菌活性。ZO1、ZO2对多数菌株的抗菌活性较弱(抑菌圈<10 mm),仅对MRSA2024、耻垢分枝杆菌1037的活性较强(抑菌圈>10 mm)。ZO3对金黄色葡萄球菌、9个MRSA、耻垢分枝杆菌的抑制活性较强(抑菌圈>10 mm),对其它菌株的抑制活性较弱(抑菌圈<10 mm)。(2)ZO3对9种耐甲氧西林金黄色葡萄球菌(MRSA1450、1505、2024、1957、28299、28300、1591、I-20、I-67) 的抑制活性远高于ZO1、ZO2。ZO3对金黄色葡萄球菌(Staphylococcus aureus ATCC 29213)的抑制活性也明显高于ZO1、ZO2。(3)ZO3对耻垢分枝杆菌(Mycobacterium smegmatis1037)的抑制活性远高于ZO1、ZO2;ZO3对枯草芽孢杆菌(Bacillus subtilis ATCC 6633)的抑制活性略高于ZO1、ZO2;对肺炎链球菌(Streptococcus pneumonia)和粪肠球菌(Enterococcus faecalis ATCC-29212)的抑制活性与 ZO1、ZO2相当。(4)ZO1、ZO2、ZO3对3种革兰氏阴性菌(大肠杆菌、鲍曼不动杆菌、克雷伯氏菌)有较弱的抑制活性。(5)ZO1、ZO2对3种白色念珠菌耐药菌无抑制活性,对2种白色念珠菌耐药菌仅有微弱的抑制活性;而ZO3对上述5种菌株的其中4种,抑制活性均明显高于ZO1、ZO2。

表1 各个测试样品的抑菌圈直径

图1 ZO1、ZO3对MRSA-1957抑菌圈对比
综上,生姜提取液加入姜黄素并经光照后,不仅对23株病原菌都有抑菌活性,而且对多数病原菌的抑菌活性显著提高,特别是对MRSA的抑制活性都显著增强。与课题组前期研究中的姜黄、紫色姜相比[19],加入姜黄素并经光照的生姜提取液抗菌活性比前二者更强(特别是对MRSA),对革兰氏阳性菌的抗菌谱更广。
2.2 薄层色谱检测加入姜黄素的生姜提取物光照后的化学成分变化 通过薄层色谱法对加入姜黄素未经光照的提取物ZO2与加入姜黄素并经光照的提取物ZO3进行检测。结果表明,未经光照的ZO2检测不到过氧化物,而经过光照的ZO3可检测到多个过氧化物(图2A)。此外,采用10%硫酸-乙醇显色剂时,ZO2与ZO3也有明显不同(图2B)。由此可见,姜黄素在光照下催化生姜化学成分发生光化学反应,产生一系列氧化产物。
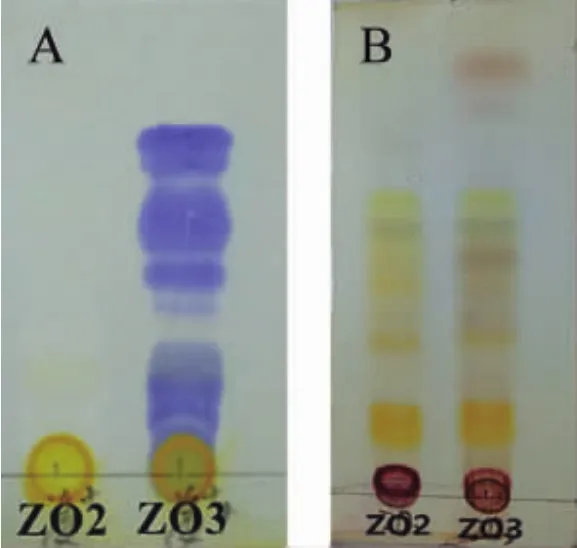
图2 加入姜黄素的生姜提取物光照前后的薄层色谱图
2.3 高效液相色谱法检测加入姜黄素的生姜提取物光照后的化学成分变化 用高效液相色谱法对加入姜黄素未经光照的生姜提取物ZO2a,与加入姜黄素并经光照的生姜提取物ZO3a进行检测(在205nm与254nm的检测结果见图3、图4)。根据色谱图分析,在光照前后,化学成分发生了明显的变化,说明可能发生了光化学反应。
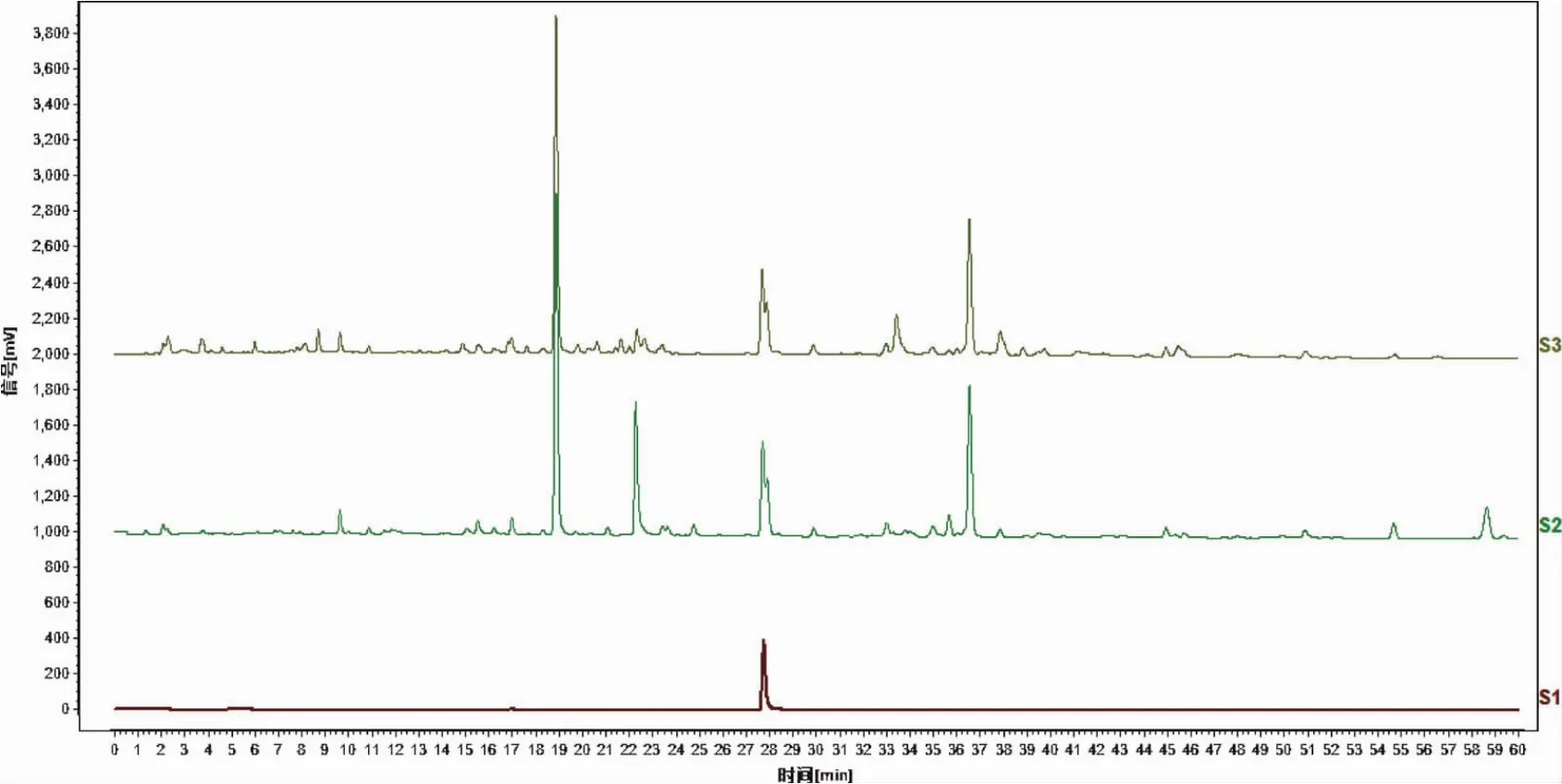
图3 加入姜黄素的生姜提取物光照前后的高效液相色谱图(检测波长205nm)

图4 加入姜黄素的生姜提取物光照前后的高效液相色谱图(检测波长254nm)
3 讨论
姜黄素溶液无论是否经过光照,对23株病原菌株均未显示抗菌活性。因此在后续的实验中,抗菌活性的产生可归因于生姜中的化学成分及光照后的光化学反应产物,而不是姜黄素。ZO1组与ZO3组虽然二者都经过光照,但前者未加入姜黄素,后者加入了姜黄素。ZO2组与ZO3组虽然二者都加入了姜黄素,但前者未经过光照,后者经过光照处理。ZO3组的对大多数菌株的抗菌活性显著高于ZO1和ZO2组,由此可见:加入姜黄素和光照,对抗菌活性的改变起到了至关重要的作用,这2个因素缺一不可。加入姜黄素并经光照的ZO3组,对多数革兰氏阳性菌的抗菌活性有显著提高,特别是对一系列耐甲氧西林金黄色葡萄球菌(MRSA)以及耻垢分枝杆菌的抗菌活性的提高幅度很大;对3种革兰氏阴性菌的抑制活性影响较小;对多数白色念珠菌耐药菌的抑制活性有少许提高。
ZO2组与ZO3组的薄层色谱与高效液相色谱均有较为明显的差别,这表明姜黄素可催化生姜的一些化学成分发生光化学反应。
耐药菌的出现和蔓延是全球关注的重大问题,特别是耐甲氧西林金黄色葡萄球菌(MRSA),已成为医院感染和社区感染的一种最常见病原菌,严重危害人们的身体健康。将姜黄素加入生姜提取液中,使其催化生姜化学成分发生光化学反应,这尚属课题组的首创。且生姜提取物经过光化学反应后,显示了较强的抗菌活性,特别是对耐甲氧西林金黄色葡萄球菌(MRSA)的抗菌活性有极大提高。下一步,我们将采用HPLC-MS初步判断光化学反应产生的化学成分的类型,再通过活性追踪寻找有价值的活性化合物。此研究工作将为抗MRSA的天然药物研究与开发提供新的途径。

