高分辨熔解曲线技术结合荧光实时PCR法同时检测鸡肉中4种食源性致病菌
张静,周倩,唐梦君,张小燕,唐修君,陆俊贤,高玉时,顾荣
(江苏省家禽科学研究所,江苏扬州 225125)
食品安全是关系到民生的重大事件,目前由于食源性致病菌引起的疾病在世界各国都引起重视,特别是微生物食物中毒事件[1]。国内目前在禽肉食品中常见的食源性致病菌主要有沙门氏菌[2,3]、单增李斯特菌[4-6]、金黄色葡萄球菌[5,7]和空肠弯曲菌[8,9]。由于禽肉产品中的高携带率和污染状况,建立能同时检测上述4种菌快速检测与鉴定方法是及时有效地控制和预防致病菌传播的前提。
目前食源性致病菌的检测方法主要包括传统培养法与生理生化检验,以及包括酶联免疫法、分子生物学方法等快速检测技术。传统的检测方法无法对难培养或不可培养的致病菌进行检测,且耗时费力,获得结果通常需要几天的时间,不能实现有效的监测和预防作用。且单独检测一种致病菌已无法满足现今社会对致病菌检测高效率的要求。多重PCR是在同一反应管中同时完成多种致病菌的高效PCR扩增,从而实现多种致病菌DNA的同步快速检测的技术。由于多重PCR可降低致病菌检测过程中样本、物资、试剂、工作量等占用的时间和空间,多重PCR技术在降低检测成本方面显得非常经济[10]。高分辨熔解曲线分析技术(High Resolution Melting,HRM)是一种基于单核苷酸熔解温度不同而形成不同熔解曲线的基因分析技术,通过与实时荧光PCR相结合,可以实时监测温度上升时双链DNA的解链过程。且该技术达到了真正的闭管操作,避免传统荧光操作和凝胶分离步骤,降低交叉污染的可能性及整体分析时间[11]。HRM技术以其高特异性、高通量、高灵敏度、低成本、快速等优势,在临床诊断及基因分析上得到迅速发展,已成为生命科学研究中的热点技术[12-20],利用HRM技术能针对每一种细菌的固定DNA序列产生精确的Tm值,可将HRM分析技术应用于多种致病菌的检测中。因此,本文利用fimY、hly、nuc和orfC为靶基因,建立多重HRM-real time PCR检测体系,采用高分辨熔解曲线分析技术同时检测4种禽肉中常见的食源性致病菌(沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌),并进行了评价和初步应用。
1 材料与方法
1.1 材料
1.1.1 菌株与样本
本实验选取S. EntericaCMCC50041,L.monocytogenesATCC19115、S. aureusATCC12598和C. jejuniATCC33560这四株菌株作为目标试验菌株(本实验室自有或购买)。10份不含上述四种菌的空白鸡肉样本已经过检验。
1.1.2 主要试剂
MeltDoctor TM HRM Master mix,美国Thermo公司;细菌DNA提取试剂盒,宝生物工程(大连)有限公司;CCDA培养基和MH培养基,英国OXOID公司;营养琼脂培养基、LB培养基和脱纤维绵羊血,青岛海博生物技术有限公司;DEPC水,混合气(5%O2、10% CO2和85% N2),南京特种气体厂有限公司。
1.1.3 主要仪器
生物安全柜(A2),日本ESCO公司;生化培养箱(HPS-150),太仓市华美生化仪器厂;高压灭菌锅(SANYO MLS-3750),日本;三用恒温水槽(XMTD-204),金坛市文化仪器有限公司;离心机(XT15R),日本HITACHI;超纯水分离系统(Mliili-Q Advantage A10),美国Millipore公司;超低温冰箱(DW-86L828),海尔;低温冰柜(BC/BD-318HD),海尔、电子天平(XS105),瑞士METTLER TOLEDO公司;TM-EXB5002S,南京汤姆斯衡器有限公司;移液枪,德国Eppendorf公司;恒温磁力搅拌器(HJ-3),江苏金坛市环宇科学仪器厂;涡旋混匀器(VTX-3000L),比利时LMS公司;QuantStudio™ 6 Flex全功能定量PCR仪,美国ABI公司。
1.2 方法
1.2.1 引物设计
广泛查阅资料,搜索目标菌株内保守、其他菌株间特异的基因片段,分别选取高度保守区域fimY、hly、nuc和orfC作为沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌的PCR扩增靶基因。在GeneBank上查询并下载所有靶基因序列,采用DNAStar软件中的seqman进行同源性分析,用生物软件Primer Express V2.0对上述保守片段设计引物。所有引物对的可行性经由NCBI上进行BLAST比对,验证引物的保守性。所有引物由上海生工生物工程股份有限公司合成。引物序列见表1。

表1 用于多重HRM-real time PCR的引物Table 1 The primers of multiplex HRM-real time PCR
1.2.2 细菌的培养
取保藏于-80 ℃的甘油保藏菌种,肠炎沙门氏菌、单增李斯特菌和金黄色葡萄球菌用接种环蘸取少许菌液划线接种至营养琼脂平板上,37 ℃培养24 h,复活菌种后接种环蘸取少许菌液混入LB营养肉汤中,37℃ 160 r/min恒温振荡器培养16 h;空肠弯曲菌用接种环蘸取少许菌液接种于CCDA平板微需氧条件下42 ℃培养36 h后富集培养于MH血平板。富集培养后的细菌置于4 ℃冰箱冷藏备用。
多重HRM-real time PCR法对食品样本检测后的增菌步骤用SSL复合增菌培养基进行增菌。
1.2.3 DNA模板的提取
肠炎沙门氏菌、单增李斯特菌、金黄色葡萄球菌采用液体LB培养基37 ℃过夜培养,然后分别取1.5 mL菌液依照DNA提取试剂盒说明书提取DNA,空肠弯曲菌将MH血平板纯化培养的细菌用无菌棉签刮下洗入PBS缓冲溶液,离心后去除上层液体。单增李斯特菌和金黄色葡萄球菌按革兰氏阳性菌提取,沙门氏菌和空肠弯曲杆菌按革兰氏阴性菌提取,所提取的DNA模板作为反应体系于-20 ℃贮存。
1.2.4 单重HRM-real time PCR反应体系的建立
根据MeltDoctorTMHRM Master mix,每20 μL的PCR反应体系包含10.0 μL MeltDoctor TM HRM Master mix,1.2 μL上游引物(5 μmol/L),1.2 μL下游引物(5 μmol/L),1.0 μL Template(反应组以基因组DNA为模板,对照组的模板为无菌去离子水),其余以无菌去离子水补齐。
单重HRM-real time PCR反应程序均为:95 ℃预变性1 min;以95 ℃变性15 s,60 ℃退火1 min扩增40个循环。PCR产物进行高分辨率熔解曲线分析,熔解程序为:95 ℃ 10 s,60 ℃ 1 min,0.025 ℃/s的速率升至95 ℃维持15 s,60 ℃ 15 s。程序设置:instrument type:QuantStudioTM6 Flex System;block:Fast 96-Well (0.1 mL);experiment type: High Resolution Melt;reagents:MeltDoctorTMHRM Ragents;properties:Standard。
1.2.5 多重HRM-real time PCR反应体系的建立
在单重HRM-real time PCR反应体系建立的基础上,在同一反应管中,加入3对相应的目标菌的特异性引物对各0.1 μL,其他成分和PCR反应程序与单重HRM-real time PCR反应一致,如1.2.4所示。
1.2.6 多重HRM-real time PCR反应特异性
在多重HRM-real time PCR反应体系建立的基础上,以目标菌和非目标菌株的基因组DNA为模板进行多重HRM-real time PCR反应,检验所建立体系的特异性。选取大肠杆菌、志贺氏菌、副溶血弧菌、霍乱弧菌、结肠弯曲杆菌为非目标菌株,以肠炎沙门氏菌、空肠弯曲菌、单增李斯特菌和金黄色葡萄球菌标准菌株为阳性对照,去离子水为阴性对照,进行特异性检验。
1.2.7 多重HRM-real time PCR反应灵敏度
选取S. EntericaCMCC50041、L. monocytogenesATCC19115、S. aureusATCC12598和C. jejuniATCC33560四种菌株作为HRM-real time PCR反应体系敏感性试验的模板DNA来源。将四种菌株分别接种于营养肉汤液体培养基中,37 ℃ 180 r/min振荡过夜培养。使用国标法测定菌液浓度,取菌液浓度为108拷贝数/mL的菌液,用生理盐水按十倍梯度递增稀释,制备浓度分别为108拷贝数/mL~103拷贝数/mL 8个浓度梯度的菌悬液。每个稀释度分别取1.5 mL依照DNA提取试剂盒说明书提取DNA。
1.2.7.1 多重HRM-real time PCR反应体系检测单一致病菌菌液的灵敏度
分别将四种目标检测菌108拷贝数/mL~103拷贝数/mL浓度菌液的基因组DNA作为检测模板,进行多重HRM-real time PCR反应,从而验证该多重体系对单一目标菌的检测灵敏度。每个浓度制备至少3个重复样本,只有所有3个重复样本都被检测为阳性的时候该样本才能被判定为阳性。
1.2.7.2 多重HRM-real time PCR反应体系检测多种致病菌菌液的灵敏度
将108拷贝数/mL~103拷贝数/mL的四种目标菌菌悬液中同浓度的混合,进行细菌DNA的提取,制备肠炎沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌四联DNA模板,进行多重HRM-real time PCR反应。每个浓度制备至少3个重复样本,只有所有3个重复样本都被检测为阳性的时候该样本才能被判定为阳性。
1.2.8 多重HRM-real time PCR反应重复性
对多重HRM-real time PCR反应体系的稳定性考察包括试验间稳定性和试验内稳定性。以敏感性试验中的S. EntericaCMCC50041,L. monocytogenesATCC19115、S. aureusATCC12598和C. JejuniATCC33560基因组DNA为检测样本,选取108拷贝数/mL~103拷贝数/mL 6个10*浓度梯度,每个浓度一式三份。同一样本在同一试验中扩增3次,用以评估该体系的批内重复性,同一样本分开3次不同时间进行3次试验,以评估该体系的批间重复性。收集并计算每个稀释度下检测得到目标扩增产物Tm值得平均值、标准差(SD)和变异系数(CV值=standard deviation)。
1.2.9 人工染菌样本的应用
分别取 37 ℃过夜培养的S. EntericaCMCC50041,L. monocytogenesATCC19115、S. aureusATCC12598和C. jejuniATCC33560菌悬液各1 mL,用生理盐水按10-1~10-6梯度进行10倍稀释,制备浓度梯度菌悬液。然后将每个浓度的四种菌悬液各1 mL,同时接种到25 g鸡肉样本中,设置5 CFU/25 g、10 CFU/25 g和20 CFU/25 g鸡肉样本三种接种浓度。接种后的样本置于20 ℃存放1 h后,加入200 mL SSL,均质10 s[21]。所有样本经37 ℃过夜培养后,样本1000 g离心5 min,并用滤袋(Tekmar,Cincinnati,ohio)过滤除去粗糙的食物残渣后,用试剂盒提取菌体DNA,多重HRM-real time PCR体系进行检测。
2 结果与分析
2.1 单重HRM-real time PCR反应建立
单重PCR反应分别扩增出了4种致病菌对应的4条特异性高分辨率熔解曲线和熔点峰,具有典型的扩增曲线,CT值在16.2~19.0之间,RSD值在0.28%~0.94%之间。如图1所示,所对应的沙门氏菌fimY基因的实际Tm值为82.2±0.019 ℃,单增李斯特菌hly基因的实际Tm值为78.2±0.022 ℃,金黄色葡萄球菌nuc基因的实际Tm值75.5±0.036 ℃,空肠弯曲菌orfC基因的实际Tm值为73.5±0.052 ℃。四种食源性致病菌Tm值之间均相互错开,为多重HRM-real time PCR反应体系的建立奠定基础。与Hoseinpour[22]等建立的检测空肠弯曲杆菌的的Tm值为76.72±0.164 ℃相比,误差更小。

图1 四种菌单重HRM-real time PCR熔解曲线图Fig.1 Four melt curve of HRM-real time PCR
2.2 多重HRM-real time PCR反应建立
通过单重HRM-real time PCR反应可知,4种目标致病菌在退火温度为60 ℃和熔解速率0.025 ℃/s时均能够获得良好的扩增结果,故选60 ℃和熔解速率0.025 ℃/s作为多重反应程序的退火温度和熔解速率。但若直接将单重体系中的模板及引物对简单的混合进行多重HRM-real time PCR反应,则扩增效果不是很理想,熔解曲线峰不明显,因此需要对多重反应体系组分进行分组实验并初步优化。经对不同模板浓度(1.0×108拷贝数/mL、1.0×109拷贝数/mL)和引物浓度(10 μmol/L、5 μmol/L)的选择,按照低浓度优先原则,建立了可扩增出4个不同Tm值高分辨熔解曲线峰的多重HRM-real time PCR反应体系,熔解曲线如图2所示。
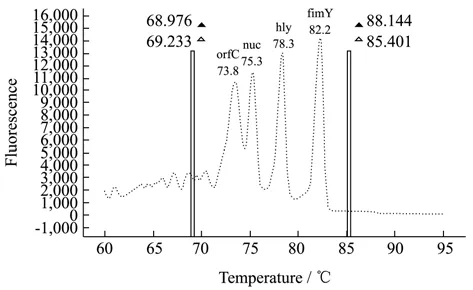
图2 多重HRM-real time PCR熔解曲线图Fig.2 Melt curve of multiplex HRM-real time PCR
2.3 多重HRM-real time PCR反应特异性
多重PCR反应体系特异性检验结果表明,所有目标菌均出现阳性扩增,而其他非目标菌株,均未出现扩增。表明多重PCR反应体系具有良好的特异性。
2.4 多重HRM-real time PCR反应灵敏度
多重HRM-real time PCR反应灵敏度结果见表2。表2表明,随着稀释梯度的不断增加,即菌浓度的不断减少,其对应Ct值增大,各食源性致病菌Tm值保持稳定,直至稀释至102拷贝数/mL时达到检出限,其平均Ct值为16.2~30.8之间,标准差在0.05~0.58之间。结合平板计数结果显示,沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌的检测灵敏度分别为102拷贝数/mL,结果表明上述多重HRM-real time PCR体系对上述4种单一食源性致病菌的检测均具有良好的灵敏度。

表2 多重HRM-real time PCR反应检测单一致病菌的灵敏度Table 2 Sensitivity of multiplex HRM-real time PCR in simple bacterium
表3 是反应体系同时检测四种食源性致病菌结果,随着稀释梯度的不断增加,即菌浓度的不断减少,其Ct值对应增大,4种食源性致病菌Tm值保持稳定且都能检出,直至稀释至102拷贝数/mL时达到检出限,其平均Ct值为14.4~30.3之间,标准差为0.17~0.96之间。对比两个结果,发现Ct值无显著差异,表明多种菌混合并不会降低HRM-realtime PCR反应的灵敏度,反应体系稳定性良好。对比类似体系,该多重检测体系达到的灵敏度高于Forghani[23]等运用该方法所建立的检测蜡样芽孢杆菌、李斯特菌(3.7×103CFU/mL),周千渝[24]等利用基质辅助激光解吸电离飞行时间质谱快速检测并鉴定从鲜食蔬菜中分离到的5种食源性致病菌(106~109CFU/mL),杨梦婕[25]等利用GeXP多重聚合酶链式反应法检测沙门菌、大肠埃希菌0157:H7、单核细胞增生李斯特菌、志贺菌和副溶血性弧菌(103CFU/mL)和杨国兴[26]等利用多重PCR快速检测肉制品中金黄色葡萄球菌和沙门氏菌(103CFU/mL);与鞠鹤鹏[27]等利用结合环介导等温扩增和微流控芯片技术检测沙门氏菌、大肠杆菌O157、金黄色葡萄球菌三种食源性致病菌灵敏度接近(100 CFU/mL)。
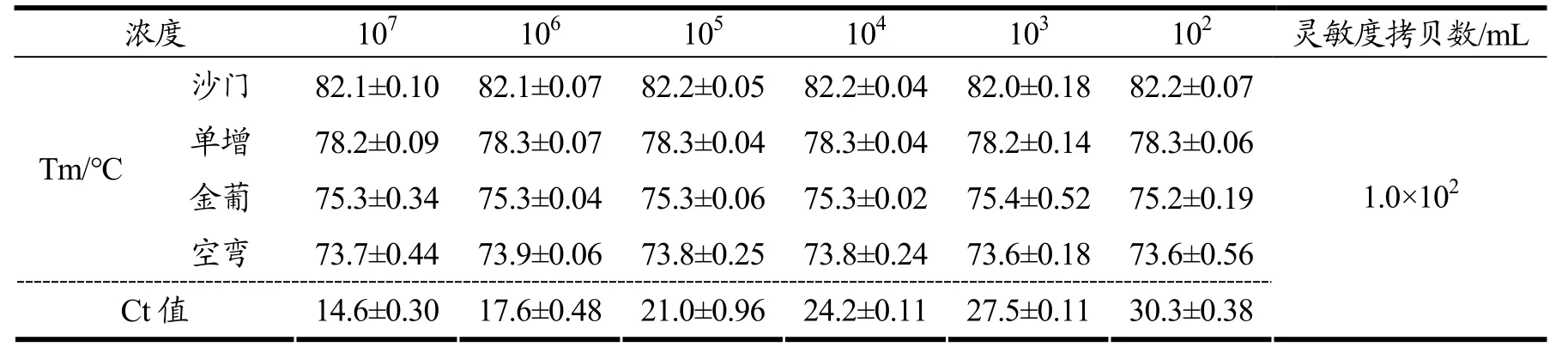
表3 多重HRM-real time PCR反应检测多种致病菌的灵敏度Table 3 Sensitivity of multiplex HRM-real time PCR in four bacterium
2.5 多重HRM-real time PCR反应重复性
多重HRM-real time PCR反应重复性结果见表4。108拷贝数/mL~103拷贝数/mL 6个稀释浓度的Tm值表明,多重HRM-real time PCR反应体系具有高度的重复性。Tm值的试验内CV值为:沙门氏菌0.03%~0.12%,单增李斯特菌0.03%~0.12%,金黄色葡萄球菌0.06%~0.32%,空肠弯曲菌0.03%~0.21%;试验间CV值为:沙门氏菌0.55%~1.12%,单增李斯特菌0.53%~2.12%,金黄色葡萄球菌0.45%~2.02%,空肠弯曲菌0.66%~2.01%。组内和组间Tm值的CV值均较低,提示该体系具有较高的重复性。
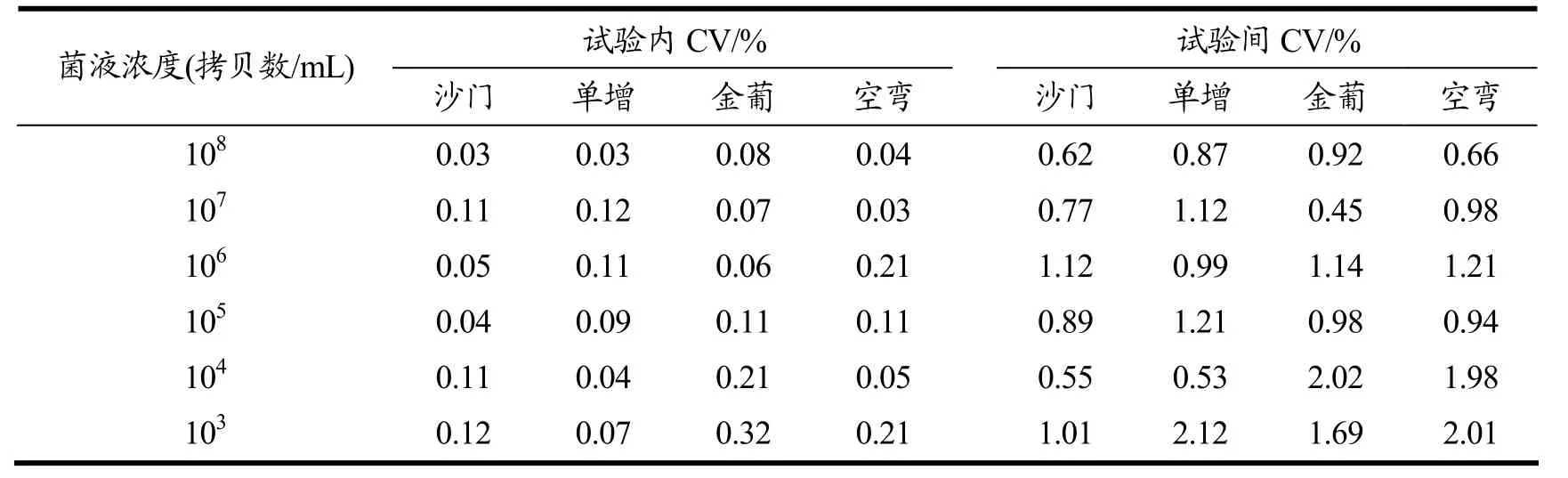
表4 多重HRM-real time PCR体系的重复性Table 4 Reproducibility of multiplex HRM-real time PCR
2.6 人工染菌样本的检测
阳性对照中沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌Tm值分别为82.20 ℃、78.24℃、75.45 ℃和73.45 ℃。实验表明,在Tm值上,5 CFU/25 g、10 CFU/25 g和20 CFU/25 g三种感染浓度下,10份鸡肉样本中四种目标菌的目标扩增产物Tm值与直接从目标菌株菌液中提取出来的的Tm值对比,无显著差异。在灵敏度上,感染样本在进行37 ℃24 h的增菌后,对沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌,多重HRM-real time PCR法均能达到5 CFU/25 g的检测限,结果见表5。在人工染菌样品的检出限高于Germini A[28]等利用多重PCR检测全蛋中大鼠伤寒沙门氏菌、单增李斯特菌和大肠杆菌O157:H7的检出限(10 CFU/25 g)。

表5 多重HRM-real time PCR体系对人工感染样本敏感度Table 5 Tm value of artificaially-inoculated samples in multiplex HRM-real time PCR
3 结论
综上所述,相较于胡双芳[29]等所建立的食源性致病菌检测方法,本研究所构建的实时荧光定量PCR结合高分辨熔解曲线方法能在一个体系中同时检测沙门氏菌、单增李斯特菌、金黄色葡萄球菌和空肠弯曲菌,具有操作简单、快速、特异性强等优点,为食品中多种致病菌污染的快速检测提供了新的手段,有望发展为快速同时检测食品中多种致病菌污染的有效手段。

