食源性单增李斯特菌检测技术研究进展
刘慧,曾祥权,谢文东,蒋世卫,杜洪淼,周玉春,黄华
(1.北京市产品质量监督检验院,北京 101300)(2.中国农业大学食品科学与营养工程学院,北京 100083)
李斯特菌属革兰氏阳性短杆菌,兼性厌氧、无芽孢、一般不形成荚膜[1]。迄今为止,已经分离并鉴定出17种李斯特菌菌株,代表菌株有单增李斯特菌(L.monocytogenes)、绵羊李斯特菌(L. iuanuii)、西尔李斯特菌(L. seeligeri)、英诺克李斯特菌(L.innocua)、威尔斯李斯特菌(L. welshimeri)、格氏李斯特菌(L.grayi)等[2],其中单增李斯特菌可直接引起人类李斯特菌病[3]。单增李斯特菌作为一种重要的食源性致病菌,广泛存在于新鲜果蔬、乳制品、肉制品、水产品、冷冻冷藏食品及即食食品等各种食品中[4],并在低温、酸性、厌氧、高盐等不利的生存环境下仍能生长,还可以在食物接触表面(如不锈钢)进行扩散,并在生物膜的保护下,耐受高浓度的消毒剂和抗菌剂[5,6]。值得注意的是,食品中单增李斯特菌的污染可能发生在生产、加工、包装或分销等任何一个环节。
国内外关于单增李斯特菌引起的食物中毒事件频频发生[7-9]。李斯特菌病的高危人群是孕妇、婴幼儿、老年人及免疫功能障碍者[10],其有非侵入性和侵入性两种临床表现。非侵入性临床表现为较轻的食物中毒症状,如发烧、头痛和腹泻,医学上称之为发热性肠胃炎;而侵入性疾病包括脑膜炎、脑炎、败血症及围产期感染,可诱发早产、流产、甚至死产[11]。尽管与其他常见的食源性疾病如沙门氏菌病或大肠杆菌感染疾病相比,李斯特菌病的发生率较低,但其致死率高达20%~30%[12-14],这意味着巨大的医疗负担和公共卫生威胁。另外,99%的李斯特菌病例是由于食用了被单增李斯特菌污染的食品所致[15]。特别是近年来随着消费者生活习惯和方式的改变,即食食品的消费量逐年增加。由于其无需清洗或烹调处理即可直接食用的特点,更易被微生物污染,同时也加大了公众对单增李斯特菌的暴露风险[16]。
鉴于单增李斯特菌对经济和公共安全的严重危害,很多国家和组织对单增李斯特菌污染问题日益关注和重视,并对食品中的单增李斯特菌的限量进行了严格规定。欧盟委员会2073/2005号法规(欧洲委员会,2005)[17]规定婴幼儿即食食品与特殊医疗用途的即食食品,在其产品保质期内对单增李斯特菌实施“零容忍”政策,即25 g内不得检出(0/25 g);对于其他类的无法支持单增李斯特菌生长的即食食品,在其产品保质期内单增李斯特菌的限量为100 CFU/g;对于其他类的可以支持单增李斯特菌生长的即食食品,单增李斯特菌的限量标准要根据食物链水平确定。在美国,食品药品监督管理局规定对于不支持单增李斯特菌生长的即食食品,单增李斯特菌含量应小于100 CFU/g[18]。在我国,食品安全国家标准规定食品(预包装食品,不包括罐头类食品)中不得检出单增李斯特菌[19]。
目前,我国对单增李斯特菌的检测仍以传统的分离培养和生化鉴定方法为主,该方法需要对样品进行增菌,并通过选择性培养基进行筛选,操作复杂繁琐,检测周期长且灵敏度不高。因此,迫切需要探索更加快速、便捷、准确、安全的检测技术,这对实现在整个食物链中单增李斯特菌的实时监控,及时有效预防单增李斯特菌诱发的食源性疾病及维护公共健康卫生,减少经济损失具有重要的现实意义。目前已经开发使用的单增李斯特菌快速检测方法主要有基于抗原/抗体特异性结合的免疫分析法、基于分子生物学的核酸分析法、新型生物传感器法及基于蛋白质检测的基质辅助激光解析电离飞行时间质谱法(Matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)等[15,20-23],这些快速检测技术能够大大提高单增李斯特菌的检测效率和灵敏度。本文就传统培养方法及新兴快速检测在单增李斯特菌中的应用进行了系统阐述,并对其优缺点进行了讨论分析,以期为相关工作者针对单增李斯特菌的快速检测提供参考依据。
1 传统检测方法
平板培养法是用于单增李斯特菌检测的传统方法,检出限通常为1~5 CFU/25 g样品[24]。由于单增李斯特菌易受加热、冷冻、冷冻干燥、盐、防腐剂及其他化学添加剂或天然抑菌化合物等因素的伤害而处于亚致死状态,导致其很难被传统检测方法检出[25]。此外,即便是单增李斯特菌活菌,也可通过进入休眠状态以应对各种环境压力,休眠状态下的活菌细胞仍具有存活能力,但其在标准培养基上不可培养(viable but non-culturable,VBCN)[26]。鉴于单增李斯特菌具有亚致死损伤和VBCN状态,针对其检测的培养方法通常包括两步富集过程。采用非选择性或半选择性培养基进行的预富集步骤可以使受伤的目标生物体复苏并增殖,同时该步骤还可稀释抑菌物质并对来自干燥或加工食品基质中的细菌细胞进行水化作用[27];采用选择性培养基(如含不同盐类和抗生素)进行的富集步骤可抑制背景菌群生长,并对目标病原体进行选择性增殖,增殖倍数可达百万倍以便于其分离检测[24]。通过对分离菌落进行染色镜检、动力试验、生化鉴定、血清学试验等可得出定性检测结果。目前我国常用的方法主要是国标法(GB 4789.30-2010),其采用的平板培养法灵敏度高,成本低,可给出定性和定量结果,但操作步骤多,过程较复杂,从培养得到可疑菌落到检测得出确定结果,整个周期需要5~14 d[28]。传统的培养基培养病原体的方法被认为是金标准方法,可靠、准确,但耗时较长,不适用于紧急状态下的快速检测。近年来,不断有研究对标准培养法进行改进,如在选择性培养基中使用荧光或显色底物,可避免传代培养和生化鉴定,使得分析更加快捷便利[29,30]。
2 免疫测定方法
免疫学测定方法以病原微生物作为免疫原,制备相应的特异性抗体,通过抗原抗体的特异性结合进行测定。一个单克隆抗体可以识别一个特定抗原,而一个多克隆抗体可以识别一个或多个抗原。针对单增李斯特菌的免疫测定方法的检测限(约103~107CFU/mL)受抗体和免疫试验类型的影响。为了达到设定的检测限标准,免疫测定时通常需要对样品进行富集。在食品诊断中应用最广泛的免疫学方法有酶联免疫吸附法(Enzyme-linked immune-sorbent assay,ELISA)、酶联荧光分析法(Enzyme-linked fluorescent,ELFA)、侧向免疫层析法(Lateral flow immunoassay,LFI)和免疫磁性分离法(Immuno-magnetic separation,IMS)等。
2.1 酶联免疫吸附法(ELISA)
在ELISA中,预先将抗原或抗体结合到固相载体表面上,然后与待测样品中的抗体或抗原分子发生特异性结合,得到的免疫复合物所携带的酶可与特定底物相反应发生颜色变化。与传统培养方法相比,ELISA方法检测时间短,大约30~50 h即可得出结果。但是,只有当病原体的数量足够多时,免疫检测才能提供有效的信息。因此,ELISA方法检测灵敏度较低,大约在105~106CFU/mL之间,且抗体对病原体的亲和力低,易受污染物等因素的干扰。免疫分析可以多种形式进行,通常采用的是夹心“三明治”反应类型,从而进一步减少分析时间、试剂和样品量[31-33]。Magliulo等[34]人开发了一种可同时检测包括单增李斯特菌在内的多种病原菌的夹心ELISA方法,在该测定中靶标病原菌的特异单克隆抗体被固定在96孔微量滴定板中,一旦待测样品中的抗原抗体发生特异性结合,就添加辣根过氧化物酶标记的多克隆抗体,并通过测定鲁米诺底物的化学发光来测量酶活。该方法对所有靶标病原菌的定量限在104~105CFU/mL之间,测定前样品需要进行富集。Portanti等[35]采用ELISA方法测定了包括肉品、海产品和乳制品在内的220个污染样品中的单增李斯特菌,该方法得到ISO标准方法的验证,加标样品的检测限为6.6×103CFU/mL,相对检测限为5~10 CFU/g。夹心ELISA法操作简单,特异性强,反应灵敏度高。然而,制备单克隆抗体的成本较高,使得采用ELISA试剂盒测试各种食物样品的成本相对较高。
2.2 酶联免疫荧光分析法(ELFA)
ELFA是将荧光物标记到抗体上,单增李斯特菌抗原和单克隆抗体发生特异性结合后,通过测定荧光强度检测单增李斯特菌的数量,大大提高了检测的灵敏度。Ueda等[36]使用一种基于ELFA原理的商品化检测方法(VIDAS®LMO2)以测定食品样品中的单增李斯特菌,该方法在弱酸性食物样品中的检测限为105CFU/mL,在酸奶和果汁等酸性食物样品中的检测限为106CFU/mL,且有效缩短了检测时间,大约70 min即可获得结果。ELFA中无显色反应,检测时间短,且灵敏度高于ELISA;但缺点是成本较高,目前主要应用于自动ELFA系统(VIDAS)。
2.3 侧向免疫层析法(LFI)
侧向免疫层析(LFI)是在免疫渗透技术基础上建立的固相标记分析技术,结合了免疫技术和色谱层析技术的优点。LFI的物化形式是免疫层析试纸条,核心部分由样品垫、结合垫、反应垫、支撑垫和吸水垫五部分组成(如图1所示)。在毛细管作用下,抗原与抗体在硝酸纤维素膜等固相载体上发生结合反应,利用标记材料的显色作用或荧光效应,可通过肉眼直接观察检测条带或在荧光激发状态下测量荧光强度得到定性定量分析结果[37]。目前有胶体金、荧光素、量子点等多种标记材料。该方法灵敏度高、对操作人员要求低,并且不需要昂贵的仪器设备,易于实现现场检测,主要作为定性或半定量筛选手段。Cho等[38]基于单克隆单增李斯特菌抗体LZF7和LZH1开发的LFI方法与磁处理联合使用以检测人工接种牛奶中的单增李斯特菌,检测可在2 h内完成,检测限低至102CFU/mL。Blažkova等[39]利用LFI方法检测经聚合酶链式反应(PCR)得到的扩增样品中的单增李斯特菌基因,将PCR产物加入LFI检测设备中,特异性扩增子的存在会显示为一条暗线,检测时间为28 h(包括24 h的富集时间),检测结果为<10个细胞/25 mL样品;Kovacevic等[40]将LFI方法应用于肉类生产加工不同阶段的环境样品中单增李斯特菌的检测,研究结果表明,与传统培养方法和PCR测定相比,LFI同样具有特异性,且大批量检测样品时(>300个)依然具有较高的灵敏度。
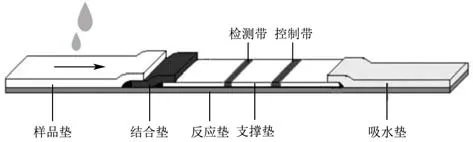
图1 侧向层析试纸条示意图Fig.1 Schematic diagram of lateral flow test strip
2.4 免疫磁性分离法(IMS)
免疫磁性分离法又称为免疫磁珠(immunomagnetic beads,IMB)分离技术,该技术是对具有超顺磁性的微粒表面进行化学修饰,使之可与特异性抗体发生结合,成为能够捕获特异性抗原的磁珠。将免疫磁珠与待测溶液混合,若有靶标抗原存在,即被免疫磁珠捕获,形成抗原-免疫磁珠复合物,并在适当的磁场条件下发生分离,从而达到富集靶标抗原的目的[41],如图2[46]所示。该技术特异性强,灵敏度高,分离富集速度快,适用范围广。在实际应用中,该方法通常与ELISA技术、PCR技术、荧光信号技术等联合使用以改进和增强方法的灵敏度。Yang等[42]采用单增李斯特菌单克隆抗体、免疫磁珠分离技术,结合实时荧光PCR检测方法,建立乳品中单增李斯特菌的纳米免疫磁分离-实时荧光PCR快速检测方法,该方法的检测限为>102CFU/0.5 mL。Wang等[43]将纳米免疫磁分离技术与量子点荧光分析相结合,可实现2 h内同时靶向检测食物样品中的单增李斯特菌、大肠杆菌和鼠伤寒沙门氏菌,该方法在碎牛肉、鸡肉、西蓝花和生菜样品中的检测限为20~50 CFU/mL。Walcher等[44]将顺磁珠表面涂上重组单增李斯特菌噬菌体内溶素产生的细胞壁结合域蛋白(cell wall-binding domain proteins,CBD),形成的CBD磁珠用于原奶中单增李斯特菌的检测,该方法的灵敏度为102~103CFU/mL。Amagliani等[45]人开发了一种更为灵敏的多重磁珠捕获杂交-三重实时荧光PCR技术,可同时检测海产品中的单增李斯特菌和沙门氏菌,该方法的检测限为1 CFU/g。
3 分子生物学检测方法
3.1 常规PCR
PCR技术通过对单增李斯特菌的特异性目标基因设计相应的引物并用于扩增这一段基因,从而获得大量待测基因以确证为单增李斯特菌。常见的目标基因有hly,inlA,inlB、iap、16S和23S rRNA以及编码入侵相关蛋白p60、氨肽酶C、磷脂酶C蛋白、纤连蛋白结合蛋白和dth-18延迟型超敏蛋白的基因[47,48]。PCR技术特异性强、稳定性高、重现性好且操作简便,被广泛应用于食品中单增李斯特菌的检测。常规的定性或半定量PCR依赖于扩增产物的终点分析(电泳或荧光)。Amagliani等[49]采用商品化DNA提取试剂盒与常规PCR技术对人工接种并富集24 h后的猪肉香肠和马苏里拉奶酪中的单增李斯特菌进行检测,方法灵敏度可达1 CFU/g。Delibato等[50]将PCR技术与微流控芯片电泳系统结合对即食肉制品、奶酪、烟熏三文鱼等食物样品中的单增李斯特菌检测,该方法与ISO标准方法检出结果一致。但是,PCR技术无法区分DNA是来自死细胞还是活细胞,往往会出现假阳性结果[51]。为了避免死菌DNA造成的假阳性结果,可将叠氮溴乙锭(EMA)和叠氮溴化丙啶(PMA)与PCR联合使用[52]。PMA和EMA不能穿透活菌,但很容易进入细胞膜受损的死菌细胞并与其DNA分子结合,导致DNA分子无法进行PCR扩增,从而可用PCR技术将死活菌区分开。还可使用逆转录PCR技术,与DNA相比,mRNA的半衰期更短,在细胞死亡之后降解更快,因此可以作为有用的目标分子以检测样本中存在的活细胞[53]。然而,当选择毒力因子mRNAs作为目标分子时,必须认识到这些mRNAs有时只在特定环境条件下表达。而且,在不受DNA干扰情况下提取mRNA是一个繁琐的过程[54]。近年来,还有研究开发出过滤技术,能够从活细胞中快速清除死亡和受损细胞[55]。此外,单增李斯特菌是一种低细胞数量细菌[20],有研究发现浓缩肉汤中英诺克李斯特菌(L.innocua)的数量远远超过单增李斯特菌[48],从而导致单增李斯特菌很难被检出,出现假阴性结果。目标DNA的缺失或浓缩食品中酚类物质、核酸酶等抑制剂的存在,也会造成假阴性结果。因此,许多研究将内参(Internal control,IAC)DNA片段添加到反应管中与目标DNA同时扩增以检测PCR抑制剂是否存在,辨别假阴性。Rip等[56]以hly基因为靶标基因,并对内参基因IAC进行优化,建立的PCR方法用于检测人工接种并富集22 h的卡门培尔奶酪和鸵鸟肉样品中的单增李斯特菌。
3.2 多重PCR(Multiplex PCR,mPCR)
多重PCR检测是在一个反应系统中加入多组引物,同时扩增多个核酸片段的PCR反应。操作过程与反应试剂与常规PCR相同,特异性增强,可同时检测不同食源性病原体,能够实现高通量检测[57]。Chen等[21]通过比较基因组学方法筛选出50个ST121菌株的候选基因,从中选择靶标基因设计该菌株特异性引物,并以prfA基因设计单增李斯特菌的特异性引物,基于此开发建立了一种用于鉴定单增李斯特菌ST121菌株的多重PCR方法。该方法快速准确、特异性强,检测限为253 fg/μL基因组,将其用于人工接种牛奶(富集4~12 h)中ST121菌株的检测,灵敏度达到2.5~2.5×104。Zhang等[58]采用基于微芯片电泳结合激光诱导荧光的多重PCR技术用于测定单增李斯特菌、大肠杆菌和沙门氏菌,该方法分析时间短,试剂用量少,选择性强,灵敏度高。在最佳实验条件下,可在135 s内分离出三种致病菌的PCR产物,其中单增李斯特菌的检测限为1.8 ng/μL;将该方法用于人工接种牛奶中三种致病菌的检测,单增李斯特菌的灵敏度为68 CFU/mL。Rawool等[59]开发了一种新颖的多重PCR方法用以鉴定李斯特菌属,并区分单增李斯特菌及其主要谱系(LI,LII,LIII),该方法快速、廉价,可用于筛选和鉴定单增李斯特菌的亚型分型。然而,与常规PCR使用单个引物相比,多重PCR引物之间易发生相互干扰,导致扩增效率降低[60]。
3.3 实时荧光定量PCR(Quantitative Real-time PCR,qPCR)
实时荧光定量PCR是在反应体系中加入特定荧光物质,对扩增产物进行标记跟踪和实时监测。荧光强度的变化取决于累积的PCR产物的量,通过监测其变化可绘制标准曲线来测量实时PCR反应进程并进行定量分析[61]。反应体系中加入的荧光分子可以使标记有荧光染料以及猝灭剂的特异性探针,如TaqMan探针、分子信标、蝎子引物、双杂交探针及复合探针等,也可以是非特异性DNA结合染料,如SYBR Green I。与常规PCR相比,荧光定量PCR的特异性较强,灵敏度较高,操作简便,且具有可定量的优势[62]。Jin等[63]根据李斯特菌的ssrA基因设计引物和探针,通过使用实时PCR和高分辨熔融曲线分析鉴定食物样品中包括单增李斯特菌在内的6种李斯特菌,其中单增李斯特菌的检测灵敏度为102CFU/mL。Schoder等[64]分别采用实时荧光定量PCR和ISO标准方法对76种食物样品中的单增李斯特菌进行检测,结果表明,相较于ISO标准方法,实时定量PCR方法的准确性更高(96%),特异性更强(100%),灵敏度更高(76.9%)。Wei等[65]将免疫磁性分离(IMS)技术与实时荧光定量PCR结合建立了豆芽样品中单增李斯特菌的快速检测方法,该方法的扩增效率为96.7%,检测时间短(27 h),特异性强为(100%),灵敏度(95%)和准确性(95.6%)均较高,检测限低至4.4 CFU/g。
3.4 环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)
环介导等温扩增的特征是针对目标DNA链上的6个特异性区域设计4个不同的引物,然后再利用链置换型DNA聚合酶在等温条件(60~65 ℃)下进行扩增,整个反应持续1 h,最后通过肉眼观察白色浑浊对检测结果进行判断[66]。与常规PCR相比,LAMP不需要模板的热变性、温度循环、电泳及紫外观察等步骤,扩增效率极高,可在15~60 min内实现109~1010倍的扩增,具有快速、简单、特异性强、灵敏度高等优点[67,68]。该技术不需要专门的PCR仪器即可实现现场高通量快速检测,其检测成本远远低于实时荧光定量PCR。Wan等[69]根据hlyA基因设计6条引物,建立了改良单叠氮丙啶-LAMP方法用于检测人工接种食品样品中的单增李斯特菌,该方法在纯培养物和食品样品中的检测限分别为102~3.1×103CFU/g。Mikš-Krajnik等[70]基于商品化生物发光方法(3MTM分子检测系统,MDA)开发了一种新颖的LAMP方法用于检测不锈钢和聚乙烯表面上的三种单增李斯特菌菌株,该方法的检测限为100~102/100 cm2,特异性和灵敏度均为100%。Feng等[68]将磁分离适配体捕获与LAMP方法结合对17种食物样品中的单增李斯特菌进行分析检测,该方法不需要预先培养富集,总测定时间约为3 h,检测限低至5 CFU/mL,准确性为100%。
3.5 重组酶聚合酶扩增技术(Recombinase polymerase amplification,RPA)
重组酶聚合酶扩增(RPA)是由特定的酶和蛋白组合(重组酶、单链结合蛋白和DNA聚合酶)参与,在恒定温度下反应5~20 min即可实现微量核酸指数扩增的新技术[71]。RPA与常规PCR扩增技术一样具有特异性强、灵敏度高等特点,但反应速度更快且不需要热变性,因此不需要昂贵的热循环设备。与其他等温扩增技术相比,RPA技术所需温度更低(37~42℃),能在广泛环境温度下工作,更适合于现场检测。目前,已有RPA应用于单增李斯特菌检测的报道。如Du等[72]将RPA与免疫层析试纸条(lateral flow strip,LF)相结合建立了一种单增李斯特菌快速检测方法(RPA-LF),等温扩增与产物检测步骤可以在15 min内完成,且具有较高的灵敏度和特异性,在纯培养条件下检测限低至1.5×101CFU/mL。Wang等[73]采用同样的策略建立了一种改进的RPA-LF方法用以检测不同食品样品中的单增李斯特菌,改进后的方法灵敏度更低(10 CFU/25 g样品),并可有效消除引物二聚体的假阳性信号。
3.6 DNA微阵列(DNA microarray)
DNA微阵列又称为基因芯片技术,主要是将多个寡聚核苷酸序列作为探针,有序地排列在硅胶板或其他固体物质上,与待测样品的标记基因进行杂交,接着通过荧光的激光共聚检测器对芯片进行扫描,分析荧光信号得到检测结果[74]。一个基因芯片上可以含有成千上万个探针,一次同时检测出多种致病菌。因此,DNA微阵列技术大大提高了检测工作的效率,可实现食源性致病菌的高通量分析,已成功应用于多种食源性致病菌的检测与基因分型。Volokhov等[75]将DNA微阵列技术与多重PCR扩增相结合,开发出可用于包括单增李斯特菌在内的6种李斯特菌同时检出的芯片制作及检测方法。Bang等[76]从单增李斯特菌菌株ATCC19111的基因组中随机选出60个不同大小的DNA片段并将其固定在胺涂层玻璃载玻片上制作出探针用以对单增李斯特菌进行鉴定区分,将该探针与从单增李斯特菌菌株中提取的DNA基因组杂交,发现16珠单增李斯特菌的杂交信号为98%~100%,将该DNA芯片用于人工接种牛奶中单增李斯特菌的检测,检测限约为8 logCFU/mL。目前,在DNA微阵列检测过程中,尚缺乏简便有效的方法以获得足够量的荧光标记DNA与探针进行杂交,并获得显著的特异性阳性结果。
3.7 荧光原位杂交(Fluorescent in situ hybridization,FISH)
FISH是将荧光素直接或间接标记的核酸探针与待测样品中的核酸序列按照碱基互补配对原则进行杂交,经洗涤后直接在荧光显微镜下观察。Rohda等[77]对近年来应用于食品中单增李斯特菌检测的FISH方法进行了综述。Fuchizawa等[78]将过滤培养和FISH技术相结合,以李斯特菌的23S rRNA与单增李斯特菌的16S rRNA为探针,对人工接种的烟熏鲑鱼、奶酪、火腿、卷心菜等食物样品中的李斯特菌和单增李斯特菌进行检测,该方法与传统的平板菌落计数法相比,检测时间缩短(12~16 h),灵敏度可达到102~103CFU/mL。Moreno等[79]分别采用标准培养方法、常规PCR方法以及基于直接活菌计数(Direct Viable Count,DVC)的FISH方法对191份新鲜蔬菜和冷冻蔬菜样品中的李斯特菌和单增李斯特菌进行检测,研究结果表明,标准培养、PCR和DVC-FISH检测系统分别检出4%、10%、33%的样品呈阳性,而DVC-FISH相较于其他两种方法,检测时间更短,灵敏度更高,即培养7 h后,可检出活菌细胞7.4×102~7.4×102CFU/g。
4 生物传感器(Biosensors)
生物传感器是一类能感应生物反应并将该反应经过信号放大转化为可以检测到的光、电等化学信号的分析设备,主要由生物受体(微生物、细胞、酶、核酸、抗原、抗体等)和转换器组成,如图3所示。转换器可以是光学的(拉曼光谱、傅里叶变换红外光谱、表面等离子体共振、光纤)、电化学的(电流、阻抗、电位、电导)、热学的以及基于质量学(压电、磁)的[80]。由于生物传感器在微生物快速检测中表现出的优良性能,目前也有许多研究集中在为单增李斯特菌检测开发各种敏感的生物传感器。基于光学原理的生物传感器是利用光学材料对适配体、抗原或抗体进行修饰,然后通过适配体与病原体或抗原与抗体之间的特异性结合,以光学材料特性的变化反映病原菌浓度的变化[81]。如Chen等[82]结合免疫磁性分离、脲酶催化和pH指示剂开发了一种光学生物传感器可对单增李斯特菌进行快速检测,该方法的检测限低至1.0×102CFU/mL,将其应用于人工接种生菜样品中单增李斯特菌的检测,平均回收率为95.1%。近年来电化学生物传感器因其高灵敏度、高通用性、强便携性等特点受到人们广泛关注。这些传感器依赖于核酸、抗原、抗体、适配体等的生物偶联,将生物信号经电子或电阻传导转化为可检测的化学信号,主要类型有电流型、阻抗型及电导型等[83]。如Radhakrishnan等[84]将单增李斯特菌的单克隆抗体lgG1固定在Au电极上作为单增李斯特菌的检测探针,抗体与单增李斯特菌的特异性结合引起电极表面阻抗的变化,通过免疫传感器的电化学阻抗变化来反映单增李斯特菌的浓度,该方法可特异性地检测未经浓缩的人工接种番茄提取物中的单增李斯特菌,检测灵敏度高度达4 CFU/mL。Niu等[85]利用金纳米粒子(AuNPs)和部分还原氧化石墨烯(p-RGO)修饰电极构建了检测单增李斯特菌的hly基因序列的电化学DNA生物传感器,以亚甲基蓝为电化学指示剂,采用微分脉冲伏安法监测目标DNA的杂交。在最佳条件下,该方法检测的浓度范围为1.0×10-13~1.0×10-6mol/L,检测限为3.17×10-14mol/L。此外,也有基于质量学的压电生物传感器用于食物中单增李斯特菌检测的报道。如Shmarma等[86]采用单增李斯特菌的商品化多克隆抗体,并使用压电悬臂生物传感器代替电化学传感器检测牛奶中的单增李斯特菌,该方法的检测限为103细胞/mL。以上列举的生物传感器方法省时、简便,但有些方法的灵敏度有待进一步改善。
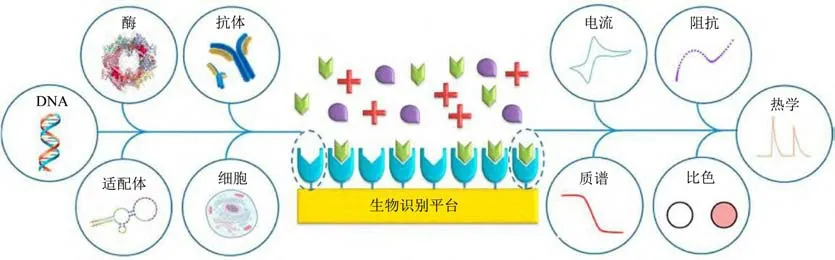
图3 生物传感器基本组件图[81]Fig.3 Basic component of biosensor
5 其他快速检测方法
5.1 飞行时间质谱技术
基质辅助激光解吸电离飞行时间质谱(Matrix-assisted laser desorption/ionization-time of flight-mass spectrometry,MALIDI-TOF-MS)技术具有分析时间短、试验成本低、可实现高通量检测等优势,已广泛应用于食源性病原微生物的鉴定。工作原理是每种病原菌都具有其特征性蛋白质指纹图谱,细菌蛋白与样品基质结合后,通过激光电离提取总蛋白,并经由检测器被捕获,根据不同质荷比(m/z)的蛋白质通过飞行管的时间不同进行分离,最后通过与数据库图谱比对得出定性分析结果,从而实现对病原菌的鉴定和分型[87]。在2008年,Barbuddhe等[88]利用全细胞MALDI-TOF技术,通过获得细菌细胞内核糖体蛋白的特征性指纹图谱,对不同来源和物种水平的李斯特菌进行鉴定。该实验中,首先从纯培养板中提取李斯特菌落,然后采用乙醇、甲酸和乙腈对其进行处理以获得细胞提取物,最后通过MALDI-TOF监测4000~12000 u范围内的核糖体蛋白特征峰。通过观察某些特征峰是否存在,即可在谱系水平分离出单增李斯特菌,该结果得到脉冲凝胶电泳技术的证实。最近,Jadhav等[21]使用MALDI-TOF对不同来源的澳大利亚乳制品中的单增李斯特菌进行鉴定和来源追踪。然而,与其他用于菌株基因分型的方法相比,MALDI-TOF鉴定时更容易受培养基类型、样品制备、样品基质等因素的干扰。
5.2 噬菌体

图5 噬菌体P100修饰的磁性颗粒分离单增李斯特菌[83]Fig.5 Isolation and separation of L. monocytogenes using bacteriophage P100-modified magnetic particles [83]
噬菌体(bacteriophage)是一种特殊的病毒,能够感染并杀死细菌或真菌等微生物。噬菌体受体结合蛋白能够与宿主细胞表面的特异性受体发生结合,这种特性赋予了噬菌体很高的生物技术应用价值。近年来,结合分子生物学、免疫学及其他学科建立起来的新兴噬菌体检测方法特异性强、灵敏度高并可区分死菌和活菌细胞,在食源性病原菌快速检测领域中显示出了巨大的优势[89,90]。Kretzer等[91]利用噬菌体编码的肽聚糖水解酶(内溶素)的细胞壁结合域(CBD)蛋白代替抗体固定在顺磁珠上作为与单增李斯特菌特异性结合的配体用以富集分离目标菌,并将该技术与传统培养方法结合检测人工接种和自然污染食物样品(生菜、奶酪、鲑鱼、肉、奶)中的单增李斯特菌。研究结果表明,样品预浓缩6 h后,该方法对于所有食品基质中单增李斯特菌的检测限为102CFU/g,而预浓缩24 h后,除软奶酪外,其他所有食品基质中单增李斯特菌的检测限均达到0.1 CFU/g,方法灵敏度明显优于标准培养方法。Walcher等[42]同样利用噬菌体CBD蛋白包被的顺磁珠分离富集人工接种原奶中的单增李斯特菌,并利用平板计数法或RT-PCR技术检测,方法检测限范围为102~103CFU/mL。Zhou等[92]利用三种不同大小的磁性颗粒通过化学和物理方法固定化噬菌体P100,建立了一种从复杂食物基质中分离单增李斯特菌的噬菌体辅助磁性分离方法(如图4所示),并通过研究噬菌体的偶联率及捕获单增李斯特菌特异性基因片段的效率对每种噬菌体修饰磁性颗粒复合物的性能进行了评价。研究结果表明,与化学固定化方法相比,采用物理方法固定化的噬菌体修饰磁性颗粒复合物对单增李斯特菌的选择性和捕获效率更强。
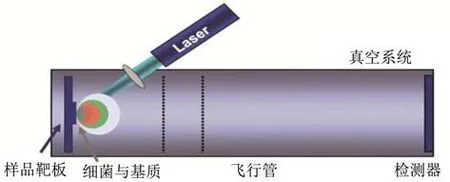
图4 MALDI-TOF-MS微生物检测原理[87]Fig.4 Principle of MALID-TOF-MS in microbiological detection
6 结语
近年来,由单增李斯特菌感染引起的食源性疾病逐年增多,人们对单增李斯特菌检测的关注度越来越高。目前我国对单增李斯特菌的检测有多种,其中多种PCR方法已经形成标准并颁布实施。免疫学测定方法,简单快捷,尤其是免疫层析试纸条携带方便,适合现场快速检测,但免疫测定方法对抗体制备具有较高要求,易受其他杂菌干扰,灵敏度不够高。使用DNA或RNA序列作为靶标的分子测定方法特异性和灵敏度更高,但该方法的预处理较复杂,对操作技术有较高要求,主要用于实验室分析,不适合现场检测。基于免疫学和核酸分析的生物传感器技术由于操作简便、检测周期短、灵敏度高等特点逐渐发展起来,但是必须根据反应信号选择合适的敏感元件,尽量减少干扰并降低背景噪音。MALDI-TOF方法分析时间短,可实现高通量检测,但容易受培养基类型、样品制备、样品基质等因素的干扰。而基于噬菌体的方法则需要与分子生物学、免疫学及其他学科相结合。以上这些技术虽然目前还存在很多不足,但随着科学技术的发展,会得到进一步的改进和完善,特别是近年来不同学科之间的相互渗透日益加强,不同方法之间的结合使用会成为未来食源性单增李斯特菌检测的发展趋势。

