高镁锂比盐湖镁锂分离与锂提取技术研究进展
王琪,赵有璟,,刘洋,王云昊,王敏,项顼
(1北京化工大学化工资源有效利用国家重点实验室,北京100029;2中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海省盐湖资源化学重点实验室,青海西宁810008)
引 言
锂作为元素周期表中的第一个金属元素,是最轻的金属,具有化学性质活泼、比热容大、膨胀系数低等优良特性,广泛应用于电池、玻璃陶瓷、润滑脂、核能等领域,是现阶段新能源汽车产业发展不可或缺的关键原料,被誉为“金属味精”。《全国矿产资源规划(2016—2020)》将锂确立为我国24种战略性矿产之一,欧盟、美国等也将锂矿产列入其关键矿产目录。
全球锂最终用途市场如图1所示[1]。近年来,由于可充电锂电池在便携式电子设备、电动工具、电动汽车和电网储能中的广泛应用,使得锂在电池中的用量大幅增加,其占比从2016年的35%上升至2020年的65%。我国新能源汽车产业发展迅猛,锂离子电池产量逐年增长,预计锂资源的市场需求量将以每年20%的增速快速增加,对我国锂资源的可持续供给带来愈发严峻的挑战[2-3]。

图1 全球锂最终用途市场分布情况[1]Fig.1 Distribution of global end-use markets of lithium[1]
根据美国地质调查局(USGS)2020年数据,世界锂资源量约为8000万吨,锂储量1400万吨[1]。其中大陆卤水含锂量最为丰富,占总储量的59%。中国已探明锂资源量为450万吨,其中超过71%的锂资源蕴藏在盐湖卤水中,并且从卤水生产锂的成本通常比从硬岩源生产成本低30%~50%。我国盐湖锂矿主要集中分布在青藏高原,其中的锂盐矿主要赋存于盐湖地表卤水和晶间卤水中。青海盐湖卤水大多属于硫酸镁亚型和氯化物型,青海柴达木盆地的大柴旦盐湖、东台吉乃尔盐湖、西台吉乃尔盐湖和一里坪盐湖是典型的硫酸盐型高镁锂比盐湖,察尔汗盐湖卤水属于氯化物型,其镁锂比值高达1400以上。我国盐湖卤水具有高镁锂比、高镁含量、低锂含量的特征(表1)。锂和镁在周期表中呈对角线关系,物理、化学性质相近,特别是Mg2+和Li+的半径相近,分别为72和76 pm。高镁锂比盐湖镁锂高效分离是世界性难题[8]。

表1 中国主要高镁锂比盐湖卤水资源组成Table 1 The compositions of high Mg/Liratio salt lakebrines in China
目前全球生产的碳酸锂原料70%来自盐湖卤水,仅30%来自硬岩型锂矿。由于我国大部分盐湖卤水镁锂比值高,提取技术难度大,锂提取率低,我国卤水提锂仅占20%,且盐湖提锂产品多为普通工业级碳酸锂,高端产品加工原料对外依存度高,其中,进口锂辉石加工占比66%,进口高浓度卤水加工占比18%。一旦进口受阻,我国新能源产业、航空航天和核能等相关领域将陷入困境。因此,盐湖镁锂高效分离与锂提取技术是保障我国盐湖锂资源可持续利用的关键,是制约盐湖资源综合、平衡利用的“卡脖子”技术。
本文综述了近年来盐湖卤水提锂的研究进展,重点介绍了高镁锂比盐湖卤水资源的提取方法,目前高镁锂比盐湖卤水镁锂分离与锂提取技术主要有:萃取法、吸附法、膜法、电化学法以及新发展的反应/分离耦合技术。详细介绍了各种方法的特点和适用性,综述了反应机理和应用性能,并提出了今后的发展方向。
1 萃取法
液-液萃取技术具有工艺简单、操作条件易于控制、成本较低、萃取效率和选择性高的优点,被认为是青海盐湖卤水提锂技术中在离子选择性及锂收率上最为突出的一种方法,但是萃取剂的环境问题以及对萃取设备的较高要求,在一定程度上制约了该技术的产业化应用。
萃取法在20世纪60年代得到发展,利用有机溶剂对锂的特殊萃取性能达到提取锂的目的,其关键是寻找合适的萃取剂。最早用于盐湖提锂的萃取剂为醇或酮类。常用于盐湖卤水提锂的醇、酮类萃取剂主要有丙醇、丁醇、苯甲酰三氟丙酮(HBTA)、甲基异丁基酮(MIBK)、环己酮等,其分子结构中都含有羟基或羰基等Li+配位基团[9-10]。
1.1 有机溶剂萃取
Li等[10]提出了采用β-二酮通过逆流方法从碱性盐水中回收锂(图2)。HBTA-TOPO-煤油作为萃取体系,能够有效回收锂。萃取反应如下:

图2 七级逆流萃取流程图[10]Fig.2 Flow chart of seven-stage countercurrent extraction[10]

在七阶段萃取过程混合沉降器中进行30 h达到稳定状态,锂的平均萃取率达到96%,汽提溶液中的锂浓度为15 g/L。β-二酮类萃取剂是将含有的羟基或羰基与Li+结合为较稳定共价键而形成螯合结构[11]。但是,酮类萃取剂具有水溶性、易燃、易挥发等物理性质,其化学性质不稳定,限制其工业化应用[12]。
Ren等[13]模拟含高Mg/Li的盐湖卤水,利用磷酸三丁酯(TBP)、FeCl3和琥珀酸二乙酯分别作为萃取剂、共萃取剂和稀释剂,进行萃取提锂,FeCl3的添加显著提高锂萃取效率。萃取反应为:
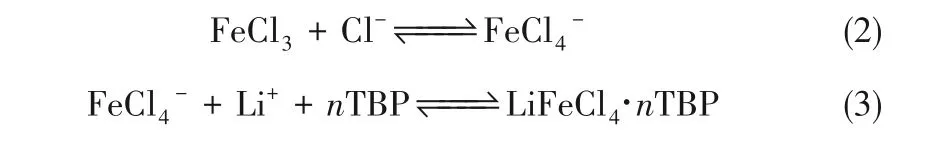
一级最高萃取效率约为65%,分离因子约为350。有机相重复利用十次,其萃取效率保持在53%。但在萃取过程中,须将FeCl3作为共萃取剂添加到有机相中,且溶液须呈酸性,在中性和碱性条件下不能进行萃取过程。
Qi等[14]提出了一种新的三元溶剂萃取体系TBP/FeCl3/P507(2-乙基己基膦酸单-2-乙基己酯),在更好地维持锂萃取容量的同时,显著增强了锂的汽提过程(图3)。85%的锂被汽提,且Fe3+几乎不损失。萃取反应如下:


图3 TBP/FeCl3/P507用于萃取提锂机理[14]Fig.3 Mechanismof TBP/FeCl3/P507 for extraction of lithium[14]
他们将三元混合萃取体系TBP/FeCl3/P507用于实际盐湖卤水提锂,如图4所示通过分批和多阶段模拟逆流萃取测试,发现在三阶段测试中,锂回收率达99.8%。汽提过程中,Fe3+完全保留在有机相中,使有机相可直接用于下一步提取而无须再生[15]。该体系有望可持续回收高Mg/Li+比盐湖卤水中的锂。萃取反应如下:

图4 三阶段SCT的过程图[15]Fig.4 Process diagramof three-stage SCT[15]
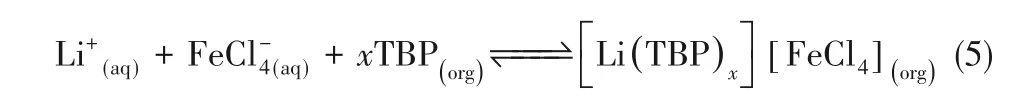
有机类萃取体系对锂的选择性高,目前研究更深入,也是高镁锂比盐湖卤水中具工业化应用前景的方法之一。
1.2 离子液体萃取
离子液体作为萃取分离过程的绿色溶剂,其化学性质稳定,具有不可燃性、低挥发性、可调黏度等特点。常用于盐湖卤水提锂的离子液体主要有:咪唑类六氟磷酸盐([Cnmim][PF6])、咪唑类双(三氟甲基磺酰)酰亚胺[Cnmim][NTf2]、四丁基铵双(2-乙基己基)-磷酸盐[N4444][DEHP]、双(2-乙基己基)-磷酸四辛基铵[N8888][DEHP]等[16-18]。
Deng等[19]研究了磷酸三异丁酯(TIBP)和几种离子液体(PF6-和NT作为阴离子)对Li+萃取性能的影响。在TIBP-ILs-煤油这一萃取体系中,这些离子液体的阴离子用作共萃取试剂,具有良好的疏水性和类似于FeCl4-的立体对称结构。以1-丁基-3-甲基咪唑六氟磷酸盐作为离子液体展现出更好的锂离子萃取效率,在最优条件下,单步萃取效率达83.71%,萃取反应如下:

Jia等[20]利用离子液体[C4mim][NTf2]和中性的TBP作为萃取剂对含镁离子的盐湖卤水进行了锂的萃取。在最优的条件下,锂的萃取效率为92.37%。在萃取过程中,通过阳离子Li+和[C4mim+]之间的交换机理,将锂离子萃取到有机相中,证明这一萃取体系能够有效提取盐湖卤水锂。
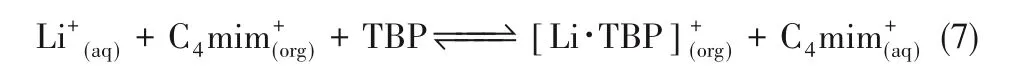
Jia等[18]合成了两种非氟化的功能化离子液体(ILs)萃取剂,即[N4444][DEHP]和[N8888][DEHP],对溶液中的锂进行了萃取。在温和条件下,无须在溶液中加入复杂的络合剂,便能将锂完全汽提,且在循环过程中,该萃取剂的萃取效率不降低。萃取反应如式(8):

Ren等[21]利用杂多酸离子液体回收锂离子,合成了无氟离子液体1-丁基-3-甲基咪唑磷钨酸盐([Bmim]3PW12O40),将其作为共萃取剂从高Mg/Li比盐湖卤水中回收锂。在最佳条件下,通过五级错流萃取,Li+总萃取率为99.23%。高选择性萃取锂离子是通过TBP与Li+之间的阳离子交换和配位作用实现的。10个再生循环萃取过程表明,有机相对Li+的选择性萃取具有高的稳定性。
深共熔溶剂被认为是一种新型的离子液体类似物,它们通过氢键相互作用由两组分或三组分共晶混合物自缔合形成,由于低挥发性、低成本可生物降解性和低毒性,被认为是绿色溶剂。Zhu等[22]利用一种疏水性深共熔溶剂(HDES)提取锂离子,绿色协同系统TBP-HDES具有高选择性锂萃取能力,单次萃取率达到76.8%,5次循环后萃取率仍能达到60%。
离子液体作为可替代有机萃取剂的绿色体系,虽然拓宽了萃取法的应用范围,降低了污染,但价格偏高,一定程度上制约了其工业应用。
2 吸附法
吸附法是一种从环境和经济角度具有较大优势的锂提取技术。尤其是从低品位的高镁锂比卤水、海水中提锂的优势更明显。该方法的关键在于发展性能优异的吸附剂,从最初的有机吸附剂到无机离子交换剂,吸附法已实现从稀溶液中提锂。现阶段吸附剂主要分锰系、钛系离子筛和铝系吸附剂。锰系离子筛主要为尖晶石结构的锂锰氧化物离子筛,通过复合吸附机理进行锂的选择性吸附;钛系离子筛主要为层状结构与尖晶石结构的锂钛氧化物,通过离子交换进行选择性吸附锂离子;铝系吸附剂主要是LiCl·2Al(OH)3·nH2O,利用有序结构空位进行选择性吸附锂。
2.1 锰系离子筛
通过将锂离子引入锰化合物中,热处理形成尖晶石结构,再利用酸处理用质子置换Li+,在不改变晶体结构的情况下,形成锰系锂离子筛(图5)。在多离子共存下,锂离子筛具有筛选和记忆目标锂离子的能力,称为“离子筛效应”[23]。
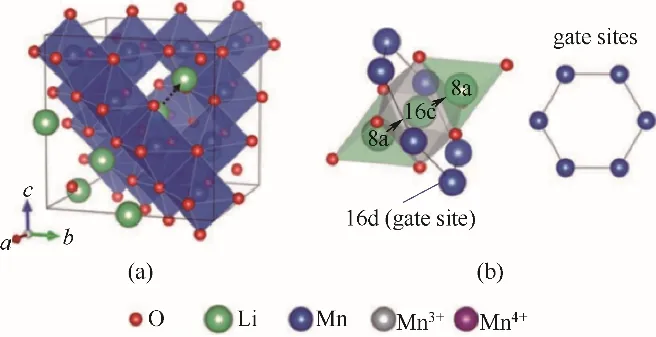
图5 尖晶石LiMn2O4的晶体结构(锰离子驻留在氧离子形成的八面体中。虚线箭头表示锂的扩散路径)(a);锂扩散通道从四面体8a位置通过由六个空位包围的八面体16c空位到相邻的8a位置的示意图(b)[23]Fig.5 Crystal structure of spinel LiMn2O4(Manganese ions reside in the octahedra formed by oxygen ions.The dotted arrow denotes a lithiumdiffusion path)(a);Schematic illustration of the lithium diffusion channel from a tetrahedral 8a site to an adjacent 8a site through an octahedral 16c vacancy surroundedby six manganeseions in the octahedral 16d gate sites(b)[23]
目前,对锰系锂离子筛吸附机理有三种解释。

(3)复合反应机制:吸附过程既涉及氧化还原机制,也涉及离子交换机制[27]。
LiMn2O4、Li1.6Mn1.6O4和Li4Mn5O12等需要通过酸处理形成锰系离子筛(LMOs)。由于Mn3+的特殊电子结构,在酸性环境中引起LMO晶格结构严重畸变,体相中Mn3+的电子被转移到Mn4+,Mn4+被还原为Mn2+后溶解[28]。LMO的锰溶损阻碍了锰系离子筛的工业应用。
锰系离子筛λ-MnO2、MnO2·0.31H2O和MnO2·0.5H2O 分 别 由 前 体 LiMn2O4、Li1.33Mnl.67O4和Li1.6Mn1.6O4形成,理论吸附容量分别为5.7 mmol/g(39.6 mg/g)、8.5 mmol/g(59.0 mg/g)和10.5 mmol/g(72.9 mg/g)[29]。尽管理论容量相对较高,但由于LMO稳定性差和锰溶解速率高,实际吸附容量相对较低。改性LMO可提高吸附能力,降低锰的溶解损失。常见方法为掺杂过渡金属,如铜、锌、铁、镍和钛修饰LMO。金属与氧原子之间可形成强离子键,Li-O键长度增加,Mn-O键长度减小,LMO尖晶石结构的晶格收缩,增强结构稳定性,阻碍锰溶解。
镁掺杂对增强LMOs结构稳定性具有积极的影响。Zhao等[30]采用软化学方法制备LiMg0.56Mn1.50O4,经过五次循环后,锂提取率仍大于95%。通过掺杂铁也可降低锰损失,利用铁的磁性有利于回收吸附剂。
由于锂离子筛呈粉末状,在工业应用中流动性差、渗透性不足、循环效率低,柱运行时压降大、粉体损失大、能耗高,工业生产中对离子筛进行如造粒、成膜、发泡、成纤维、磁化等成型处理。Yu等[31]合成LiMn2O4、Li1.66Mn1.66O4和Li4Mn5O12等锂锰氧化物(LMO),应用于地热水中锂选择性回收,发现粉状Li4Mn5O12对低浓度Li具有较高吸附性能,在壳聚糖(CTS)/LMO质量比3∶2下造粒(图6),在303.15 K时,地热水中Li平衡吸附容量达到8.98 mg/g,Li与其他离子的分离系数均高于5,经过五次吸附-解吸循环后,吸附容量衰减不超过1.1%[31]。
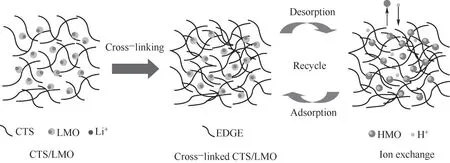
图6 用EGDE交联球形CTS/LMO示意图[31]Fig.6 Schematic diagram of cross-linking spherical CTS/LMOwith EGDE[31]
Ju等[32]报道了通过浸渍结晶和钙化方法后将锂锰氧化物(Li4Mn5O12)负载到管状α-Al2O3陶瓷衬底上,作为离子筛前体,酸洗后得到锂离子筛。在动态吸附-解吸过程,该锂离子筛对Li+吸附容量为9.74 mg/g,锰溶损为0.99%。经过3次循环,该吸附剂保持80%的初始动态吸附容量。
锰系锂离子筛对Li+具有良好的选择性,可从高镁锂比卤水中吸附Li,但在解吸过程中,锰溶解阻碍了其工业应用。
2.2 钛系离子筛
锂钛氧化物(LTOs)离子筛对锂具有较高的选择性,该吸附剂可在其晶体结构无重大变化的条件下,实现锂离子的插层和脱出,而盐水中存在的其他离子如Na+、K+和Ca2+,由于半径较大,不被吸附,钛系离子筛的离子选择性顺序为Li+≫Na+>Mg2+>Ca2+>K+。LTOs如Li2TiO3和Li4Ti5O12可通过锂盐处理商业二氧化钛来合成,在洗脱锂时表现出更好的稳定性。
在Li2TiO3的晶体结构中,氧原子排列在立方体晶格位点,锂和钛占据八面体空隙,形成层状单斜结构,一层包含Li原子,另一层包含LiTi2序列(图7)[33]。用酸将锂从Li2TiO3中洗脱出来,得到H2TiO3,用于吸附锂[式(11)~式(13)]。在锂吸附/解吸过程中,LTOs具有较好的结构稳定性,可回收利用。但在酸浸过程中,Li2TiO3会发生结构重排,特别是在高浓度氯离子存在下,会导致其转化为金红石相TiO2,对Li的吸附能力降低[34]。

图7 锂钛酸盐的晶体结构[33]Fig.7 Crystal structure of lithiumtitanate[33]
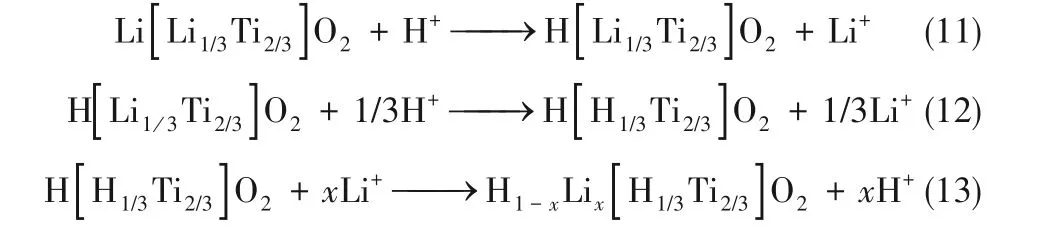
Tang等[35]采用静电纺丝和煅烧相结合的方法制备了多孔钛基锂离子筛(LIS)纳米纤维,具有良好锂吸附容量和较高选择性,如图8所示。焙烧形成的多孔结构增加了吸附位点暴露,显著加速了锂在骨架空位的脱出与嵌入。该材料可在30 min内达到吸附平衡,吸附容量59.1 mg/g,接近理论值(63.77 mg/g)。具有良好的稳定性,循环6次后对锂离子吸附量仍为86.5%。
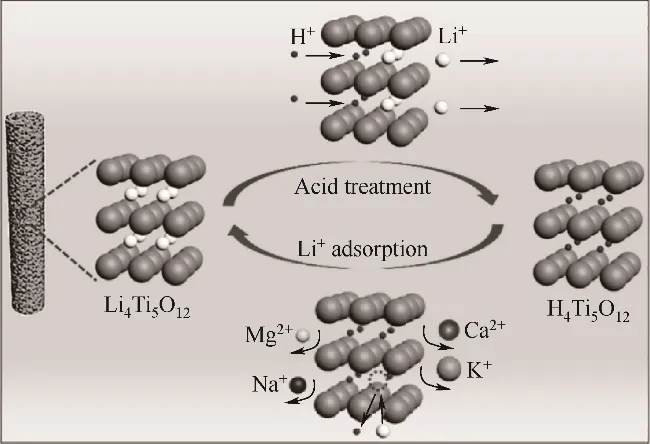
图8 P-HTO-NF锂回收示意图[35]Fig.8 Schematic diagram of P-HTO-NFlithium recovery[35]
Li等[36]发现Li2TiO3可以实现盐湖卤水中镁/锂分离,Li/Mg分离系数为4783。He等[37]发现Li2TiO3脱锂后形成的H2TiO3吸附容量达到57.8 mg/g,在5次循环后,吸附容量为25~30 mg/g。虽然Li2TiO3具有较高的理论吸附容量(142.9 mg/g),但由于实际生成物中锂含量低于理论量,以及合成Li2TiO3时的高温条件引起颗粒间团聚,所得到的吸附容量仅为理论值的40%[38]。Zhu等[39]用不同TiO2前体制备锂离子筛,发现了锂离子筛亲水性与吸附性能之间的相关性,其中锐钛矿TiO2衍生的锂离子筛具有更强的亲水性,表现出更高的吸附性能,24 h吸附容量达到34.2 mg/g,对Li+具有很高的选择性,且易于再生。另外,铁掺杂的Li2TiO3离子筛Fe/Ti-0.15(H)具有良好的大规模连续磁回收率(96%)和优良的锂吸附容量(53 mg/g),可与悬浮液有效分离[40]。
2.3 铝系吸附剂
铝系吸附剂一般化学式为LiCl·2Al(OH)3·nH2O,是将LiCl插入Al(OH)3中形成锂铝复合金属氢氧化物(LiAl-LDH)而产生的一种有序空位型层状结构[图9,式(14)][41],是目前我国青海盐湖唯一大规模工业化应用的吸附剂。

图9 Al(OH)3吸附Li+转化为LiAl-LDH示意图[41]Fig.9 Schematic diagramof Al(OH)3 adsorption of Li+into LiAl-LDH[41]

因为Li+可以进入Al(OH)3晶格,占据八面体空穴,而体积较大的碱金属和碱土金属离子由于空间效应不能进入,使得铝系吸附剂对Li+具有选择性。虽然Mg2+的离子半径(72 pm)与Li+的离子半径(76 pm)相似,但Mg2+与水分子结合形成水合离子([Mg(H2O)6]2+),离子半径增大到428 pm,而Li+只能形成半径382 pm的水合离子,水化自由能远小于Mg2+(Li+为515 kJ/mol,Mg2+为1922 kJ/mol)[42-46]。因此,实现铝吸附剂对Li+的吸附和镁锂分离。
Yu等[47-49]研究了具有结构缺陷的LiCl·2Al(OH)3·nH2O吸附剂,从高Mg/Li比盐水中提取锂,吸附容量为7~8 mg/g,卤水中含有高浓度的MgCl2,吸附剂对锂仍具有选择性[47]。当MgCl2浓度从0增加到500 g/L时,锂吸附容量提高近4倍[48]。进一步研究了吸附剂对Li-Na-MgCl2体系的协同竞争吸附,验证了锂和钠离子之间的竞争吸附作用,说明了在柱吸附过程中回收锂的可能性,为柱吸附实验提供了数据[49]。
Yu等[50-52]用超顺磁性纳米粒子(Fe3O4或γ-Fe2O3)掺杂入铝吸附剂,无须造粒过程,并实现外部磁场下的吸附剂回收。用磁性Fe3O4化学共沉淀法制备磁性Li/Al-LDH(MLDH),用磁棒进行吸附剂与溶液分离。发现MLDHs的锂吸附容量下降,而选择性增大。当Fe3O4含量为13.11%(质量)时,MLDH对锂吸附容量为5.83 mg/g,吸附剂回收率为97%。在固定床柱中填充成型吸附剂,模拟从盐水中吸附锂离子。发现初始锂浓度、床层高度和进料流量对柱吸附性能有显著影响[51]。为了模拟和预测锂的吸附曲线,建立了均匀表面扩散模型[52]。虽然铝系吸附剂已工业应用,但吸附容量低,需要进一步优化。
吸附法适用于高Mg/Li比盐湖卤水提锂工艺。锂吸附剂具有优异的锂选择性、较高的理论锂吸附容量和优越的循环性能,并且可从较低锂浓度的溶液中有效提取锂,因此该技术未来在盐湖原始卤水提锂以及西藏盐湖锂资源开发中具有较大的应用潜力。但现阶段,锂吸附剂还有诸多问题及挑战:
(1)实际吸附容量与理论吸附容量之间存在巨大差距,这可能是由于吸附剂前体洗脱过程中Li+脱附不完全以及循环过程中吸附通道被堵塞,导致有效空位数减少;
(2)在洗脱过程中,粉末吸附剂的核心骨架在溶液中溶损、破裂、塌陷;
(3)工业生产中对吸附剂进行如造粒、成膜、发泡、成纤维、磁化等处理,导致吸附位点被堵塞和覆盖,使工业吸附剂的吸附容量大幅降低。因此,后续探究优良的造粒成型方法提高吸附容量是吸附剂工业应用的关键。
3 反应/分离耦合技术
反应/分离耦合是指能同时实现化学反应和物理分离,其主要特点是:
(1)在反应过程中分离出具有抑制作用的产物,可提高总收率和处理能力;
(2)在反应过程中消除不良物质,从而保持较高的反应速率;
(3)反应过程中产生的热量促进分离过程,从而降低能耗;
(4)简化后续分离过程,从而降低生产成本。
该技术在反应精馏、反应-膜分离和生物反应/分离中有广泛应用[53-57]。针对我国高镁锂比盐湖镁锂分离的重大难题,Guo等[58]提出反应/分离耦合创新思想,依据层状复合金属氢氧化物(layered double hydroxides,LDHs)的晶格选择性与离子识别科学原理,在镁锂分离、提取锂的同时联产镁基功能材料,例如:MgAl-LDHs。MgAl-LDHs层板由MgO6和AlO6八面体交替排列组成,当镁离子和锂离子在溶液里同时存在时,Mg2+会形成稳定的金属-氧八面体结构即MgO6,而Li+不能形成八面体结构,即不能进入LDHs的层板,使得MgAl-LDHs对Mg2+具有晶格选择性。因此,卤水中的Mg2+与外加Al3+在碱作用下反应,形成MgAl-LDHs固体,镁离子选择性进入固相形成MgAl-LDHs,而锂离子仍保留在液相,实现镁锂高效分离。在高效回收锂的同时,充分利用了盐湖丰富的镁资源(图10)。镁基功能材料在紫外阻隔、气体阻隔、PVC热稳定剂、阻燃/抑烟、催化、土壤修复治理等领域应用广泛。

图10 反应/分离耦合技术从盐湖卤水中分离镁、锂并制备LDHs产品流程[58]Fig.10 Scheme of Mg/Liseparation and LDHs preparation by reaction-coupled separation technology[58]
Xiang等[59]从实验和理论模拟两方面提出了混合离子溶液中Mg/Li分离的条件判据(图11),为反应/分离耦合技术应用于盐湖镁锂分离提供了理论依据。确定了镁离子和锂离子分离的边界条件是Mg/Al摩尔比大于2,而与溶液中的Mg/Li质量比无关。利用微液膜反应器进行分离过程强化,通过研究成核和结晶过程条件,以锂损失、反应后Mg/Li比和LDHs产品粒径为主要指标,发现当形成高结晶度的LDHs时,颗粒间团聚被显著抑制,LDHs产品粒径更均一,反应/分离过程的锂损失降低。反应/分离后溶液中的镁锂比由初始的12.66大幅降至0.08,锂回收率高于90%。

图11 反应/分离耦合技术分离盐湖卤水中镁、锂的理论判据边界条件[59]Fig.11 Theoretical criterion and boundary conditions for separation of magnesium and lithium in salt lake brine by reaction-coupled separation technology[59]
在利用反应/分离耦合技术实现盐湖镁、锂分离时,由于向卤水溶液引入了Na+,除镁后溶液的Na/Li比高达48.7,这为锂的提取带来了新挑战。依据晶体结构分析,锂离子可以进入Al(OH)3结构的有序空位,形成稳定的空位嵌入型锂铝氢氧化物(LiAl-LDHs)(图12)[60]。因此,Xiang等[61]进一步采用反应/分离耦合技术从高钠卤水中提取锂,利用LiAl-LDHs的离子识别结构特征,从提镁后的高钠卤水中选择性地捕获锂离子,使锂离子进入固相,而钠离子则保留在液相,实现了高效锂、钠分离。通过脱锂反应将LiAl-LDHs中的锂离子脱出,转变为锂空位型Al(OH)3,可从盐湖卤水中选择性地捕获锂离子,实现高选择性锂提取。该研究实现了从预合成的LiAl-LDHs中脱锂、从卤水中提锂的循环过程。在吸附过程中,锂离子被捕获进入AlO6形成的晶格空位中,而Cl-插入到层间,恢复为LiAl-LDHs结构,吸附容量达到22.94 mg/g,锂回收率达到96%。反应/分离耦合技术应用于高钠卤水提取锂,证实了LiAl-LDHs在选择性捕获锂离子中的关键作用,拓宽了该技术的适用范围。

图12 合成LiAl-LDHs并制备有序空位型锂吸附剂高选择性捕获锂离子[60]Fig.12 Scheme of selective capture of lithium ions by ordered vacancy adsorbent prepared by LiAl-LDHs[60]
反应/分离耦合技术打通了从盐湖卤水锂资源提取到锂盐富集的整个技术链条,通过锂回收和吸附反应中晶相的改变实现了循环过程,反应条件温和,是盐湖锂资源提取利用新工艺的有益探索。该技术已在青海察尔汗盐湖提锂项目中完成中试,为后续我国青海其他盐湖及西藏盐湖提锂提供了新的技术方向。
4膜 法
膜法是一种具有较高分离效率的新兴技术,且膜过程已实现规模化连续运行以及自动化控制,在盐湖卤水锂资源提取领域具有广阔的应用前景。根据驱动力不同,膜法提锂技术主要分为纳滤法(压力驱动)与离子选择性电渗析法(电位驱动)。此外,相比于传统电渗析,双极膜电渗析和膜电容去离子系统在工艺和功能上有了较大改进,因此受到了关注。近年来,许多膜材料相继被开发并用于盐湖卤水锂的分离与提取,具有高选择性、低能耗和良好循环性能的膜材料是膜过程工业应用的关键。
4.1 纳滤
纳滤是一种压力驱动的膜分离过程,受Donnan效应和尺寸筛选效应的影响,对多价离子具有更好的保留性能,对单价离子具有更好的渗透性[62]。然而,在实际操作中,纳滤膜并不能完全分离镁和锂,只可使盐湖卤水中Mg/Li比明显降低,从而降低后续锂提取过程中的分离难度。在纳滤分离过程中常出现膜污染现象,而且延长操作时间后,分离效率降低。因此,该技术在实际应用中应与其他分离方法相结合,以提高分离效率、延长使用寿命、降低分离成本[63]。
采用模拟高Mg/Li比卤水溶液研究DK纳滤膜,发现其对镁和锂具有良好的分离效果。Wang等[64]通过提高操作压力,增加了锂收率,改善了镁锂分离效果,在3.5 MPa下观察到镁截留率92%。他们还研究了pH对镁锂分离的影响,在较低pH时,由于多价离子的介电排斥增强,Li+和Mg2+的分离得到改善[65]。在两阶段纳滤过程中,溶液pH是至关重要的,在pH=3.5时,分离后Mg2+/Li+比从13.25下降到0.17。Yu等[6]详细研究了操作时间、操作压力、进料温度、pH、镁锂比等对DL-2540NF分离镁锂的影响,提高操作压力,降低进料温度和pH,可提高Mg2+截留率,有利于镁锂分离,同时Mg2+/Li+比增大、竞争性单价离子(如Na+和K+)的存在会增加Li+截留率,不利于镁锂分离。
Zhang等[66]将三丁磷酸(TBP)/FeCl3经典萃取体系加入到聚氯乙烯(PVC)基聚合物包裹膜(PIM)中,从富含Mg2+的溶液中提取Li+(初始Mg2+/Li+摩尔比为15)。与液-液萃取相比,聚合物包覆膜对Li+提取率提高了20%,Li+与Mg2+分离系数提高了5%,为卤水中提取锂提供了一种有潜力的膜技术。
Li等[67]合成了用于镁/锂分离的聚酰胺复合纳滤 膜,对 离 子 的 截 留 顺 序 为MgCl2>MgSO4>NaCl>LiCl。当MgCl2浓度为2 g/L、初始Mg/Li比为20时,通过纳滤过程可将Mg/Li比降至7.7。当等电点小于9.5时,膜表面带正电(商用NF90膜的等电点为3.6)。因此,合成纳滤膜的性能优于商用NF90。Li等[68]用EDTA改性纳滤膜,表面带正电荷,可与二价阳离子如Mg2+形成配合物,镁和锂的分离因子为9.2。Xu等[69]制备了一种含羟基多壁碳纳米管修饰的纳滤膜,处理卤水的镁锂质量比为14,镁和锂的分离因子为10.4,具有97%以上的二价离子截留率和高渗透性。Peng等[70]构建了一种新型聚合物功能化金属-有机骨架(MOF)纳滤膜,具有优异的锂离子选择性,分离因子高达1815,可实现极快锂分离。Zhao等[71]使用含二齿胺基团的电解质单体(DAIB)改性原始聚酰胺复合膜,DAIB改性不仅提高了膜表面亲水性,而且还降低了水通过100 nm厚度分离层的阻力,表现出高透水性,在200 h连续纳滤中,稳定性良好。
在纳滤膜材料结构设计方面,首先应开发锂离子通量较高的纳滤膜,以降低分离成本;提升纳滤膜的耐污染性和分离稳定性,因为在复杂卤水体系下长期运行易形成膜污染,进而降低水通量和离子选择性,不利于提升锂回收率和镁锂分离效果;开发高性能的膜,提升纳滤膜对多价阳离子的分离效果,这对于镁和锂的分离尤为关键。
4.2 电渗析
在电渗析过程中,溶液中的离子在电场下通过膜迁移,这种现象广泛应用于盐水淡化、工业废水处理和有机酸生产等领域[72]。使用交替放置的阳离子和阴离子交换膜的电渗析过程示意图见图13,阳离子在电场作用下通过阳离子交换膜,而阴离子则通过阴离子交换膜迁移到电极上[73]。电渗析分离离子的原理是单价阳离子(例如:Li+、Na+、K+)通过单价选择性阳离子交换膜迁移到浓缩室,而二价阳离子(例如:Ca2+、Mg2+)被阻挡,留在脱盐室。选择性离子交换膜是电渗析技术应用于盐湖卤水中提取锂的关键。

图13 电渗析过程示意[73]Fig.13 Schematic diagram of the electrodialysis process[73]
Yu等[74]采用电渗析技术对不同进料特性的卤水进行处理,评价了Selemion CSO膜的选择性与亲和性。在盐水系统中发现一种特殊的转移现象,证明该方法对各种卤水中回收锂具有适用性。天然卤水实验也表明,该技术能有效实现锂回收。
选择性电渗析(S-ED)是一种从较高Mg/Li比卤水中分离回收锂的新兴技术。Yu等[75]采用单级SED工艺,研究了电流、温度和卤水总溶解固体(TDS)浓度对锂回收率、选择性迁移率、电流效率和能耗的影响。发现低于极限电流密度的大电流既能提高锂回收率,又能提高分离性能。高温下锂、镁离子分离度明显降低,锂回收率变化不大。采用四级分步调节电流的S-ED工艺,分离后Mg/Li质量比由9.85降至0.57时,锂回收率达90%。
Zhao等[76]报道了一种液膜电渗析法,可以选择性地从卤水中回收锂。液膜由离子液体和两层固体阳离子交换膜组成,离子液体作为Li+的载体,对Li+具有较高选择性和长期稳定性,两层固体阳离子交换膜夹在载体上。利用电场辅助的夹心液膜可实现Li+识别和选择性电迁移。在电流密度为4.375 A/m2的条件下,电渗析12 h后,Mg/Li比由初始盐水的50∶1降至接收液的0.5∶1,电流效率65%和比能耗16 Wh/g均比典型电渗析工艺低。
Zhao等[77]进一步提出了一种结合液膜萃取和电渗析的夹心式液膜电渗析系统(图14)。夹心液膜由两层阳离子交换膜和一层负载锂的有机液膜组成。选择TBP-TABLO4-体系作为液膜,能够将锂离子与其他阳离子(Na+、K+、Mg2+、Ca2+)有效分离。该系统适应性强、能耗低,具有很好的应用前景。

图14 液膜萃取和电渗析夹心式液膜电渗析系统回收Li+[77]Fig.14 Liquid membrane extraction and electrodialysis sandwich liquid membrane electrodialysis recovery Li+system[77]
电渗析工艺能耗低(40~270 Wh/mol),可处理较高Mg/Li比和高Mg2+浓度的盐湖卤水。该工艺可在不同浓度的盐湖卤水中实现镁/锂分离。虽然单价选择性离子交换膜的电渗析能有效去除二价离子,但从含有共存单价离子(Na+、K+等)的卤水中有效回收锂仍具有挑战性。
4.3 双极膜电渗析
双极膜电渗析技术(bipolar membrane electrodialysis,BMED)是在普通电渗析系统中引入双极膜,以促进水在电场下解离成H+和OH-的过程,在直流电场驱动下,OH–可以与从含锂原料液迁移进入碱室的Li+结合形成氢氧化锂,因此该方法在由含锂溶液制备氢氧化锂方面具有应用前景。目前研究侧重于由盐湖卤水制备氢氧化锂的工艺。针对我国盐湖高镁锂比特点,可将双极膜电渗析与其他镁锂分离方法相结合,制备较高纯度的氢氧化锂产品。该方法与传统盐湖氢氧化锂制备技术相比,具有低能耗、绿色环保、产品品质高等特点,在提升盐湖锂盐产品品质、丰富锂产品种类方面具有一定优势。
Xu等[73]利用电渗析对低镁锂比卤水进行富集浓缩,再由沉淀法得到碳酸锂,去除二价阳离子杂质,最后利用双极膜电渗析制备氢氧化锂。Shen等[78]采用离子选择性电渗析与双极膜耦合,利用选择性离子交换膜分离二价杂质离子,一定程度上解决了二价阳离子对离子交换膜的结垢污染,但制备的氢氧化锂液浓度低于0.2 mol/L,需进行高倍浓缩后才能进行氢氧化锂结晶。从高Mg/Li比盐湖卤水制备氢氧化锂面临着分离锂/镁、富集锂、生产高纯度氢氧化锂的挑战。Wang等[79]采用双极膜电渗析与NF、RO、CED相结合的一体化膜工艺,从Mg/Li比大于30的盐湖卤水中制取LiOH(图15)。结果表明,该工艺制备的碱液锂浓度大于1.0 mol/L,电流效率为36.05%,能耗为6.20 kWh/kg,是从盐湖卤水中制备氢氧化锂很有发展前景的工艺。

图15 BMED与NF、RO、CED一体化膜从盐湖卤水中制取LiOH[79]Fig.15 Schematic diagramof the production of LiOH fromsalt lake brine with integrated membranes of BMED,NF,ROand CED[79]
虽然膜分离技术是一种可行的工艺,但其发展受到高运行成本的限制。因此,膜技术的未来发展应包括提高分离效率、改善材料稳定性、膜污染控制和膜设计,而开发高选择性膜材料至关重要。
5 电化学法
电化学方法利用锂离子电池中的Li插层/脱层原理,工作电极作为锂捕获材料先从盐水中捕获Li+,再将其释放到溶液中回收。在电化学作用下可避免脱锂过程用酸洗脱材料,从而减少了材料溶损,增强了循环性能,是一种低能耗、高效率的提锂技术[80-81]。在电化学方法中,要求锂捕获材料具有优良的选择性、高的锂容量和长期稳定性。
5.1 离子捕获系统
Kanoh等[82-83]报道了利用电极材料从溶液捕获锂离子的电化学方法。该过程是基于可充电锂离子电池的锂插层/脱嵌机制,捕获和释放锂离子的反应为:
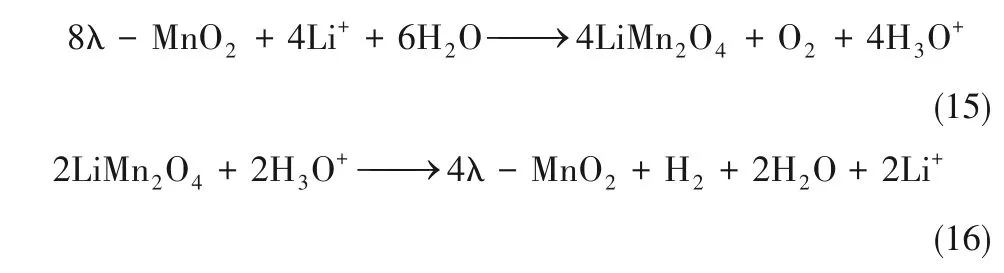
Chen等[84]通过恒电位处理LiMn2O4合成了一种不需高温和有机黏结剂的自支撑λ-MnO2电极,在电化学提锂中表现出较高的锂离子迁移能力,更大的容量和更好的循环性能,能耗约为4.14 Wh/mol Li+。Wang等[85]用石墨布改性LiNi0.6Co0.2Mn0.2O2制备核壳型微球材料(rGO/NCM),解决电极材料的腐蚀问题。电子在石墨布中传输,有效抑制了NCM晶格塌陷。由rGO/NCM和活性炭(AC)组成的脱盐电池能提取93%的Li+,提取容量为13.84 mg/g,消耗能量1.4 Wh/mol。他们还研究了由LiNi0.038Mo0.012Mn1.95O4(LNMMO)和交流阳极组成的混合超级电容器从盐水中提取锂,提取容量为14.4 mg/g,97.2%的Li+被捕获,消耗能量7.91 Wh/mol[86]。在锂离子捕获系统中,Li+在工作电极上被捕获,阴离子在对电极上被捕获。由于LiFePO4能够在较宽pH范围内的水溶液中保持稳定,具有良好的可逆性能,常被选为工作电极。当锂被提取时,LiFePO4转变到FePO4,通过施加反向电压,AgCl被还原为Ag,实现锂的提取回收。反应如下:

La Mantia等[87]报道了一种从盐水中回收锂的电池(图16),该电池由捕获Li+的阳离子电极(LiFePO4)和捕获Cl-的阴离子电极(Ag)组成。回收每千克锂消耗电能144 Wh,可将富钠的盐水(Li∶Na=1∶100)转化为富锂溶液(Li∶Na=5∶1)。

图16 采用LiFePO4-Ag体系进行电化学锂回收[87]Fig.16 LiFePO4-Agsystem for electrochemical lithium recovery process[87]
Zhao等[88]将磷酸铁锂电极材料充电机理与浆料电解工艺相结合,回收废弃磷酸铁锂材料。在阴离子膜浆料电解过程无须添加化学试剂,可分离Li和FePO4。锂浸出率达98%,而96%以上的铁以FePO4/C被回收。
5.2 摇椅电池系统
摇椅电池是在电池充电和放电期间,锂离子分别从电池的正、负电极插入和脱出,锂离子的传输类似于摇椅运动。Li+从阴极室的盐水中被选择性捕获;同时,Li+被释放到阳极室。锂离子在正极和负极中具有良好的可逆性。常利用LiFePO4/FePO4电极选择性地从盐湖卤水中提取锂,盐水中Li+被FePO4选择性捕获。同时,Li+从LiFePO4里脱出并富集,反应式为:

通过调节电位将插入负极中的Li+释放到电解质中,阴离子交换膜阻止锂离子从阳极室进入阴极室,从而达到锂离子在阳极室中富集。循环结束后,交换正、负极后再运行,可以从盐水中连续提取锂。
Zhao等[89]依据摇椅电池原理从卤水中提取锂,构建了LiFePO4|NaCl溶液|阴离子交换膜|卤水|FePO4电池体系(图17)。在处理原卤时,卤水中Mg/Li比从初始的134.4降至阳极电解液中的1.2,锂回收率83%。在处理老卤时,Mg/Li比由初始的48.4降至0.5,阳极电解液中的锂浓度上升为初始的6倍,从0.51 g/L上升到3.2 g/L,提锂容量约为5 mg/g。使用电化学方法提取锂的过程简单、连续性好,回收过程不用添加其他化学试剂,几乎不引入杂质,产品的纯度和回收率高。但电极上的化学反应需避免副反应,对电解液组成要求较高,系统需要进一步优化,目前尚未规模化生产。

图17 利用LiFePO4/FePO4结构电化学提取锂[90]Fig.17 Structure of the LiFePO4/FePO4 for electrochemical lithiumextraction[90]
6 总结与展望
从高镁锂比盐湖卤水中提取锂的主要方法有萃取、吸附、新兴的反应/分离耦合技术以及以压力驱动的膜分离法,而以电驱动的膜分离法及电化学法只适用于低镁锂比盐湖卤水锂提取,对于高镁锂比盐湖提锂则需要与其他分离方法相结合。由于各盐湖锂资源禀赋特点存在差异,现阶段以萃取、吸附、膜分离为主的盐湖提锂技术已分别在青海柴达木地区各盐湖锂盐产区得到产业化应用,已在青海建成总产能近10万吨/年的碳酸锂生产线。本文对现有提锂技术研究进展进行了系统综述,并结合相关技术的产业化实施效果,对现有锂提取技术方法的特点以及存在问题进行总结,见表2。

表2 现有盐湖卤水锂提取技术比较Table 2 Summary of existing lithium extraction techniques
近年来,随着我国青海、西藏盐湖卤水锂提取技术的不断发展,萃取法、吸附法等较为传统的提取方法已经得到一定应用,而以纳滤法、电渗析法为代表的膜法和反应/分离耦合技术也在逐渐兴起,并受到广泛关注。依据各分离技术的优势和特点,耦合利用不同提锂技术是未来青海地区盐湖提锂的一个重要发展方向,比如膜法与吸附法等其他技术组合,可进一步提升镁锂分离效果和锂浓度,高镁锂比盐湖卤水可利用反应/分离耦合技术进行镁锂分离,之后再利用普通电渗析及双极膜电渗析直接加工锂盐产品,而无须传统的蒸发浓缩和化学法沉锂技术,有利于提升锂资源利用率、降低能耗。
基于目前我国青海盐湖提锂技术进展及产业化发展状况,针对青海地区高镁锂比盐湖锂资源的开发利用,尚需解决如下问题:
(1)盐湖锂资源开发利用的总收率偏低;
(2)提锂后资源的综合利用程度低;
(3)镁锂分离技术有待优化提高,开发高纯的氯化锂、氢氧化锂、金属产品,延长锂产品产业链,实现锂资源高值化、多元化利用;
(4)盐湖高效提锂技术的工程化和产业化研究待加强。
由于地理环境、气候条件以及光照条件等因素影响,西藏地区盐湖卤水蒸发速度低、老卤产出周期长,因此,青海地区盐湖提锂技术未必适用于西藏盐湖锂资源的开发。针对西藏地区盐湖锂资源开发,应结合西藏地区的环保要求,发展低能耗、无污染、绿色环保的提锂技术,因此,吸附法和膜分离技术在西藏盐湖提锂中具有突出的应用前景。总之,我国盐湖主要位于青藏高原生态环境脆弱区,未来的盐湖提锂技术应充分利用当地的太阳能、风能、冷能和地热等天然资源优势,发展高效盐田工艺,减少外来化学试剂添加。在开发锂资源的同时,促进盐湖资源的综合利用,积极开发提锂后高镁或高钠卤水及沉锂母液等高盐废水综合治理及锂资源再利用技术,促进盐湖提锂技术向高效、集约、绿色环保的方向发展。

