虎杖O-甲基转移酶基因(PcOMT)的克隆与生物信息学分析
吴志军,王晓伟,陈默,胡红艳,陶玲玲,徐淑艳,张华,曹宏伟,王红
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.中国科学院大学生命科学学院;3.黑龙江八一农垦大学学术理论研究部;4.黑龙江八一农垦大学理学院)
虎杖是我国传统中药,具有利湿退黄、散瘀止痛、清热解毒、止咳化痰等功效。可用于治疗湿热黄疸、风湿痹痛、痈肿疮毒、水火烫伤、跌打损伤、肺热咳嗽等症状,在临床得到广泛应用[1]。现代药理学研究表明,虎杖具有抗病毒、止血镇痛、抑菌、消炎、抗肿瘤的作用。另外,对心血管疾病和相关脂代谢也有调节作用。其中的白藜芦醇因具有抗肿瘤、抗发炎、抗病毒、降血压等功效而受到广泛关注[2-3]。
虎杖的主要药用部位是根和根茎,随着其药理学性质和药用部分的化合物逐渐被鉴定,发现聚酮类化合物是虎杖的主要活性成分。包括二苯乙烯类、蒽醌类、黄酮类等次生代谢产物[4]。聚酮是一大类结构复杂、功能多样的次生代谢产物,与人健康密切相关。聚酮类化合物参与多种生物学过程,具有抗肿瘤、抗寄生虫、抗炎症和抗真菌、调节免疫活性等功能[5-6]。
生物碱、黄酮、苯丙烷、二苯乙烯、蒽醌、木质素等次生代谢产物的产生过程多需要甲基化修饰。植物O-甲基转移酶能将次生代谢产物中的氧原子进行甲基化修饰,甲基化修饰可以提高脂溶性和稳定性,能更好的发挥其生物活性[7-8]。甲基化修饰是植物中广泛存在的催化甲基化反应的蛋白,在植物苯丙烷衍生途径、类黄酮合成途径、二苯乙烯和蒽醌类糖苷等次生代谢产物合成过程中发挥重要作用,并在植物抗生物和非生物胁迫过程中发挥重要作用[9]。
虎杖作为重要的药用植物,在临床上有广泛应用。目前,虎杖的基因组信息尚未得到测序,相关功能基因组学的研究较少,仅有基因组草图发布,严重制约虎杖的相关功能基因的研究[10]。许多化合物的合成途径和相关基因尚未得到确定,仅有苯丙烷途径中少数基因如查尔酮合酶和白藜芦醇合酶和转录因子的基因得到报道。郝大程等[11]利用Illumina HiSeq 2000高通量测序技术测了虎杖根的短序列,并通过信息学方法拼接并注释了86 000多个unigenes,其中有许多与次生代谢相关的同源基因。Chen等[12]报道了从虎杖基因组中扩增出2-吡喃酮合酶的基因,研究了其催化特征和表达模式。柳忠玉等[13-14]获得白藜芦醇合成基因并观察了其在拟南芥中的表型,同时验证了转录因子PcMYB1基因的功能和表达特征。Bao等[15]从虎杖基因组中扩增得到转录因子基因PcWRKY,并将其转入拟南芥中,研究了其在植物响应逆境胁迫中发挥的作用。
研究从虎杖转录组数据库中获得O-甲基化酶全长序列,设计引物进行克隆,构建植物表达载体进行表达,并对其相关生物信息学进行了分析。同时验证了其植物在细胞中的亚细胞定位。并不同组织中的表达水平进行了验证。为进一步研究其功能奠定基础,为利用合成生物学生产这些活性成分提供基因资源。
1 材料与方法
1.1 菌株、质粒和植物材料
大肠杆菌DH5α、BL21菌株和根癌农杆菌GV3101为实验室保存,分别用于载体构建、蛋白表达和植物转化,P19由实验室保存,用于烟草瞬时转化。PBI121质粒和eGFP-PBI121质粒由实验室保存。野生型虎杖、拟南芥均在实验室种植。本氏烟草(Nicotiana benthamiana)由实验室保存,用于转基因烟草瞬时表达。虎杖在24℃温室中培养,光周期为:16 h光照/8 h黑暗,培养8周后用于实验。分别进行UV-B胁迫30 min、0.5 mM的MeJa、0.1 mM的ABA进行处理。处理后样品用液氮速冻后放-80℃备用。
1.2 试剂
质粒小提试剂盒购自全式金生物公司;胶回收试剂盒购于北京天根生化科技有限公司;Silwet L-77购自科创欣达公司,用于拟南芥的遗传转化;Clon Express II One Step Cloning Kit一步克隆重组试剂盒购自南京诺唯赞生物科技有限公司,引物合成、测序均由北京擎科生物科技有限公司完成;各种限制性内切酶均购自Thermo Fisher Scientific公司;植物DNA快速提取试剂盒购自GeneMark公司;Plant Total RNA Purification Ki(tCat.TR02)试剂盒购自GeneMark公司,反转录试剂盒购自全式金公司。
1.3 目的基因的获得
用液氮研磨虎杖叶片,使用Plant Total RNA Purification Kit试剂盒提取虎杖叶片总RNA,使用反转录试剂盒将RNA逆转录为cDNA后进行10倍稀释做模板。根据转录组测序的结果,获得待扩增的氧甲基转移酶基因全长序列(去掉终止密码子),并设计引物进行PCR扩增(上游引物ATGGGTTCAGCTGCTCCAGA,下游引物为:AGGATAAACCTCGATAACTG),PCR扩增过程如下:95℃预变性5 min;95℃变性1 min,60℃退火45 s,72℃延伸1 min;30个循环后72℃恒温10 min。将PCR产物胶回收,同时以eGFP-PBI121为模板扩增eGFP基因(上游引物:CAGTTATCGAGGTTTATCCTATGTCTAGAGTGAGCAAGGG,下游引物:GATCGGGGAAATTCGAGCTCTTACTTGTACAGCTCGTCCA),胶回收用于融合片段的扩增。
1.4 载体构建
PCR扩增eGFP的片段,利用Overlap extenation PCR分两轮将PcOMT和eGFP基因片段连为融合表达载体。用限制性内切酶BamHI和SacI对PBI121载体进行双酶切,胶回收酶切产物。设计具有与线性化载体两端区域重叠的引物(上游:CGGGGGACTCTAGAGGATCCATGGGTTCAGCTGCTCCAGA,下游:GATCGGGGAAATTCGAGCTCTTACTTGTACAGCTCGTCCA),通过PCR扩增出目的片段(两端带有与载体同源的序列),再利用一步克隆重组试剂盒进行连接。在冰浴中按以体系(5×CE II Buffer:2μL;线性化载体:3μL(200 ng);插入片段扩增产物:3μL(50 ng);Exnase II:1μL;ddH20:1μL) 加入各种试剂后瞬时低速离心,在PCR仪中37℃反应30 min,反应完成放于冰上5 min,然后通过热激转化大肠杆菌感受态细胞。涂布含有50μg·mL-1卡那霉素的板子上,37℃过夜培养,挑取单菌落,菌液PCR,鉴定为阳性的提质粒测序。测序正确的质粒保存于-20℃备用。将构建好的质粒转入根癌农杆菌GV3101的感受态细胞中,用抗性平板筛选,并进行PCR鉴定。载体构建流程见图1。

图1 载体构建流程图Fig.1 The construction process of recombinant plasmid
1.5 荧光定量PCR反应体系
PCR反应总体系为10μL,包括:5μL HieffTM qPCR SYBR Green Master混合液(裕盛生物技术有限公司)、1μL cDNA、上下游引物各0.2μL和3.6μL去离子水。荧光定量qPCR反应程序:95℃,5 mim;95℃,10 s;60℃,20 s;72℃,20 s;40个循环。数据分析采用2-ΔΔCT法计算基因的相对表达量。引物为:q-F:ACAGACGCAGTTGTTCTA,q-R:GGTGAATCCAGCATTGTC;扩增片段长度为103 bp。选择actin为内参基因,其引物为actin-F:TACCTACAACTCCATCAT和actin-R:TCATCCTGTCAGCTATA。
1.6 转基因拟南芥和烟草构建
用花序侵染法构建转基因拟南芥,带有目的载体的农杆菌GV3101菌液接种于200 mL LB液体培养基(含抗生素)中,28℃和200 rpm振荡培养过夜,生长至OD600=1~1.5时,将菌液4 000 rpm离心10 min,弃上清液,用5%蔗糖溶液重悬稀释菌体,使OD600在0.4~0.6之间;向蔗糖菌液中加入0.05%的表面活性剂silwetL-77,作为侵染液;侵染时将拟南芥已开的白色花蕾剪去,用绿色花蕾进行侵染。将花蕾放入侵染液中8 min,然后取出拟南芥植株放于暗处24 h,继续放回温室培养,直至种子成熟;转基因种子的筛选:将成熟的种子用75%乙醇和NaClO分别消毒。消毒后铺在含有含35 mg·L-1卡那霉素的1/2 MS固体培养基上,4℃纯化2 d,观察拟南芥苗颜色变化,转基因苗能够正常生长,颜色呈正常的绿色,待生长至4片叶片后移入土培环境中继续培养,至种子成熟。剪取拟南芥小片叶片用植物DNA快速提取试剂盒提取DNA,用目的基因的引物进行PCR鉴定,获得转基因拟南芥。
烟草瞬时转化采用注射农杆菌GV3101的方法。挑取农杆菌GV3101培养至OD600=1~2,转接至含有Rif和Kan的新鲜LB培养基中。28℃培养至OD600=1,4 000 rpm离心10 min,去上清。用infiltration buffer(10 mM MES,150μM的MAs,10 mM的MgCl2)重悬菌体用。P19重悬液OD600=1。用注射器针头在烟草叶片背面扎小孔,用去针头的注射器对准叶片,把菌液注射进叶片,直至水渍满整个叶片,在叶柄上贴上标签。注射后2~3 d进行观测。
1.7 蛋白的生物信息学分析与进化树构建
利用NCBI数据库进行BLAST分析,通过在线软件ProtParam对PcOMT蛋白的特性进行分析,用I-TASSER在线软件预测其二级结构并进行PcOMT蛋白的结构建模。利用Clustal W软件对扩增得到的蛋白质序列和NCBI数据库获得的其他植物来源OMT蛋白序列进行同源比对,然后利用MEGA 7.1软件Neighbor-joining方法构建进化树,Bootstrap重复设置为1 000,并进行聚类分析。
2 结果与分析
2.1 基因的克隆与载体构建
利用植物RNA提取试剂盒,提取植物总RNA,通过反转录获得cDNA,以其为模板用特异性引物和进行PCR扩增。如图1所示,PCR扩增获得一条1 116 bp的条带,与预期大小一致(图2 A)。同时扩增eGFP片段,大小为726 bp,与预期一致(图2 B)。利用重叠延伸PCR将PcOMT和eGFP基因进行串联融合,得到大小约为1 900 bp的条带,显示已经将两条带融合为一条嵌合基因(PcOMT-eGFP)(图2C)。用一步克隆试剂盒将所得的融合基因与双酶切的载体同源重组,转化感受态细胞,涂布含有50μg·mL-1卡那霉素的LB固体培养基上,37℃过夜培养后,挑单菌落,进行PCR鉴定,同时进行液体培养并提取质粒,BamH I和Sac I双酶切鉴定。结果显示,重组载体切为2条带,其中一条大小为1 900 bp左右,为融合片段(图2 D)。测序结果证实PcOMT-eGFP融合片段正确连接至PBI121载体,且没有发生突变。
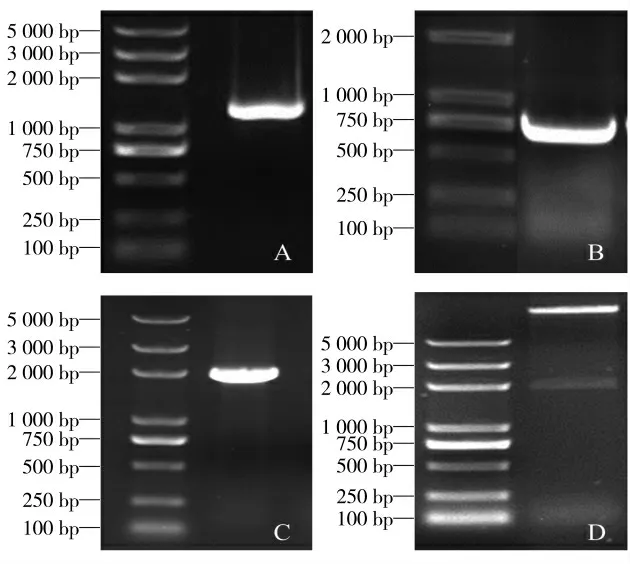
图2 PcOMT基因的克隆与融合片段的扩增与连接载体PBI121Fig.2 Gene clone and construction the fused fragment of PcOMT and eGFPby overlap PCR,and ligated fused fragment to the plasmid of PBI121
2.2 PcOMT蛋白的生物信息学分析
根据测序结果显示,PcOMT基因有1 116个碱基对组成,编码371个氨基酸,通过在线软件Prot-Param对PcOMT蛋白特性进行分析,结果显示,蛋白分子量为40.95 KDa,等电点为5.95。PcOMT的脂溶指数为87.57,亲水性平均系数为-0.091,属亲水性蛋白质,不稳定系数为39.42,该蛋白的性质较稳定。在线软件TMpred预测结果表明,在196~219处有跨膜区(图3)。

图3 PcOMT蛋白的生物信息学分析Fig.3 Bioinformatics analysis of PcOMT protein
将PcOMT基因序列利用NCBI的BLAST进行序列比对,发现PcOMT存在两个植物甲基化酶的保守结构域(图3-C)。即植物O-甲基转移酶的二聚体结构域(GenBank accession number:cl06920,38Met-85Thr)和AdoMet_MTases超家族(GenBank accession number:cl17173)序列(144Trp-362Phe)结构域,表明该蛋白具有典型的O-甲基转移酶特征,PcOMT在196~219位氨基酸处有跨膜结构域。用I-TASSER(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)进行蛋白质空间结构建模,预测PcOMT蛋白的空间结构如图3-B,该蛋白50.13%的α-螺旋结构,11.86%的片层结构,38.01%的无规则卷曲和β折叠。C-score为0.65,模型预测结果较为可靠。α-螺旋构成了空间结构的主体,这与其他植物中的氧-甲基转移酶一致。序列分析发现,PcOMT蛋白有5个保守的结构域(I-V)(图4),其中结构域I(VDVGGGTG)和IV(GKVLII)是S-腺苷-甲硫氨酸(SAM)的结合位点[16-17]。

图4 PcOMT蛋白与其他植物O-甲基转移酶的序列对比和保守结构域(I-V)Fig.4 Sequence alignment and conserved domain(I-V)of PcOMT protein and other plant O-methyltransferases
2.3 蛋白序列分析及系统进化树构建
使用Clustal X软件对PcOMT和其他植物(Jr:胡桃;Qs:高山栎;Pa:甜樱桃;Vv:酿酒葡萄;Ha:向日葵)来源的OMTs进行同源序列比对,使用Mega 7.1软件进行Neighbor-joining法构建系统进化树,以分析PcOMT蛋白的亲缘关系。
BLAST结果显示,PcOMT与其他同源蛋白的序列相似性较低,同源性最高的为山葡萄(Vitis amurensis),达53.02%,与其他物种的同源性更低。
系统进化树结果表明,PcOMT蛋白与野甘草(Scoparia dulcis)、酿酒葡萄(Vitis vinifera)、烟草(Nicotiana attenuata)、云杉(Quercus lobata)和向日葵(Helianthus annuus)等植物的同源蛋白相似性较高,与拟南芥(Arabidopsis thaliana)、玉米(Zea mays)、小麦(Triticum aestivum)、月季(Rosa Chinensis)和糙叶山黄麻(Parasponia andersonii)等同源蛋白亲缘关系较远。
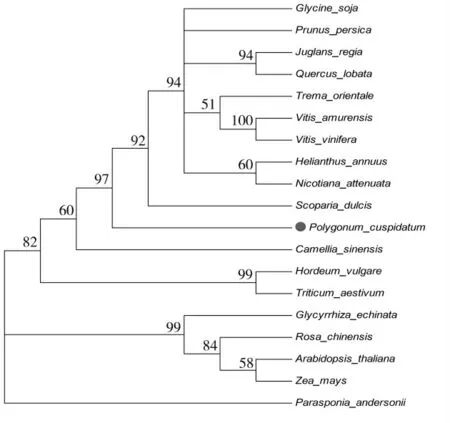
图5 系统发育树分析PcOMT蛋白的进化关系Fig.5 The phylogenetic tree of PcOMT and other homologous protein
2.4 PcOMT蛋白在烟草和拟南芥中表达的亚细胞定位
将构建的融合表达基因PcOMT-eGFP转入根癌农杆菌感受态细胞,通过花序侵染法侵染拟南芥,构建转基因拟南芥。利用瞬时转化,转染烟草。结果显示,PcOMT蛋白得到正确表达,其在拟南芥和烟草中的亚细胞定位结果显示,PcOMT定位在细胞质中。
2.5 PcOMT基因的表达模式分析
分别提取生长8周的虎杖根、茎和叶的RNA,反转录成cDNA,利用实时荧光定量PCR分析PcOMT基因在不同组织的表达水平。结果显示PcOMT的表达水平呈现组织特异性。以叶片中PcOMT基因的表达水平为对照,在茎中的表达水平最高,是叶片中的2.94倍,根中次之,是叶片的2.77倍,叶片中表达水平最低。这与其他植物中的甲基转移酶表达模式一致,PcOMT参与了根、茎中木质素的合成,以增强机械强度[18]。
同时,采用UV-B、MeJa和ABA等非生物因素进行胁迫,检测PcOMT基因的表达水平,结果显示,PcOMT基因在受到UV-B和ABA胁迫时,在收到胁迫2 h时PcOMT的表达水平达到最大,8 h表达水平下降,16 h后表达水平降到最低。而在受到MeJa胁迫时,PcOMT的表达水平在2 h和8 h与对照组没有明显提高,但在胁迫16 h后,PcOMT的表达明显受到抑制。
3 讨论
次生代谢产物在植物适应环境过程中发挥重要作用,也是中药活性成分的重要来源[19]。次生代谢物的合成途径复杂多变,需经过多种化学修饰才能完成。虎杖是我国传统的药用植物,在临床上有非常广泛的应用。虎杖中的次生代谢产物,包括苯丙烷类、二苯乙烯、黄酮类、生物碱类等化合物,具有药理作用,对人类健康有益,这些化合物是虎杖的主要活性成分[20],其合成过程大都需要甲基化修饰。植物中甲基化修饰主要依赖于SAM的O-甲基转移酶将甲基转移至目标化合物的氧原子上,形成甲基化产物,甲基化修饰能够增加这些次生代谢产物的脂亲和性和稳定性,影响植物的生长发育,同时参与植物抵抗各种非生物胁迫[21-22]。
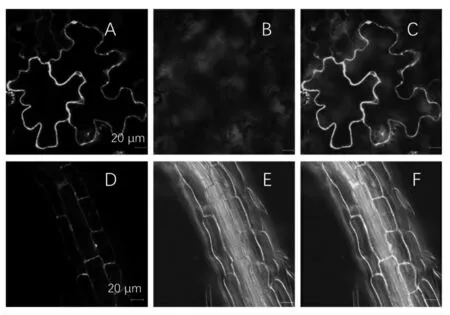
图6 PcOMT蛋白在烟草和拟南芥中的亚细胞定位Fig.6 Subcellular localization of PcOMT protein in Nicotiana benthamiana and Arabidopsis thaliana
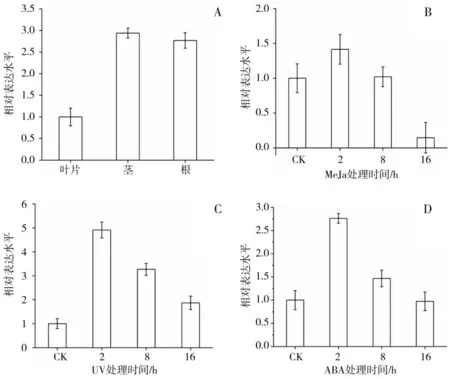
图7 PcOMT基因在虎杖不同组织和环境胁迫下的表达模式Fig.7 Expression profiles of PcOMT gene in different tissues and under different environmental stress
由于虎杖基因组结构复杂,至今尚未有精确的基因组信息公布,给其功能基因的研究带来很大障碍。目前研究的基因主要集中在与苯丙烷代谢途径相关的酶(STS、CHS、PAL、C4H和4CL) 和MYB和WRKY等转录因子的基因[1]。研究利用虎杖的转录组数据,设计引物克隆得到PcOMT基因全长,并将其连接至PBI121真核表达载体。生物信息学分析表明PcOMT蛋白具有氧甲基转移酶的保守结构域。BLAST和序列分析发现氧—甲基转移酶在不同植物中序列差异性较大,不同植物来源的氧—甲基转移酶功能上保守,但在序列上并不保守。拟南芥和烟草的转化实验表明,PcOMT基因得到正确表达,亚细胞定位显示,该基因编码的蛋白定位于细胞质。组织表达模式证实,该基因是组成型表达,在茎和根中表达水平较高,叶片中最低,这与其他植物来源的甲基转移酶基因表达模式相似,在受到非生物胁迫时表达水平总体上都有上升趋势,在胁迫2 h达到最高,后逐渐下降,显示甲基转移酶在植物受到非生物胁迫时发挥了重要作用。虎杖O-甲基转移酶基因的克隆与表达,为深入研究其生物学功能奠定了基础,也为利用合成生物学方法生产中药活性成分提供基因资源。

