猪整合素β1蛋白的表达及多克隆抗体的制备
王一,李春秋,栾广宇,郭东华,张旭,原冬伟,孙东波
(黑龙江八一农垦大学动物科技学院,大庆163319)
整合素是一种成员较多的免疫受体蛋白,整合素(integrin)最早是在1987年研究发现的,其主要由α与β两种亚基组成。目前发现有18种α亚基及8种β亚基,两种亚基通过不同的组合方法形成了24种不同的整合素分子[1]。整合素是一种广泛分布在细胞表面的膜状蛋白,可在细胞表面作为重要的黏附受体[2]。根据配体结合特异性与亚基组成分类,整合素最大的三个分组为α亚基、β1亚基和β2亚基。整合素的受体包括精氨酶-甘氨酶-天冬氨酶(RGD)、层粘连蛋白、白细胞、胶原蛋白[3]。α和β亚基彼此不具有同源性,结构有较大的差异。从细胞外结构来看,虽然两种亚基的胞外区都比较长,大约含有700至1 100种氨基酸而胞内区则相对较短,至含有40至70种氨基酸。但是我们也发现,和β亚基相比,α亚基的胞内区的长度较短,所以,二者的细胞外结构差异性较大。但是β4属于一个例外,其胞内区较长[4]。
整合素的胞外区和细胞外基质相连,胞内区和细胞骨架相连。所以,整合素起到连接细胞和外界环境的功能,使得细胞具备黏附的能力[5]。整合素可以作为双向性的信号转导媒介,它可以介导ECM信号从细胞外向细胞内传递,调控细胞的活性、代谢、黏附、迁移等。此由外向内传递信息由整合素与胞质蛋白结合介导[6]。它也可以介导胞质蛋白信号从细胞内向细胞外传递,调控细胞分化、存活、增殖等,其中整合素β亚基在信号传导过程中发挥重要的作用。此由内向外传递信号由胞内的刺激因子介导[7-8]。整合素与黏附分子及信使分子相互作用而实现整合素的双向信号转导。整合素的亚基具有不同的功能,整合素β1是一种可以实现细胞与细胞外基质连接的作用,使得细胞能够产生黏附作用;而整合素β2主要作用于各个细胞之间,其主要在白细胞表面表达;整合素β3参与血小板聚集,在血栓形成中发挥作用[9]。
机体在感染病毒之后,细胞表面的受体最先和病毒接触,从现有的研究结果来看,细胞表面的糖蛋白是最主要的受体物质,也就是病毒最先与之结合的位置,而整合素正是一种存在于细胞表面的糖蛋白物质[10]。研究发现整合素可以在多种病毒感染过程中发挥作用,整合素可以作为目前已知的多种病毒受体或共受体,例如人类疱疹病毒、艾博拉病毒、免疫缺陷病毒、腺病毒、口蹄疫病毒、轮状病毒等[11-16],促进病毒感染宿主细胞,因此使其在病毒学研究领域引起了广泛关注。整合素β1及其自身和α亚基结合的异二聚体,都可以作为多种病毒的感染受体或感染相关蛋白参与病毒的侵入过程。例如,β1亚基和αv亚基形成的整合素αvβ1在禽偏肺病毒的感染过程中起着重要作用,促进病毒与细胞的结合[17];在狂犬病病毒感染者的机体内,科学家发现整合素β1发挥了重要作用,促进了狂犬病病毒与细胞的结合,增加了感染的几率[18]。高水平表达的整合素β1促进爱波斯坦—巴尔病毒的感染[19]。整合素β1通过激活PI3K/Akt信号传导促进牛痘病毒进入细胞[20]。大脑中高效表达的整合素β1能够促进巨细胞病毒感染[21]。
目前,有关猪整合素β1作为与病毒感染受体或相关蛋白的报道鲜为人知,研究通过对猪整合素β1进行序列优化后利用大肠杆菌对其进行表达,从而制备出多克隆抗体,并对制备出的抗体进行分析实验。为进一步研究猪整合素β1在猪病毒感染过程中的作用和机制奠定了基础。
1 材料和方法
1.1 主要试剂及实验动物
实验用兔购自中国农业科学院哈尔滨兽医研究所,弗氏完全佐剂及弗氏不完全佐剂购自Sigma-Aldrich公司,IPTG、HRP标记羊抗兔IgG及HRP标记羊抗鼠IgG购自Biosharp公司,Xh oI限制性内切酶及Bam HI限制性内切酶购自赛默飞世尔科技(中国)有限公司,TMB单组分显色液、质粒小量提取试剂盒及SDS-PAGE凝胶配制试剂盒购自北京索莱宝生物技术有限公司,PEG8 000试剂盒购自德国BioFrox公司。
1.2 猪整合素β1基因的合成
通过CBS在线网站使用TMHMM-2.0工具分析猪整合素β1基因序列(GenBank NM_213968.1)的跨膜区、胞外区、胞内区。选择亲水的胞外区序列,用DNAStar软件的Protean工具预测抗原区,根据大肠杆菌的偏爱密码子对抗原性良好区域进行优化,在5'与3'末端加入Bam HI与Xho I酶切位点,猪整合素β1基因的核苷酸序列人工合成后与pGEX-6p-1载体连接,实验中所使用的质粒pGEX-6p-1-β1是上海生工生物技术有限公司合成。
1.3 猪整合素β1基因的原核表达及纯化
首先,将合成的质粒pGEX-6p-1-β1转化到大肠杆菌的感受态细胞E.coli BL21(DE3)中,然后从中选择一个单一的菌落,将其放入具有氨苄抗性的LB溶液中,将溶液置于37℃的环境中进行细菌培养。当检测到该培养液的OD600值为0.6时,则向其中加入0.6 mmol·L-1的IPTG。然后将溶液置于160 r·min-1的环境中16 h,将温度调节为16℃,然后将完成诱导的溶液置于离心机中,温度4℃,转速为5 000 g,离心10 min后将菌液沉淀用预冷的PBS洗后在4℃离心机内5 000 g离心10 min,重复5次。对细菌溶液进行在低温状态下超声波破碎后(防止蛋白降解),通过SDS-PAGE电泳对细菌的全菌液、上清液及沉淀物对蛋白表达情况进行鉴定。蛋白胶泡在0.1 mmol·L-1KCL预冷溶液中显色2 min,使用手术刀片小心的切下凝胶中染为银白色的目的条带,银白色凝胶用PBS洗3次,洗掉目的条带上的KCL溶液,碾碎胶加入适量的PBS,在-80℃反复冻融3次以上(蛋白冻融次数越多,回收效率越高)。冻融后的胶及PBS在4℃离心机内8 000 g离心10 min,最终得到纯化的猪整合素β1重组蛋白,测定浓度用于后续的免疫实验兔及ELISA抗原包被(若蛋白浓度过低,我们可以使用PEG8 000进行浓缩,获得最合适的蛋白浓度),将纯化的蛋白保存在-80℃冰箱。
1.4 猪整合素β1重组蛋白的鉴定
用纯化的猪整合素β1重组蛋白SDS-PAGE电泳,230 mA电流在120 min内通过湿转电泳法,完成转膜之后将其封闭2 h,然后用PBST溶液对其进行清洗。将GST单克隆抗体1∶1 000作为一抗,将其置于4℃的环境中;将HRP-山羊抗鼠IgG 1∶10 000作为二抗,将其置于常温中避光1 h,然后用PBST溶液对其进行清洗。最后通过扫描成像系统查看结果。
1.5 猪整合素β1重组蛋白抗体的制备
首先将经过纯化的重组蛋白pGEX-6p-1-β1,用BCA法对其浓度进行检测,按0.5 mg每只实验兔将纯化后的蛋白与佐剂按体积比1∶1进行混合,在低温环境下使用旋涡振荡器充分振荡,乳化液体在清水中5 min内不出现扩散现象表明充分乳化。将乳化后的液体皮下多点注射2.0 kg左右的实验兔背部。蛋白和弗氏完全佐剂混合为首次免疫,蛋白和弗氏不完全佐剂混合为二、三次免疫。实验中各次免疫出现的时间相隔14 d左右。在开始实验后的第7 d从兔的耳部静脉处收集血液,采集血清,将免疫前的兔子血清作为对照组使用。在第三次免疫8 d后处死实验兔取其全血后进行血清分离。
1.6 猪整合素β1重组蛋白抗体效价检测
实验中效价的检测方法为间接ELISA法,首先用包被溶液对纯化后的蛋白进行稀释,稀释后的溶液浓度为1μg·mL-1,然后将96孔板的每孔加入100μL稀释后液体包被板子,在4℃的温度过夜孵育(目的是特异抗原与固相载体结合用于后续实验)。次日弃液,每孔使用300μL的PBST(0.01 mol·mL-1PBS,PH=7.4,0.05%Tween-20)进行洗涤,室温振荡3次,每次5 min。弃液后用5%的脱脂乳37℃恒温箱内封闭2 h,每孔150μL。弃液用PBST每孔300μL,洗3次,每次5 min。以待检阳性血清与未免疫实验兔的阴性血清为一抗,用PBST进行稀释,用方阵法确定一抗的最佳稀释度。稀释梯度按1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400至1∶12 800。在每个孔内加入100μL血清稀释液,37℃培养箱内作用1 h。将溶液去除后置于PBST中清洗,然后轻拍ELISA板去除清洗液。然后将孔板的所有孔中都加入HRP标记山羊抗兔IgG二抗(1∶10 000)溶液100μL,然后将孔板再次放入37℃培养箱内作用1 h,将溶液去除后置于PBST环境中清洗,然后轻拍ELISA板去除清洗液。再次将孔板中加入TMB显色液100μL,然后将其置于无光的室内,在常温下放置10 min,然后向其中加入100μL的2 mol·L-1H2SO4终止液,此时底物显色变黄,颜色越深代表抗体量越高。5 min内使用酶标仪测定每个孔在OD450nm的吸光度,记录实验结果,以便进行后续分析。计算阳性与阴性血清的OD450值之比(P/N),当P/N值小于1.5时血清为阴性,当大于或等于1.5而小于2.1为可疑血清,当大于或等于2.1时血清为阳性。所以在P/N值大于或等于2.1时的抗体血清最高的稀释倍数为抗体效价。
1.7 猪整合素β1多克隆抗体的特异性鉴定
选用含天然整合素β1蛋白的仔猪小肠组织作为样品进行Western blot方法分析。提取仔猪小肠组织总蛋白通过SDS-PAGE电泳将蛋白转印到聚偏二氟乙烯膜(PVDF膜)。5%的脱脂乳用PBST进行稀释后在37℃封闭2 h,PBST充分洗涤。取出三免后的实验兔多抗血清,将其加入到PBST溶液中稀释成1∶1 000的比例,将此溶液作为一抗置于4℃的环境中过夜放置,用PBST洗涤后HRP标记的山羊抗兔IgG为二抗置于常温下放置1 h,用PBST溶液反复清洗3次。最后使用凝胶成像仪观察结果,从而确认猪整合素β1多克隆抗体和天然整合素β1之间是否会产生反应。
2 结果与分析
2.1 猪整合素β1重组蛋白表达及纯化结果
首先需要对猪整合素β1胞外区进行预测,通过CBS在线网站使用TMHMM-2.0工具,结果显示猪整合素β1的胞外区为1~728位氨基酸(图1)。寻找胞外区抗原性良好区域为后续蛋白表达奠定基础,使用DNAStar软件分析出猪整合素β1的26~728位氨基酸具有良好的抗原性(图2)。基于大肠杆菌偏嗜性密码子的基础上对基因优化后合成,把Bam HI酶切位点加到5'末端,把Xho I酶切位点加到3'末端,人工合成猪整合素β1核苷酸序列。将合成的基因与原核表达载体pGEX-6p-1连接起来,使用Bam HI和Xho I限制性内切酶对重组质粒pGEX-6p-1-β1双酶切进行分析研究,试验结果显示,在2 109 bp和4 984 bp上,两个片段的大小和预测基本相同,检测结果如下(图3)所示。将保存完好的质粒pGEX-6p-1-β1转化至大肠杆菌的感受态细胞E.coli BL21(DE3)中,加入0.6 mmol·L-1的IPTG诱导,完成后将其置于超声环境中破碎,然后用聚乙酰胺凝胶进行电泳分析。结果显示,在102 ku左右发现目的蛋白成功表达,且以包涵体的状态存在。因此为了获得纯化蛋白实验通过切胶纯化的方法(图4)。

图1 猪整合素β1跨膜区预测Fig.1 Prediction of transmembrane helices of porcine integrinβ1

图2 猪整合素β1抗原区预测Fig.2 Prediction of porcine integrinβ1 antigen region

图3 pGEX-6p-1-β1合成质粒双酶切鉴定结果Fig.3 Identification results of double digestion of pGEX-6p-1-β1 synthetic plasmid

图4 猪整合素β1重组蛋白的表达与纯化结果Fig.4 Expression and purification results of porcine integrinβ1 recombinant protein
2.2 猪整合素β1的抗原性分析
实验中的抗原性分析的检测方法为Western blot法,将经过纯化的猪整合素β1重组蛋白经过Western blot分析后得出,pGEX-6p-1-β1重组蛋白它的原核表达载体pGEX-6p-1带有GST标签,鼠源的GST一抗能够特异性结合GST标签,说明纯化蛋白是猪整合素β1的目的蛋白(图5)。
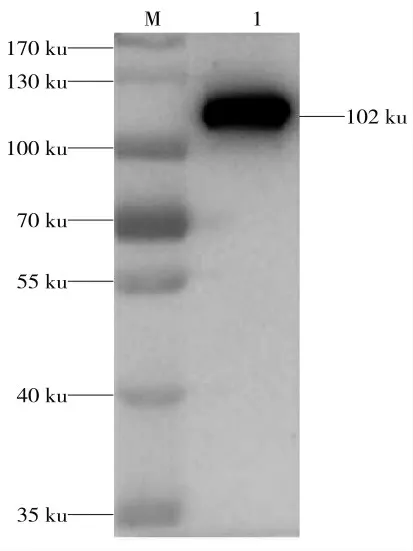
图5 纯化猪整合素β1重组蛋白Western blot结果Fig.5 Western blot of purified porcine integrinβ1 protein
2.3 多克隆抗体效价检测
使用间接ELISA法检测效价,检测结果显示,猪整合素β1多克隆抗体效价为1∶12 800。
2.4 猪整合素β1抗体检测效果
从仔猪的小肠部位中取出膜蛋白,该蛋白中含有天然的整合素β1,利用Western blot法对其抗原性进行分析,结果在130 ku左右有一条特异性条带,与整合素β1蛋白大小相近,此结果说明制备的多克隆抗体能识别天然整合素β1蛋白(图6)。

图6 多抗与天然整合素β1蛋白反应性鉴定结果Fig.6 Results of identification of reactivity of polyclonal antibody with natural integrinβ1 protein
3 讨论
整合素有许多功能,如在癌症发生、免疫反应、血栓治疗、炎症、胚胎形成等方面都发挥重要作用,还可以作为受体在病毒与细胞的感染过程中发挥作用[22-23]。由于整合素广泛分布于许多动植物细胞膜的表面,病毒颗粒感染宿主细胞过程中会直接或间接与整合素接触,因此在病毒感染过程中整合素可能具有重要参与作用。目前,整合素可作为多种病毒的感染受体或感染相关蛋白,在病毒研究领域备受关注。目前有报道称,整合素可以作为人类疱疹病毒、艾博拉病毒、免疫缺陷病毒、腺病毒、轮状病毒、口蹄疫病毒等多种病毒的受体或共受体[11-16]。口蹄疫病毒感染受体研究中已被报道的有整合素 β1、β3、β6、β8,其中整合素β6能够增强病毒感染[24-26]。PEDV是一种冠状结构的病毒,自身带有囊膜,当PEDV进入宿主细胞时,首先通过病毒表面的纤突糖蛋白和肠绒毛上的受体结合,二者通过膜融合的方式使病毒进入[27]。PEDV的敏感细胞Vero中有17种膜蛋白与病毒受体相关,包括整合素β1[28]。而且PEDV病毒粒子表面的纤突糖蛋白能够识别整合素的不同配体序列[29]。猪整合素 αvβ3能够在Vero、IEC细胞上促进PEDV感染[30]。猪整合素β1与β3都是整合素家族成员且同在于细胞表面,因此猜测在PEDV感染过程中猪整合素β1也可能发挥作用。为完成后续研究,试验构建表达猪整合素β1的原核表达载体并制备多克隆血清用于PEDV入侵宿主细胞机制的验证。
制备抗体主要是选择蛋白合适的抗原区,蛋白的亲水性、抗原性、可及性、二级结构以及疏水性等多种特性对抗原区域的选择作为参考,其中蛋白的亲水性与可及性对抗原表位的形成发挥重要的作用[31]。由于整合素β1胞外区的蛋白的主要作用是产生黏附,所以实验先对整合素β1的跨膜区域进行了分析,然后对其分析出的胞外区进行抗原性预测,对胞外区具有很好的抗原性区域人工合成。实验中选择pGEX-6p-1原核表达载体,因为pGEX-6p-1载体的GST标签不仅具有增加外源蛋白可溶性的作用,而且易于蛋白纯化。在对猪整合素β1的表达后发现,在分子质量在102 ku时,出现了特异性条带,这说明蛋白成功表达,但是重组蛋白的形式是包涵体的状态。因此在制备多克隆抗体时,使用了KCL染色SDS-PAGA电泳切胶纯化方法。通过切胶免疫法能实现蛋白的提取,而且提取出的蛋白不仅纯度相对较高,完整性也相对较好。此外,通过此方法提取出的蛋白为包涵体蛋白,经过蛋白纯化后可以直接免疫兔。为了制备出特异性强和高效价的猪整合素β1多克隆抗体,以实验兔为研究对象,通过蛋白免疫法对其进行检测,结果显示,较核酸免疫效价更高,但是抗原持续发挥作用时间短,所以,试验采用重复加强免疫,两周免疫1次,共免疫3次或得高效价血清[32]。免疫动物过程中抗原中添加的弗氏完全佐剂与弗氏不完全佐剂后改变其物理状态,有利于增强抗原的免疫应答[33]。试验制备的猪整合素β1多克隆抗体具有较高效价为1∶12 800,此多抗能够通过Western blot方法特异性识别仔猪小肠上皮细胞中的整合素β1蛋白。试验所制备猪整合素β1多克隆抗体也可通过间接免疫荧光的抗原抗体反应对细胞或组织中抗原的进行定位,为后续整合素β1与病毒定位和作用研究奠定物质基础。
4 结论
试验成功制备了特异性强和高效价的猪整合素β1多克隆抗体,该抗体的备制成功为后续猪整合素β1与猪病病毒感染等作用研究提供基础。

