超声造影鉴别诊断涎腺腺样囊性癌与多形性腺瘤的应用价值
彭柳清,罗渝昆,李 楠,李秋洋,费 翔,梁舒媛
解放军总医院第一医学中心 超声诊断科,北京 100853
涎腺腺样囊性癌(adenoid cystic carcinoma,ACC)是涎腺较常见的恶性肿瘤,主要累及腮腺,次为颌下腺,以“羊皮狼”为特征,其生长缓慢,形状和特点与良性多形性腺瘤(plemorphic adenoma,PA)相似,但浸润性强且血行转移率高[1-3]。超声检查是涎腺肿瘤术前常用的检查方法,但部分涎腺ACC恶性征象不明显,容易误诊为PA,两种肿瘤的治疗方案及远期预后迥异[4]。因此,术前明确肿瘤的性质对选择合适治疗方案及预后判断非常关键。目前超声造影技术可为涎腺良恶性肿瘤鉴别诊断提供有价值的信息[5-6]。本研究回顾性分析涎腺ACC和PA的常规超声特征、超声造影增强特征和时间强度曲线(time intensity curve,TIC)参数,以期为涎腺ACC和PA的鉴别诊断提供参考。
资料与方法
1资料 本研究收集2018年1月-2019年12月因颌面部肿块就诊于解放军总医院第一医学中心口腔外科,后经病理证实的ACC及PA患者。所有患者术前进行常规超声和超声造影检查,检查前均签署超声造影知情同意书。
2超声造影检查 仪器采用Mindray Resone7彩色多普勒超声诊断仪,探头型号为L11-3(频率3~11MHz)。造影剂使用声诺维(sonovue)加入5mL0.9%氯化钠注射液稀释配制,使用前充分震动混匀。患者平卧位,头部向健侧微转,充分暴露检查区域。先行常规超声检查,记录病灶大小、形态、边界、内部回声及彩色多普勒(color Doppler flow imaging,CDFI)情况。CDFI采用Adler0~Ⅲ级的分级方法。选择病灶血流最丰富切面(同时包括部分正常腺体组织),固定探头,再切换至超声造影模式,机械指数设定为0.08。经肘部浅静脉采用团注法推注2.5mL造影剂,随后推入5mL0.9%氯化钠注射液,推注造影剂同时打开计时器,连续采集120s动态图像并保存。为避免因推注时间不同引起的造影参数差异,推注药物和0.9%氯化钠注射液的时间均在3s内完成。
3图像分析 逐帧回放超声造影动态图像。分析指标:1)增强时间:快进(早于周围正常组织增强),慢进(晚于或同步于周围正常组织增强)。2)增强方式:向心性增强(自病灶周边向中心增强),非向心性增强(弥漫性或离心性增强)。3)增强均匀程度:均匀,不均匀增强(包括灌注缺损)。4)增强后边界:清晰,不清晰。5)增强强度(与周围正常组织增强程度对比):高增强、等增强、低增强。6)增强环(病灶周边高亮度的环状增强):无、有(连续、不连续)。7)增强后病灶范围:有或无扩大。运行仪器自带定量分析软件,避开灌注缺损区、钙化灶及大血管,选取病灶明显增强区域为感兴趣区(region of interest,ROI),尽量使ROI面积相同,绘制TIC曲线,获取如下参数:达峰时间(time to peak,TTP)、峰值强度(peak intensity,PI)、峰值强度减半时间(DT/2)。
4诊断方法 常规超声以声像图特征进行诊断,机器自动设置以病灶边界、形态、内部回声和CDFI特征等多个声像图特征参数进行联合判断。超声造影特征联合应用:以设备默认的联合输出结果,结合临床专业人员的实践经验进行联合诊断。图像结果的判读由两名主治医师进行分析得出,若两者判读存在不同,由副主任医师以上级别的医师会诊得出结果。
5统计学分析 采用SPSS20.0软件进行统计学分析。计量资料以?表示资料以例数(百分比)表示,组间计量资料比较采用t检验,计数资料采用Fisher’s精确概率检验。诊断价值分析采用ROC曲线。P<0.05为差异有统计学意义。
结 果
1患者一般资料 共纳入11例ACC及24例PA患者。ACC组病灶部位为腮腺7例,颌下腺4例,年龄22~68(48.6±14.2)岁,病灶最大径1.4~5.1(2.8±1.0)cm;PA组病灶部位为腮腺12例,颌下腺12例,年龄21~81(47.2±18.2)岁,病灶最大径1.0~3.8(2.3±0.9)cm。
2常规超声声像图特征结果比较 涎腺ACC和PA多表现为边界清晰、形态不规则、内部回声不均匀,以Ⅰ~Ⅱ级血流为主。涎腺ACC和PA声像图特征见表1、图1A、图1B。

表1 涎腺ACC和PA患者声像图特征比较(n,%)Tab. 1 Comparison of sonographic features between salivary gland ACC and PA patients (n,%)
3超声造影诊断比较 涎腺ACC和PA均可表现为高增强或低增强,多表现为向心性、不均匀增强伴灌注缺损区且无增强环。涎腺ACC患者中9例(81.8%)增强时间为快进且增强后边界不清,8例(72.7%)增强后病灶范围扩大,5例(45.4%)存在异常血管结构,PA患者中仅2例(8.3%)快进、6例(25.0%)增强后边界不清、2例(8.3%)增强后病灶范围扩大,1例(4.2%)存在异常血管结构,两组增强时间、增强后病灶边界、增强后病灶范围及异常血管结构比较结果见表2、图1C、图1D。
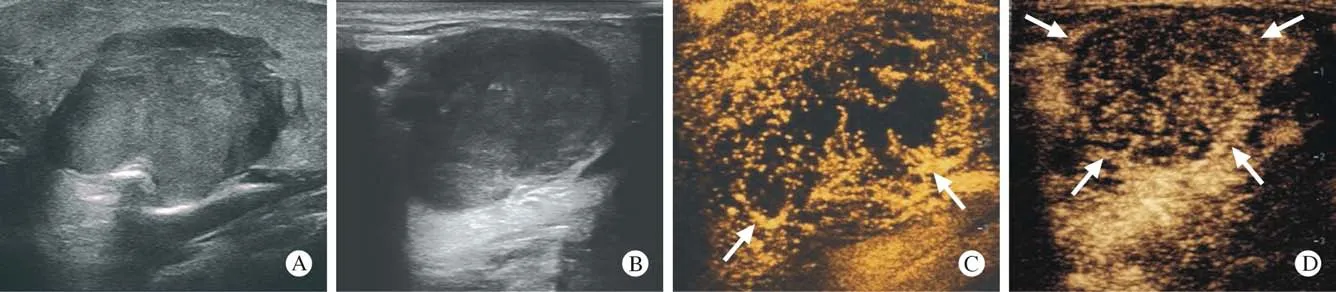
图1 腮腺内ACC和PA的常规超声和超声造影图像A:腮腺内ACC常规超声图像;B:腮腺内PA常规超声图像;C:腮腺内ACC超声造影达峰时表现,局部边界不清,箭头所示病灶边缘异常血管结构;D:腮腺内PA超声造影达峰时表现,箭头所示病灶边界清楚Fig.1 Conventional ultrasound and contrast-enhanced ultrasound images of ACC and PA in the parotid glandA: Routine ultrasound image of ACC in the parotid gland; B: Routine ultrasound image of PA in the parotid gland; C: The peak of ACC ultrasound contrast in the parotid gland, the local boundaries are unclear, abnormal vascular structure at the edge of the lesion is shown by the arrow; D: Peak performance of PA ultrasound in parotid glands, the border of the lesion shown by the arrow is clear
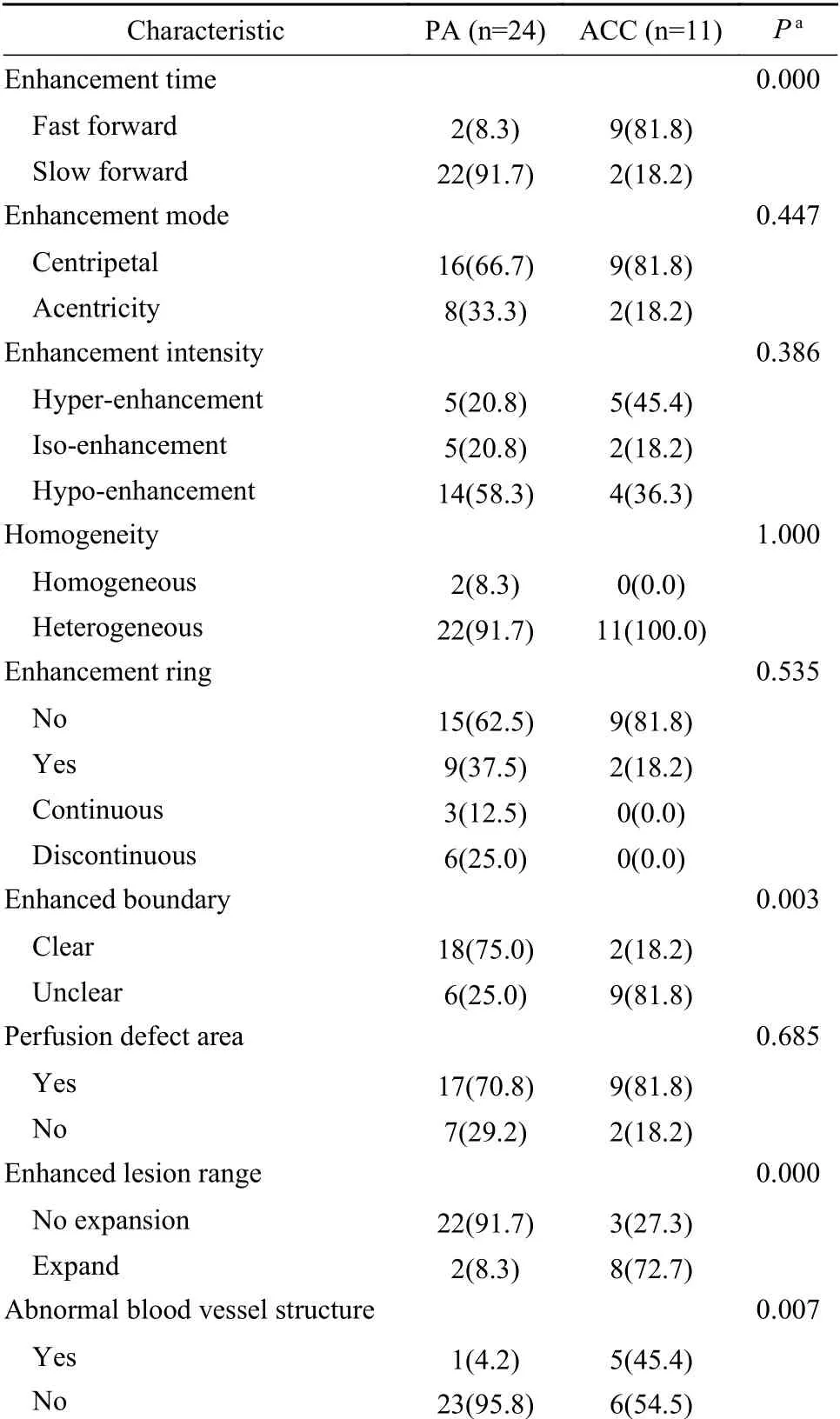
表2 涎腺ACC和PA超声造影结果比较(n,%)Tab. 2 Contrast-enhanced ultrasound of ACC and PA in salivary glands (n,%)
4超声造影参数比较 涎腺ACC的TTP为(9.97±0.68)s,短于PA的(11.77±2.41) s (P<0.05);其DT/2(35.62±4.93) s明显高于PA的(23.68±7.58)s(P<0.05)。两组PI差异无统计学意义(P>0.05)。见表3。

表3 涎腺ACC和PA超声造影参数对比Tab. 3 Comparison of ACC and PA ultrasound contrast parameters of salivary glands
5两种方法的诊断性能比较及ROC曲线分析1)常规超声:11例ACC样本中,9例被正确发现(确诊涎腺ACC),即敏感度为0.818;24例PA样本中,17例被正确发现(排除涎腺ACC),特异性为0.708;全部35例样本中,被正确诊断的病例数为26例,准确度为0.743(26/35)。对应的ROC分析曲线见图2。2)超声造影特征联合应用:联合应用增强时间、增强边界及增强后病灶范围诊断涎腺ACC的敏感度、特异性及准确度分别为0.909(10/11)、0.833(20/24)、0.857(30/35),对应的ROC分析曲线见图2。
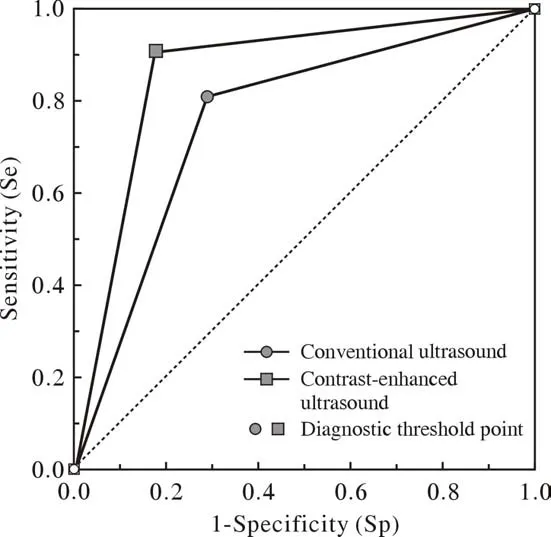
图2 常规超声及超声造影鉴别涎腺腺样囊性癌与多形性腺瘤的ROC曲线Fig.2 ROC curves of conventional ultrasound and CEUS in differential diagnosis of ACC and PA
讨 论
涎腺肿瘤分类烦杂,以上皮细胞性良性肿瘤多见,其中80%为PA(又称混合瘤),占涎腺肿瘤的65%[7]。涎腺ACC约占涎腺肿瘤的14.5%,恶性涎腺肿瘤的40%,是发病率较高的恶性肿瘤,早期临床表现类似PA,随着疾病的渐进性发展,易发生局部浸润、侵入血管,造成血运转移[8-10]。文献报道80% ACC术前针吸细胞学检查误诊为PA[11]。因此,提高ACC超声诊断的准确率,对早期发现ACC、减少误诊有一定的帮助。
常规超声检查主要依靠边界、形态、内部回声及血流丰富程度等鉴别诊断涎腺良恶性肿瘤[12],但对涎腺ACC的诊断特征存在争议[13-14]。本研究中大部分ACC边界清晰(72.7%)、Ⅰ~Ⅱ级血流(54.5%),具有部分良性肿瘤的特征。大部分PA形态不规则(75%)、内部回声不均匀(75%)。故常规超声鉴别诊断ACC与PA存在一定困难。PA由上皮组织、黏液样或软骨样间质混杂组成,呈膨胀性生长,肿瘤长入周围腺体内或穿破包膜形成瘤结节[15-16]。ACC病理组织分为管状型(无实性成分)、筛状型(实性成分<30%)及实性型。管状型肿瘤形态较规则,较少出现浸润及转移。筛孔和实体型肿瘤形态不规则,易出现周围浸润和转移[17]。另有研究表明ACC彩色多普勒显示率仅为33.3%,血流信号少量或中等[14],与本研究相符。
超声造影技术可以增强病变血管对比度,TIC曲线能显示肿瘤血管内的造影剂强度随时间的变化,通过评估肿瘤内微血管的丰富程度、血流动力学特征及灌注模式,可为肿瘤性质的判定提供新的信息[18-19]。本研究中涎腺ACC和PA均以不均匀性增强伴灌注缺损为主,均可表现为低增强或高增强。PA组织学表现多样性,故增强多不均匀,上皮组织丰富者多为高增强,黏液样、软骨样及透明样间质丰富者多为低增强[15]。ACC管状型、筛孔型及实体型细胞密度和微血管密度(microvessel density,MVD)计数依次增加,恶性程度逐渐增高,肿瘤细胞可形成腺样或囊状结构,间质可见黏液及玻璃样变性。同时瘤内组织纤维化、坏死程度不同、血管局部丰富程度不一,影响造影剂灌注[9,17,20-21]。故增强不均匀、增强强度不一。但周玲燕等[13]的报道中涎腺ACC均为高增强,可能与病例选择偏倚以及判断增强强度方法不同有关(本研究采用TIC定量分析法)。
本研究中涎腺ACC与PA的增强边界、增强后病灶范围差异明显,可作为鉴别诊断的依据。病理研究显示PA包膜情况不定,肿瘤与周围组织界限清楚,涎腺ACC与周围组织分界清,无包膜,但呈浸润性生长,破坏正常组织血管网,故增强后边界不清、范围扩大[22]。蒋丽萍等[6]认为涎腺肿瘤以非向心性增强为主,向心性增强是PA特征性超声造影表现。苟加梅等[5]则持相反观点。本研究中9例(81.8%)涎腺ACC、16例(66.7%)PA呈向心性增强,与后者相符。研究结果不一致可能因为前者病例中恶性肿瘤组未纳入ACC。肿瘤边缘区血管较密集,而中央区血管较稀疏可能是形成向心性增强的原因。苟加梅等[5]研究结果显示,涎腺大部分良性肿瘤有完整的增强环(肿瘤膨胀性生长压迫周围组织形成假包膜或自身包膜),可与恶性肿瘤鉴别。但本研究中仅9例(37.5%)PA有环状增强(3例连续,6例不连续)。笔者考虑有以下原因:1)部分PA体积大,包膜受压变薄或消失;2)部分PA(以上皮样成分为主型)易出现包膜浸润或不完整[16];3)部分PA无包膜(以黏液性为主型多见),与周围正常组织分界不清[22]。本研究中6例PA边界不清晰,常规病理均提示无包膜;4)部分病灶位于浅叶或囊变区较大,受侧边声影、后方回声增强及近场无法聚焦等因素影响不利于病灶边界的观察。故需继续充实样本进一步研究。本研究发现涎腺ACC与PA增强时间差异较大,分别表现为快进(81.8%)、慢进(91.7%),与相关报道一致[13,23]。恶性肿瘤受血管因子的诱导,大量新生血管形成,血管分布杂乱、形成动-静脉瘘,故造影剂进入快。联合应用增强时间、增强边界及增强后病灶范围鉴别诊断涎腺ACC与PA的敏感度、特异性及准确度为90.9%、83.3%、85.7%,但ACC超声造影特征仍缺乏对不同恶性肿瘤的特异性,需与其他恶性肿瘤鉴别。
杨嘉嘉等[24]发现肿瘤边缘有1条向内部走行的条状血流(Ⅱ级血流),认为此征象对提示ACC可能有一定作用。本研究有类似的发现,5例ACC增强后病灶边缘有1条或以上增粗并向内部走行的血管结构,推测自病灶边缘穿入的异常血管结构对诊断ACC可能有一定帮助。这可能与该肿瘤易侵入血管的生长特性有关,ACC新生血管网非常丰富,微血管密度常位于浸润的前缘,形态呈芽状、细索状甚至球状血管丛[21]。
采用绘制超声造影TIC曲线定量分析法比较发现ACC的TTP短于PA[(9.97±0.68) s、(11.77±2.41) s]、DT/2长于PA[(35.62±4.93) s、(23.68±7.58) s](P<0.05),与Zheng等[25]报道涎腺ACC的MRI动态增强TIC表现为典型的上升-平台型,即对比剂流入快、流出较慢,PA表现为持续上升型相似。
综上所述,CEUS增强特征和TIC曲线定量分析在鉴别不具有典型常规超声特征的涎腺ACC与PA时可以提供有价值的诊断信息,从而提升超声鉴别诊断的准确率,有利于术前选择合适的治疗方案,具有一定的临床应用价值。

