重症监护病房中急性肾损伤患者发生急性呼吸窘迫综合征及不良预后的相关危险因素分析
饶雪敏,冯 哲,陈香美
解放军总医院第一医学中心 肾脏病医学部 解放军肾脏病研究所 肾脏疾病国家重点实验室 国家慢性肾病临床医学研究中心 肾脏疾病研究北京市重点实验室,北京 100853
急性肾损伤(acute kidney injury,AKI)是指突发和持续的肾功能突然下降,住院患者AKI的发病率约18%,ICU患者AKI发病率约57%,AKI相关死亡率约27%[1-2]。有研究表明,AKI是急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的危险因素,并且当AKI患者合并ARDS时,患者死亡率增加2~3倍[3-4]。许多基础研究表明AKI可能通过炎症反应、固有免疫反应、氧化应激、细胞凋亡和水/尿毒素清除受损等途径引起肺损伤[5-7]。本研究通过回顾性分析重症病房中AKI患者发生ARDS及预后的相关因素,为AKI患者发生ARDS和不良预后提供预警,并为探索AKI导致肺损伤的机制提供启示。
资料与方法
1资料 本研究为单中心回顾性病例对照研究。选取2013年1月1日-2020年1月1日在解放军总医院第一医学中心重症监护病房住院的AKI患者。纳入标准:1)年龄>14岁;2)住院时间>24 h;3) AKI发生早于ARDS。排除标准:1)维持性血液透析;2) CKD 5期;3)肾移植。AKI的诊断和分期标准根据2012年改善肾病全球预后组织(KDIGO)临床实践指南,诊断标准:1) 48 h内血肌酐(serum creatinine,Scr)升高超过26.5 µmol/L(0.3mg/dL);2)Scr升高超过基线1.5倍、确认或推测7 d内发生。分期标准:1期,Scr较基线增高1.5~1.9倍,或Scr升高≥26.5 µmol/L(0.3mg/dL),或尿量<0.5 mL/(kg · h)达6~12 h;2期,Scr较基线增高2.0~2.9倍,或尿量<0.5 mL/(kg · h)超过12 h;3期,Scr较基线≥3.0倍,或Scr升高 ≥353.6 µmol/L(4mg/dL),或接受肾替代治疗,或尿量<0.3 mL/(kg · h)超过24 h,或无尿超过12 h。ARDS诊断标准根据2012年柏林定义:在已知的临床损伤或新的/恶化的呼吸道症状后1周内出现不能完全用心力衰竭或液体过多解释的呼吸衰竭,表现为PaO2/FiO2≤300mmHg (1mmHg=0.133 kPa),伴双侧肺部影像改变。本研究通过解放军总医院伦理委员会审查(伦审第S2020-234-02号)。
2分组与研究方法 1)研究分组:一是根据是否发生ARDS,对病例进行分组。二是根据是否发生不良预后(定义为住院死亡或出院时未脱离机械通气伴应用血管活性药物维持循环),对病例进行分组。2)研究分析指标及方法:分析AKI患者发生ARDS及不良预后的危险因素。本研究中血管活性药物定义为收缩血管的药物,包括肾上腺素、去甲肾上腺素、多巴胺、多巴酚丁胺等。急性肾损伤或急性肾衰竭的病因分为肾前性、肾性和肾后性三大类。肾前性:由肾灌注减少导致肾小球滤过率降低引起,常见原因有大出血、充血性心力衰竭、肝硬化失代偿期、肾动脉狭窄等;肾性:有肾单元的结构如肾小球、小管、血管或间质受到影响,如血管炎、恶性高血压、急性肾小球肾炎、急性间质性肾炎、肾小管坏死等;肾后性:由泌尿系统被内源性或外源性的肿块阻塞引起[8]。同时存在两种或以上病因者在本研究中归类为混合性。临床结局随访至患者出院。
3统计学分析 采用SPSS22.0统计软件。计量资料正态性检验采用Q-Q正态概率图,正态分布者以表示,两组间比较采用独立样本t检验,非正态分布的连续变量以中位数和四分位数间距表示,两组间比较采用Mann-WhitneyU检验;分类变量用例数(百分比)表示,率或构成比的两组或多组间比较采用χ2检验,有序多分类资料采用Mann-WhitneyU检验。单因素logistic回归分析各因素,将P<0.1的因素纳入多因素logistic回归,评价各指标的独立预测价值。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
1ARDS组与非ARDS组临床资料比较 纳入患者共256例,ARDS组154例,非ARDS组102例。ARDS组中位年龄62(45~74)岁,男性103例(66.9%),非ARDS组中位年龄62(36~80)岁,男性67例(65.7%)。ARDS组饮酒史、肺部感染、急性胰腺炎和应用血管活性药物的比例更高(P<0.05),心力衰竭的比例更低(P<0.05)。两组性别、年龄、体质量指数(body mass index,BMI)、入院体温、平均动脉压(mean arterial pressure,MAP)、吸烟史均无统计学差异。两组其他指标均无统计学差异。见表1。

表1 ARDS组与非ARDS组人口统计学资料和临床特征比较Tab. 1 Demographic and clinical characteristics of the ARDS group and the non-ARDS group
2正常出院组与不良预后组临床资料比较256例中,正常出院组92例,不良预后组164例。不良预后组中位年龄65(50~79)岁,正常出院组中位年龄56(31~70)岁,两组差异有统计学意义(P<0.05)。不良预后组入院体温、呼吸频次更低,并发休克、肿瘤更多,两组差异有统计学意义。不良预后组AKI 3期患者更多,血管活性药物应用率更高,中位住院时间更短,两组差异有统计学意义。不良预后组BMI、MAP更低,并发急性胰腺炎更少,合并冠心病更多(P<0.1)。两组的其他指标差异无统计学意义。见表2。

表2 不良预后组和正常出院组人口统计学资料和临床特征比较Tab. 2 Comparison of demographic and clinical characteristics between the two groups with different prognosis
3AKI患者发生ARDS的危险因素logistic回归分析 建立非条件逻辑回归模型,以发生ARDS为因变量,赋值1=发生ARDS,0=未发生ARDS。以单因素logistic回归分析中P<0.10的指标为自变量,共7个。经临床和统计人员协商,将具有较大临床意义的2个变量——中性粒细胞百分比和白细胞介素-6纳入自变量。中性粒细胞百分比按数值等分为三层,赋值0为<0.77,1为0.77~0.89,2为>0.89。将以上9个自变量行共线性诊断,各自变量间均无共线性。回归过程:采用基于最大似然估计的向前逐步回归法,进行自变量的筛选,设定α剔除=0.10,α入选=0.05。回归结果:共有AKI分期、AKI病因、应用血管活性药物和心衰4个变量保留在回归方程,均满足P<0.05。提示AKI3期、肾性AKI和应用血管活性药物是发生ARDS的独立危险因素,其OR值均在3.72以上,其中肾性AKI的OR值最大,为6.00。心衰的OR值小于1,考虑与入选病例时排除单纯心衰引起的呼吸衰竭有关。见表3。

表3 AKI患者发生ARDS的危险因素分析Tab. 3 Risk factors associated with ARDS in the patients with AKI
4AKI患者不良预后的独立危险因素logistic回归分析 建立非条件逻辑回归模型,以发生不良预后为因变量,赋值1=不良预后,赋值0=正常出院。以单因素logistic回归分析中P<0.10的指标为自变量,共13个。中性粒细胞百分比赋值如第三部分结果所述。经临床和统计人员协商,将具有较大临床意义的变量——淋巴细胞百分比纳入为自变量。将以上14个自变量行共线性诊断,各自变量间均无共线性。回归过程:采用基于最大似然估计的向前逐步回归法,进行自变量的筛选,设定α剔除=0.10,α入选=0.05。回归结果:共有年龄、休克、AKI分期、入院体温和ICU住院时间5个变量保留在回归方程,P均<0.05。提示年龄、休克、AKI3期是不良预后的独立危险因素。年龄OR值1.02,休克OR值3.12,AKI 3期OR值3.44。不良预后组入院体温更低(OR=0.66),考虑与免疫应答能力低相关,ICU住院时间(OR=0.99)更短,与早期死亡率高有关。见表4。
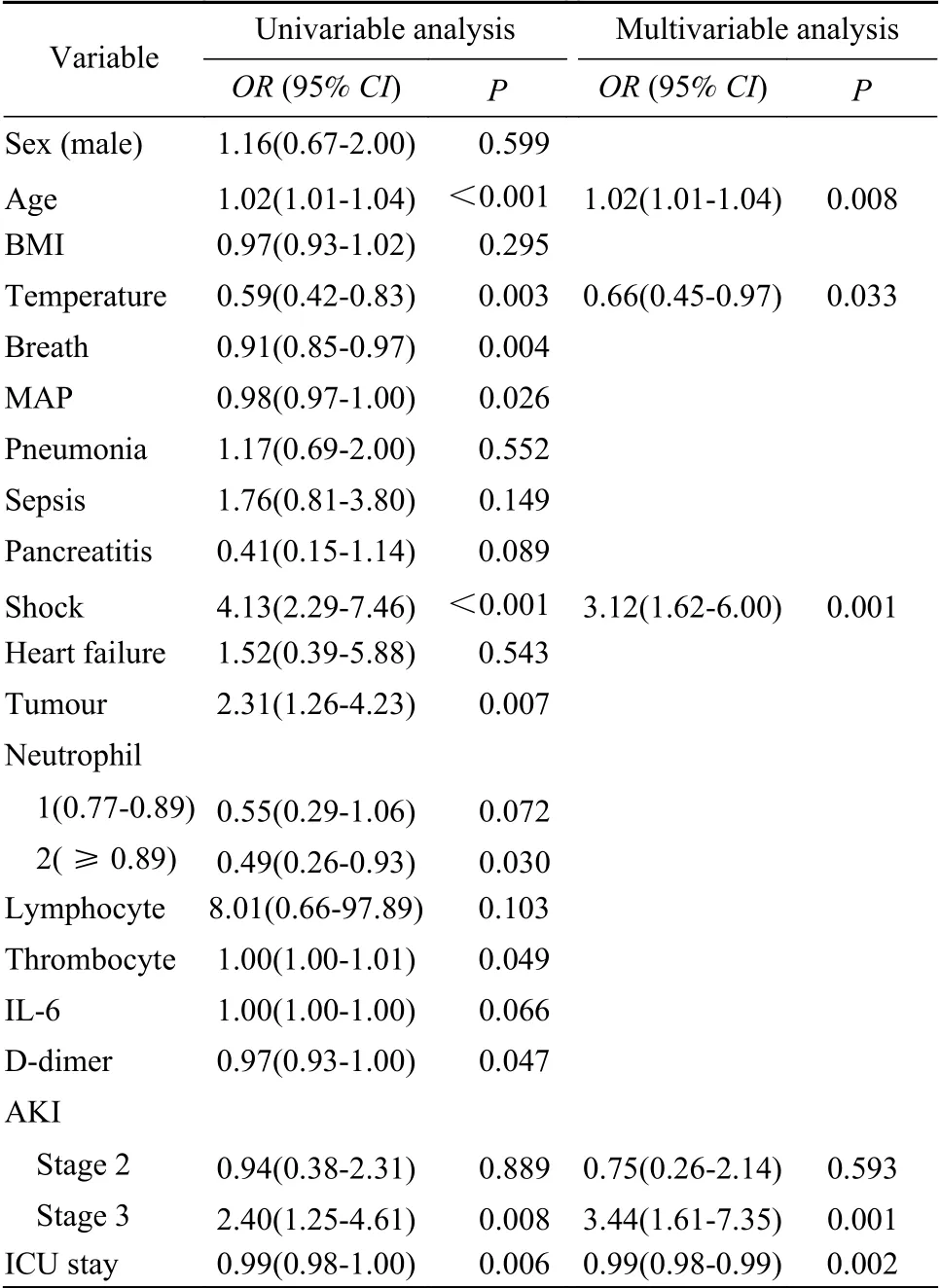
表4 AKI患者发生不良预后的相关危险因素分析Tab. 4 Risk factors associated with adverse outcomes in the patients with AKI
讨 论
AKI是ICU患者常见并发症,研究表明AKI患者较非AKI患者呼吸衰竭或肺损伤风险更高,当AKI患者发生ARDS或需要机械通气时,死亡率显著增加,并消耗更多的医疗资源[2,9]。因此,早期识别AKI患者发生ARDS的危险因素,及早干预治疗,对改善患者预后具有重要意义。
本研究发现,在重症病房AKI患者中,AKI的严重程度和病因与ARDS的发生相关。ARDS组AKI 3期患者占84%,而非ARDS组AKI 3期患者占46%。ARDS组肾性AKI约占66%,非ARDS组约占27%。既往研究表明AKI是肺损伤的危险因素[10]。AKI通过改变pH或水电解质平衡、产生炎症介质、减少代谢毒素的排泄等机制诱发肺脏损伤[11]。本研究支持这一论点,且结果表明严重的AKI更易诱发ARDS和不良预后。一方面可能因为3期AKI患者肾小管损伤坏死加重,释放炎症介质,激活炎症反应,甚至激发全身炎症反应综合征或炎症因子风暴,通过血液循环,炎症介质侵犯肺部血管,引起肺损伤,甚至进展为多器官功能障碍综合征[12]。另一方面,3期AKI患者肾小球滤过率下降明显,体内水与尿毒素等代谢产物排出减少,诱发肺水肿[10]。肾性AKI包括肾血管疾病、缺血和中毒性肾小管坏死(手术、创伤、抗生素、抗肿瘤药物、造影剂、中毒、肌红蛋白等)、急性间质性肾炎(过敏、感染、肿瘤等),这些相关危险因素引起或加重AKI,进而激发免疫炎症反应,引起肺内皮细胞和上皮细胞凋亡,下调肺泡上皮细胞水钠通道、Na-KATP酶,破坏肺微血管屏障,引起肺损伤[13-16]。有基础研究表明AKI通过坏死性炎症诱发肺损伤也是一个潜在途径[17-18],本研究中ARDS组中性粒细胞比例有升高趋势,但无统计学差异,考虑可能与样本量较少有关。
ARDS组心衰患者比例较低,考虑与纳入患者时将单纯心衰相关的ARDS排除有关。本研究中血管活性药物主要包括肾上腺素、去甲肾上腺素、多巴胺、多巴酚丁胺。应用血管活性药物可加重肾缺血。有研究表明去甲肾上腺素对血压的复苏加剧了髓质的低灌注和缺氧,菌血症时去甲肾上腺素可能导致肾血流受损,诱发或加重AKI,从而引起ARDS[19-21]。有动物试验发现儿茶酚胺输注72 h可能引起肺重构,这些过程主要是α-肾上腺素能机制,表明肾上腺素能机制可能在以水肿为特征的肺损伤的发病过程中有重要作用[22-24]。
本研究发现,不良预后组的中位年龄较正常出院组大9岁,高龄患者的脏器基础功能更差,免疫应答能力也较弱,更容易发生不良预后。正常出院组患者年龄小,免疫应答能力更强,入院体温更高。休克引起各脏器缺血,损伤心肺肾等功能,进而影响患者的预后[25]。不良预后组的中位ICU住院时间更短,考虑与不良预后组的早期死亡率更高相关。
本研究存在一些不足:首先,本研究纳入人群为单中心ICU中的AKI患者,研究人群比较局限,研究结论在其他中心的适用性有待验证;其次,本研究为回顾性研究,研究资料的收集分析只能在现有资料的基础上进行,可能会缺失部分重要的信息,如呼吸机的参数。下一步研究计划纳入多中心患者,开展前瞻性研究,动态分析AKI患者一般临床资料、血液、尿液新型标志物及生命支持治疗等与ARDS的作用关系。
综上所述,在重症病房中,AKI 3期、肾性AKI和应用血管活性药物为ARDS发生的独立危险因素。不良预后组入院体温更低。年龄、休克、AKI 3期为患者不良预后的独立危险因素,可对患者预后起预警作用。不良预后组患者ICU的早期死亡率更高,ICU住院时间更短。

