化学必修二考点演练
■尉言勋
一、选择题:共15小题,每题只有一个选项符合题意。每小题2分,共30分。
1.疫情尚未结束,个人预防措施不能松懈。下列说法错误的是( )。
A.每天最好用肥皂洗手,肥皂是由高分子化合物油脂在碱性条件下水解得到的
B.每天可以用“84”消毒液对环境消毒,但“84”消毒液不能与洁厕灵混用
C.出门要戴口罩,口罩原料无纺布成分是聚对苯二甲酸乙二醇酯,属于合成纤维
D.可以用75%的酒精对手机、键盘和皮肤消毒,原理是酒精可以使蛋白质变性
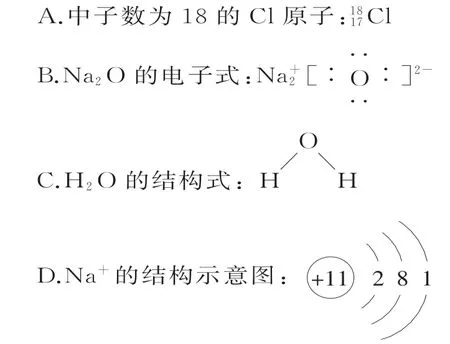
2.用化学用语表示反应Na2O+2HCl==2NaCl+H2O中涉及的相关微粒,其中正确的是( )。
3.某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成HmX分子。在agHmX中所含质子的物质的量是( )。
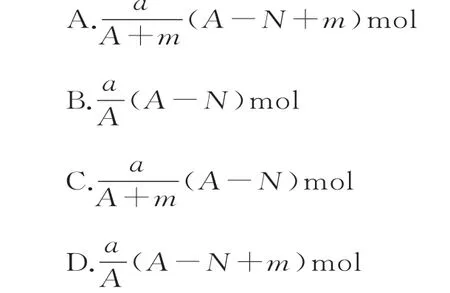
4.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图1所示。下列说法不正确的是( )。
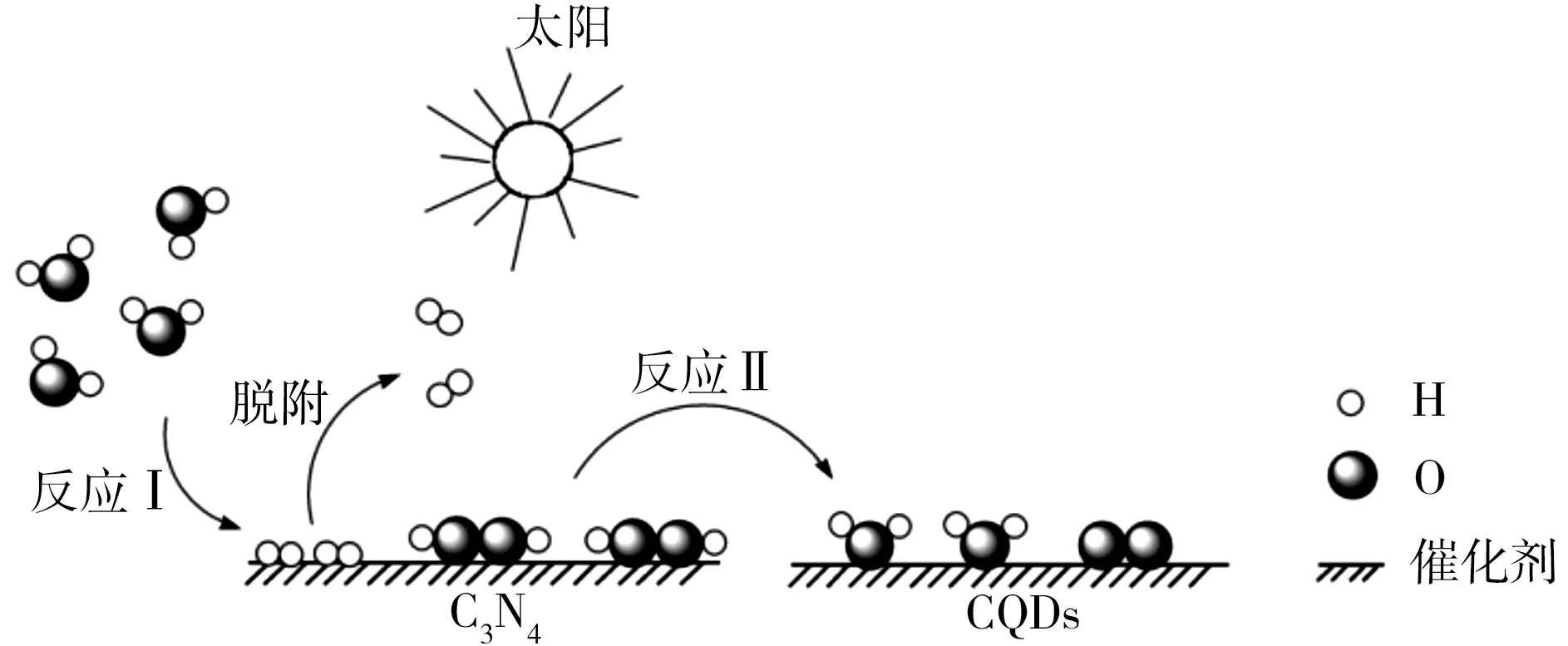
图1

A.位于第四周期ⅤA族
B.属于非金属元素
C.x=8
D.最高正价为+5价
6.用NA表示阿伏加德罗常数的值。下列有关说法不正确的是( )。
A.在标准状况下,5.6L乙烯中所含极性共价键的数目为NA
B.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2NA
C.8.0g甲烷与氯气反应时生成的HCl分子数最多为2NA
D.7.8g苯所含碳碳双键数目为0.3NA
7.下列反应中,属于加成反应的是( )。
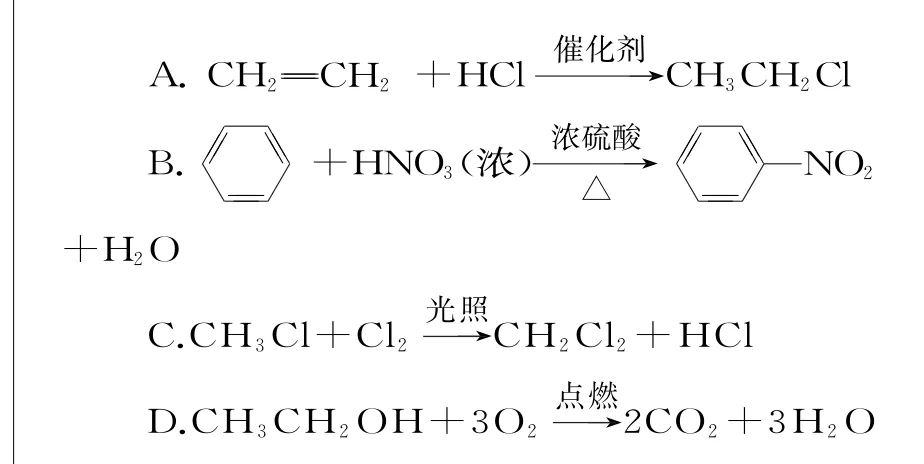
8.糖类、油脂、蛋白质都是饮食中常见的有机化合物,下列说法正确的是( )。
A.棉花、蚕丝、羊毛都是天然纤维,其主要成分都是纤维素
B.淀粉和纤维素的化学式都是(C6H10O5)n,二者互为同分异构体
C.碘遇淀粉变蓝,可以用KI溶液鉴别淀粉溶液和蛋白质溶液
D.油脂在一定条件下能水解生成高级脂肪酸和甘油
9.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如表1所示,由此可判断这四种金属的活动性顺序是( )。
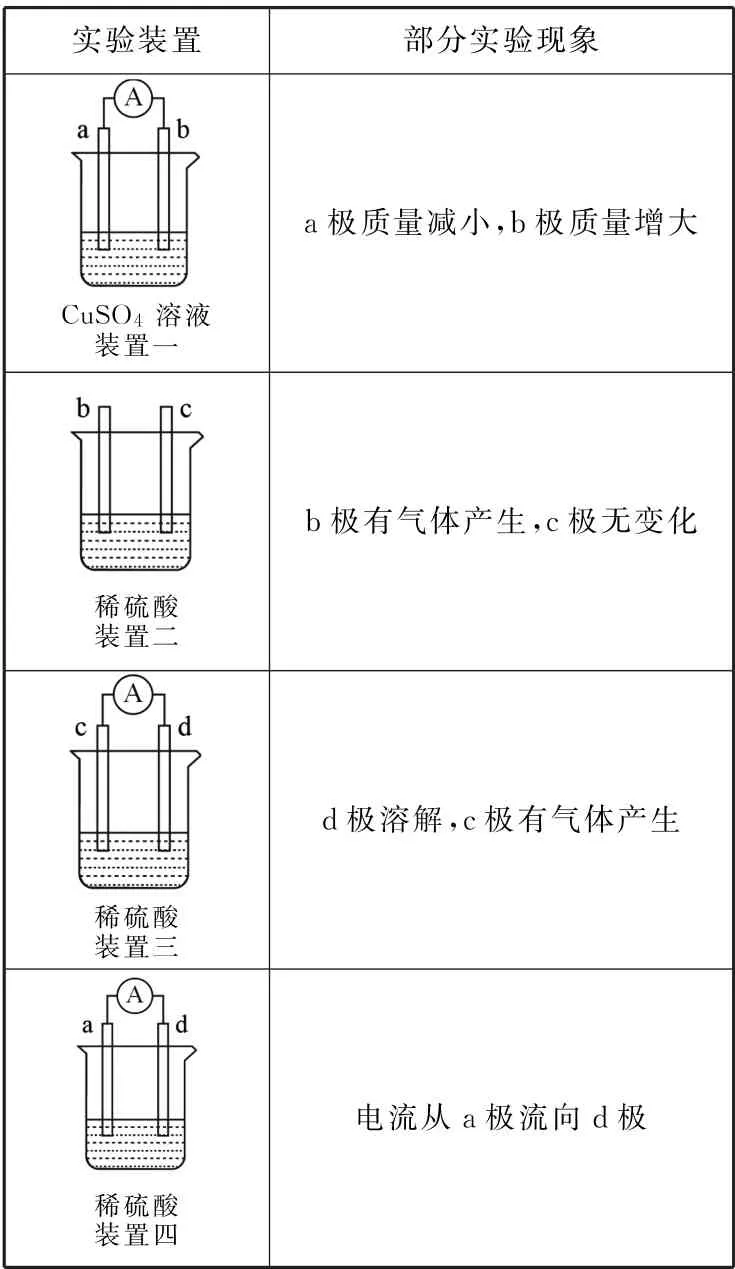
表1
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
10.反应4A(s)+3B(g)==2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )。
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.若改变条件,2min内v(D)=0.2mol·L-1·min-1,则反应速率减慢
11.下列实验装置或操作不能达到实验目的的是( )。
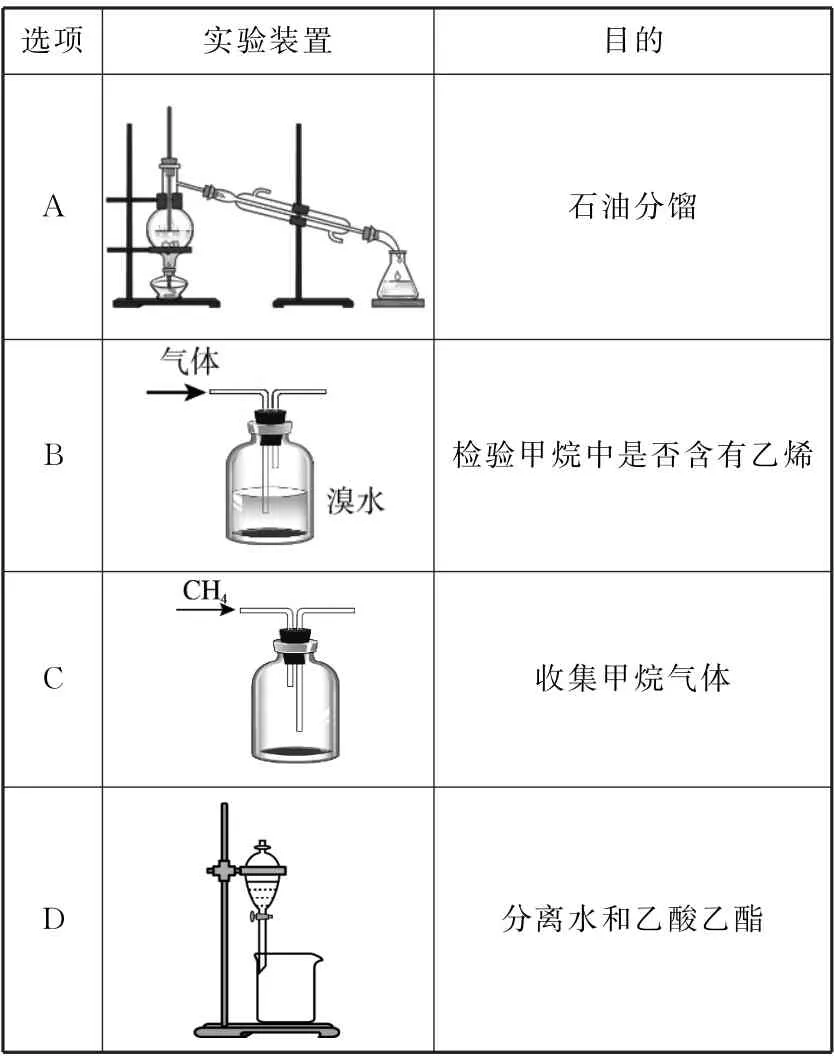
选项 实验装置 目的___________A images/BZ_44_1266_1183_1599_1394.png石油分馏B images/BZ_44_1299_1422_1565_1631.png检验甲烷中是否含有乙烯C images/BZ_44_1333_1654_1531_1850.png收集甲烷气体D images/BZ_44_1351_1884_1513_2119.png分离水和乙酸乙酯
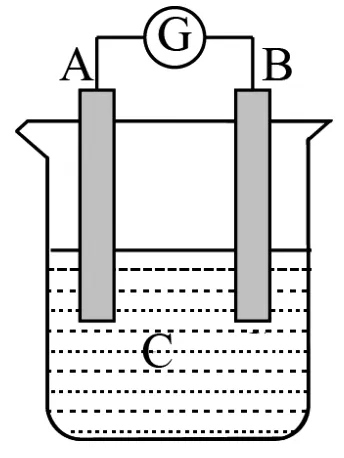
图2
12.如图2所示装置,检流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则( )。
A.A是Zn,B是Cu,C为稀硫酸
B.A是Ag,B是Fe,C为稀AgNO3溶液
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Cu,B是Zn,C为稀硫酸

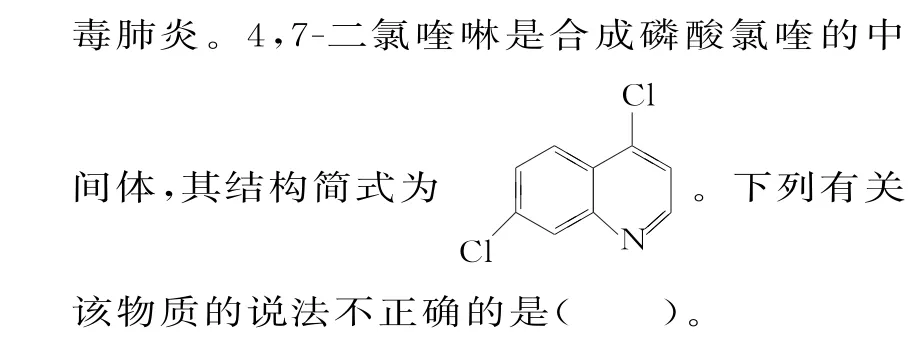
A.不属于烃
B.分子式为C9H6NCl2
C.分子中所有原子可能在同平面上
D.可发生取代反应
14.下列说法不正确的是( )。
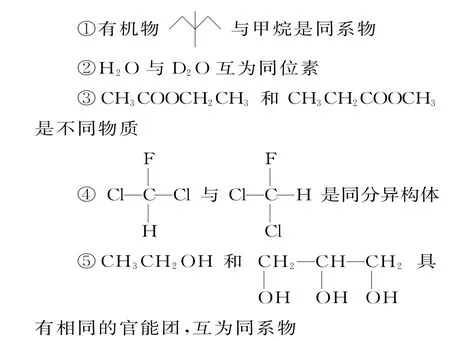
⑥5627Co、5727Co、5827Co、5927Co是同素异形体,其物理性质有差异,化学性质相同
A.②④⑤⑥ B.②③⑤⑥
C.①③⑤ D.全部
15.下列化学工艺流程不可行的是( )。
A.实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏

二、选择题:本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。
16.根据元素周期律,由下列事实进行归纳推测,推测合理的是( )。

选项 事实 推测________A 氨气易溶于水生成NH3·H2O磷化氢易溶于水生___________________________________成PH3·H2O B Si是半导体材料,同主族的_______Ge也是半导体材料第ⅣA族元素的单质都可作半导体材料____C HCl在1500℃时分解,HI_______在300℃时分解HBr的分解温度介于二者之间_________D H2Se的沸点比H2S的高 H2S的沸点比H2O___________________________________的高
17.在恒容绝热密闭容器中发生CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )。
①容器内混合气体的平均相对分子质量不再变化
②容器内气体的密度不再发生变化
③容器内气体的压强不再发生变化
④v正(NO)∶v逆(N2)∶v逆(CO2)=4∶2∶1
A.①②③ B.③④
C.①②③④ D.②③④
18.将有机物完全燃烧,生成CO2和H2O。将6g该有机物的完全燃烧产物先通过浓硫酸,浓硫酸增重3.6g,再通过碱石灰,碱石灰增重8.8g。则该有机物的分子式为( )。
A.C4H10B.C2H6O
C.C3H8O D.C2H4O2
19.根据如下所示的海水综合利用工业流程,判断下列说法正确的是( )。
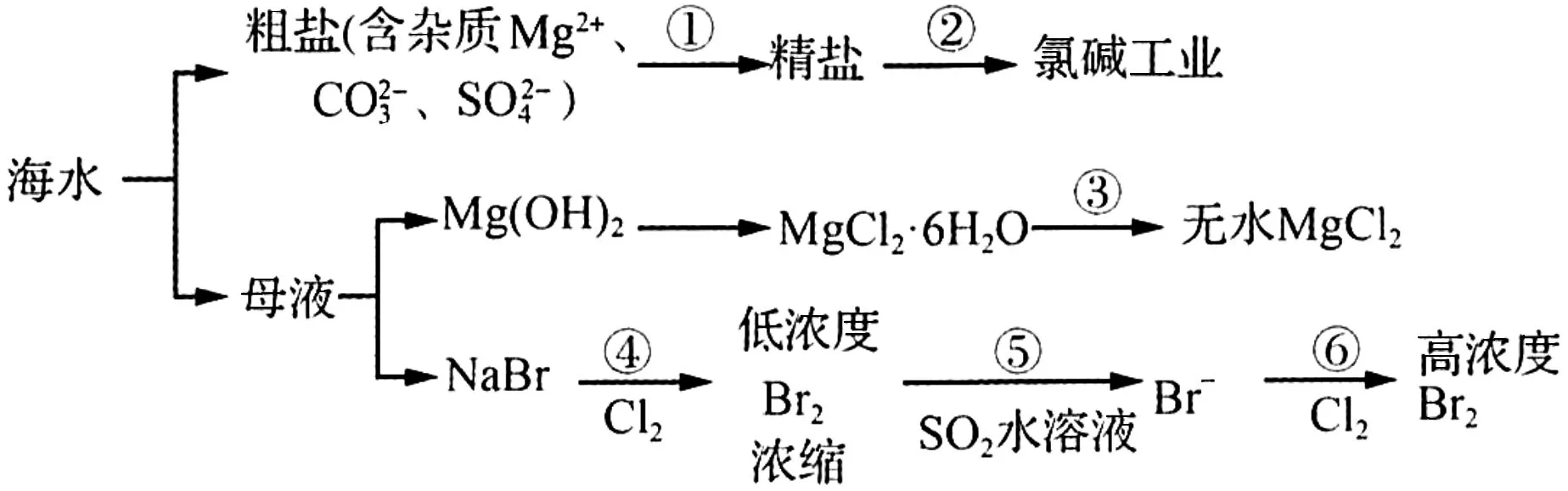
A.过程①的提纯是物理过程
B.电解饱和MgCl2溶液制取镁是由于镁是很活泼的金属
C.在过程④⑥反应中每氧化0.2molBr-需消耗2.24LCl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
20.T1℃时,向容积为2L的恒容密闭容器中充入SO2和O2,发生反应2SO2(g)+O2(g)2SO3(g),容器中各组分的物质的量随时间变化如图3所示。下列说法不正确的是( )。
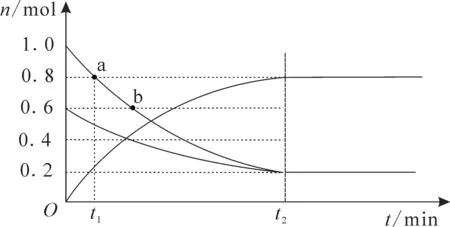
图3
A.a、b两点反应速率va>vb

C.t2时刻,向容器中充入一定体积的气体氦,则v正、v逆均不变
D.若反应在T2℃进行(T2<T1),反应进行t1min后,n(SO2)<0.8mol
三、填空题:共5小题,满分55分。
21.Ⅰ.图4是元素周期表的一部分,回答下列问题:
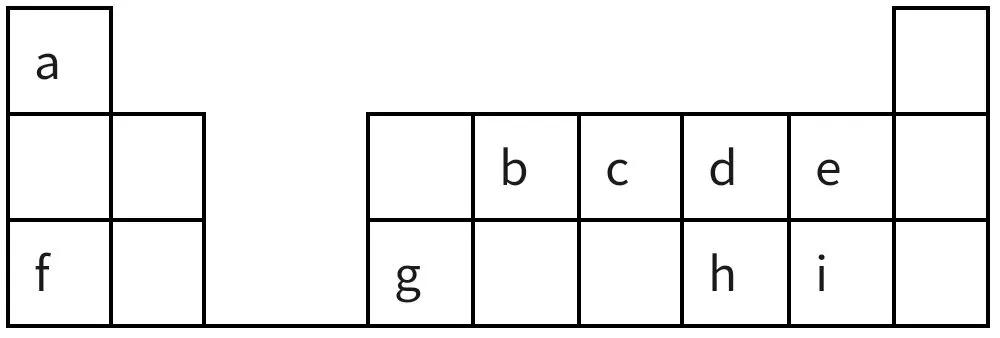
图4
(1)d、e、f对应简单离子的半径由大到小的顺序为____(用具体微粒符号表示)。
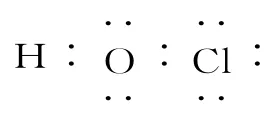
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式为_____。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式:___。
Ⅱ.(4)根据下列信息判断氢气燃烧生成水时的热量变化:
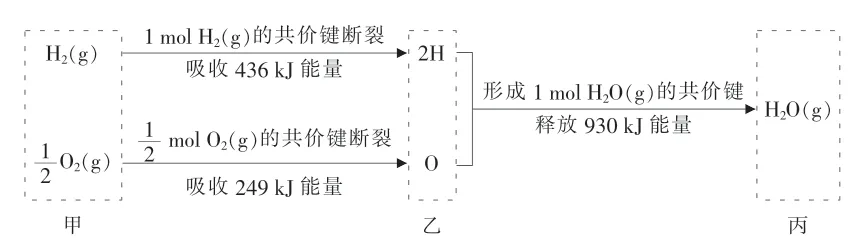
①H2(g)与O2(g)反应生成1mol H2O(g)时放出的热量为____kJ。
②甲、乙、丙中物质所具有的总能量由大到小顺序为____。
(5)铅蓄电池是最常见的二次电池,放电时的化学方程式为Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O。负极反应式为____,一段时间后,负极增重48g,转移电子数为_____mol。
22.海带中含有丰富的碘元素,某实验小组设计如下流程从海带中提取碘。
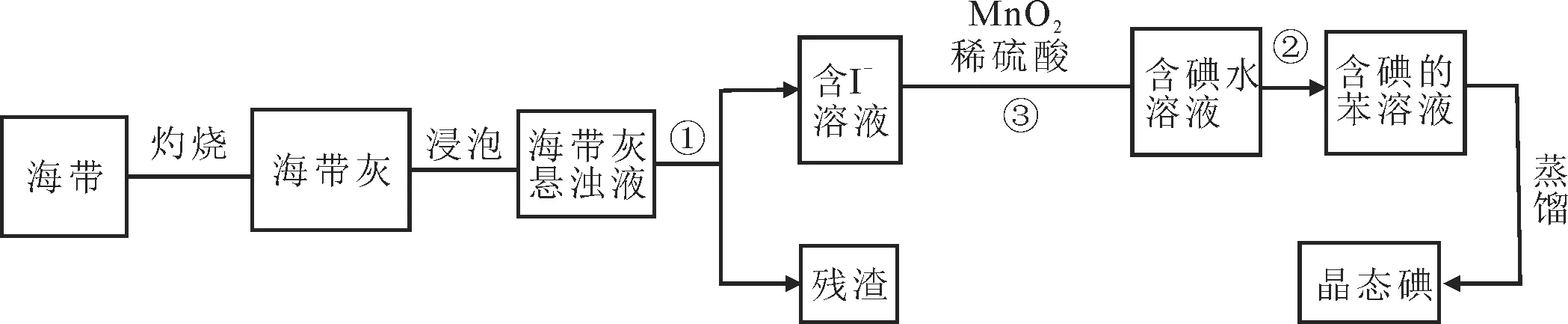
(1)灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是____(填字母)。
A.烧杯 B.蒸发皿 C.坩埚 D.试 管E.酒精灯
(2)提取碘的过程中有关的实验操作名称:①____,②____。
(3)②对应的离子反应方程式为____。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___。
(5)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,装置如图5所示。使用水浴的优点是____,最后晶态碘在____(填仪器名称)里聚集。

图5
23.乙烯是重要的有机化工原料,通过如下转化可制取某些常见有机物。
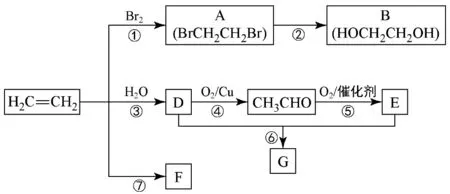
结合转化路线回答:
(1)反应④的化学方程式是_____。
(2)与A物质互为同分异构体的有机物的结构简式为____。
(3)F是一种高分子化合物,可用于制作食品袋,其结构简式为_____。
(4)G是一种油状、有香味的物质,有以下两种制法。
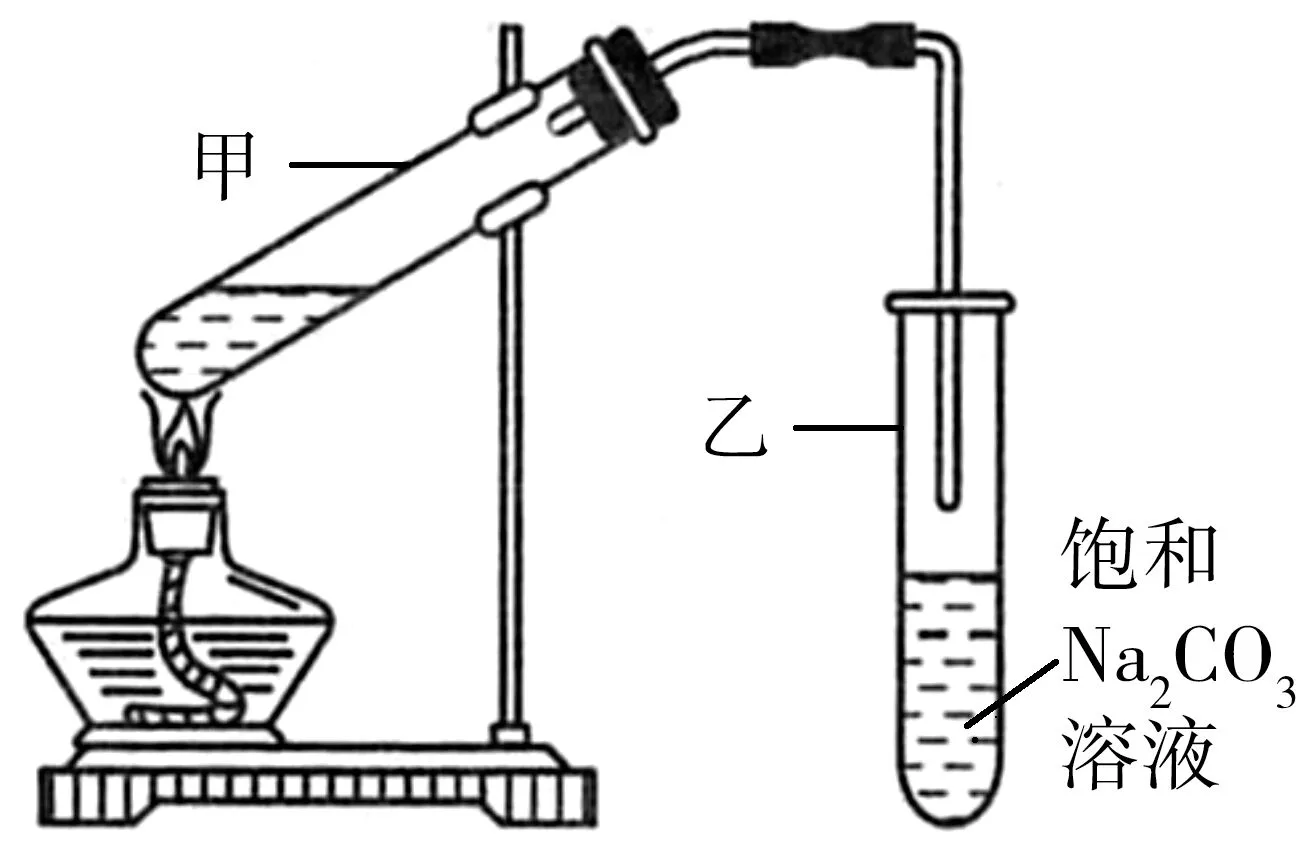
图6
制法一:实验室用D和E反应制取G,装置如图6所示。
①甲试管中加入反应混合物后,为了防止液体在实验时发生暴沸,在加热前应采取的措施是____。
②试管乙中饱和Na2CO3溶液的作用是_____。
③反应结束后,振荡试管乙,静置,观察到的现象是_____。
制法二:工业上用CH2=C H2和E直接反应获得G。
④该反应类型是____。
⑤与制法一相比,制法二的优点是_____。
24.H2与O2、F2均能发生反应,图7为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:

图7
(1)完成转化Ⅰ、Ⅱ____(填“吸收”或“放出”,下同)能量,完成转化Ⅲ____能量。
(2)H2和F2反应的能量变化图可用图8的_____(填“A”或“B”)表示。
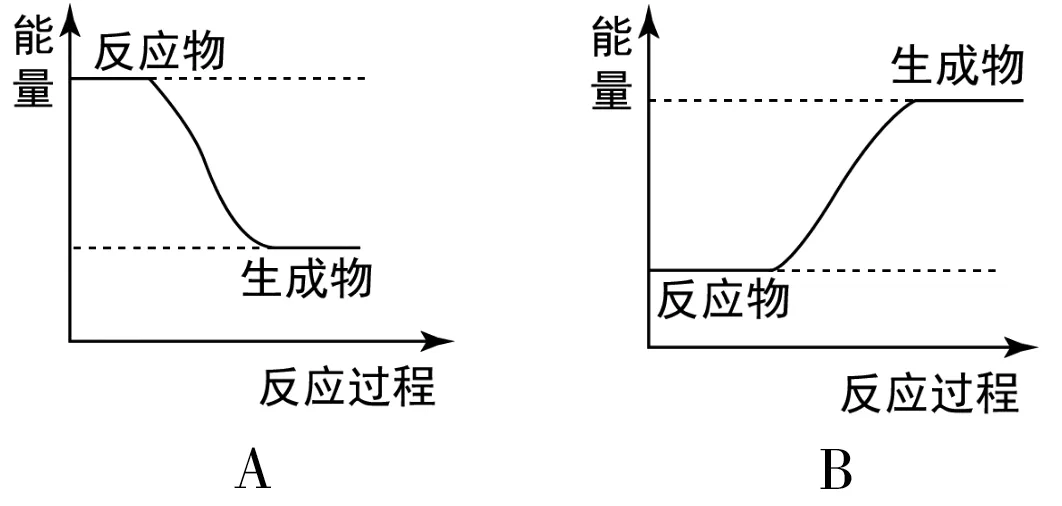
图8
(3)图9是宇宙飞船上使用的一种新型电池装置。A、B两个电极均由多孔的碳块组成,该电池正极的电极反应式为_____;若将该装置中的氢气换成甲烷,其余都不改变,对应装置的负极电极反应式为 。
25.一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化曲线如图10所示(其中C为有色气体)。

图10
(1)该反应的化学方程式为____。(2)用B表示的反应速率为____。
(3)下列条件改变时,能加快化学反应速率的是____(请填代号)。
A.扩大容器的容积 B.增大C的用量
C.降低体系的温度 D.加入催化剂
(4)该反应达到平衡状态的标志是_____。①2V(A)=V(B)
②单位时间内生成nmolB的同时生成2nmolA
③A、B、C的浓度之比为2∶1∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的平均相对分子质量不再改变
(5)该反应达到化学反应限度时,B的转化率为(请保留一位小数)。

1.A 提示:油脂不是高分子化合物。
2.C 提示:中子数为18的Cl原子的质


4.B 反应Ⅰ是水反应生成氢气与过氧化氢,涉及极性键的断裂和极性键、非极性键的形成。
5.C 提示:由于质子数等于核外电子数,故x=33-2-8-5=18。
6.D 提示:苯中不含有碳碳双键。
7.A 提示:碳碳双键与HCl发生加成反应得到氯乙烷,故A项正确;硝基取代苯环上的H原子,为取代反应,故B项错误;Cl原子替代H原子,为取代反应,故C项错误;乙醇燃烧生成水和二氧化碳,为氧化反应,故D项错误。
8.D 提示:棉花的成分是纤维素,羊毛、蚕丝的成分是蛋白质,故A项错误;淀粉和纤维素的化学式都是(C6H10O5)n,但聚合度不同,二者不是同分异构体,故B项错误;单质碘能使淀粉溶液变蓝,而I-不能使淀粉溶液变蓝,所以不能用KI溶液鉴别淀粉溶液和蛋白质溶液,故C项错误;油脂是高级脂肪酸的甘油酯,在酸性条件下可以水解生成高级脂肪酸和甘油,故D项正确。
9.C 提示:装置一,发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;装置二,发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;装置三,发生电化学腐蚀,d极溶解,是负极,c极有气体产生,是正极,所以金属的活动性顺序d>c;装置四,发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a。

11.A 提示:分馏时温度计测定馏分的温度,冷水“下进上出”,A项图中温度计水银球未在支管口处。
12.B 提示:该原电池中,A极逐渐变粗,B极逐渐变细,所以B作负极,A作正极,B的活泼性大于A的活泼性,所以排除A项和C项;A极逐渐变粗,说明有金属析出,D项析出氢气,B项析出金属,所以B项符合题意。
13.B 提示:由4,7-二氯喹啉的结构简式可知,其分子式为C9H5NCl2。


15.A 提示:海带中碘以离子存在,从海带中提取单质碘的工艺流程为取样→灼烧→溶解→过滤→氧化→萃取→蒸馏。
16.C 提示:氨气可与水分子间形成氢键,P的非金属性较弱,不能形成氢键,难以生成PH3·H2O,故A项错误;位于金属、非金属分界线附近的元素可作半导体材料,第ⅣA族碳单质不是半导体材料,故B项错误;同主族非金属氢化物稳定性依次减弱,HCl在1500℃时分解,HI在230℃时分解,HBr的分解温度介于二者之间,故C项正确;水分子间存在氢键,沸点最高,故D项错误。
17.B 提示:①该反应中混合气体的总质量和总物质的量为定值,则容器内混合气体的平均相对分子质量始终不变,不能据此判断平衡状态;②混合气体总质量、总体积为定值,则容器内气体密度始终不变,不能据此判断平衡状态;③该反应中气体总物质的量为定值,在恒容绝热密闭容器中温度为变量,根据PV=nRT可知,容器中压强为变量,当容器内气体的压强不再发生变化时,表明达到平衡状态;④v正(NO)∶v逆(N2)∶v逆(CO2)=4∶2∶1,表明正逆反应速率相等,该反应达到平衡状态。
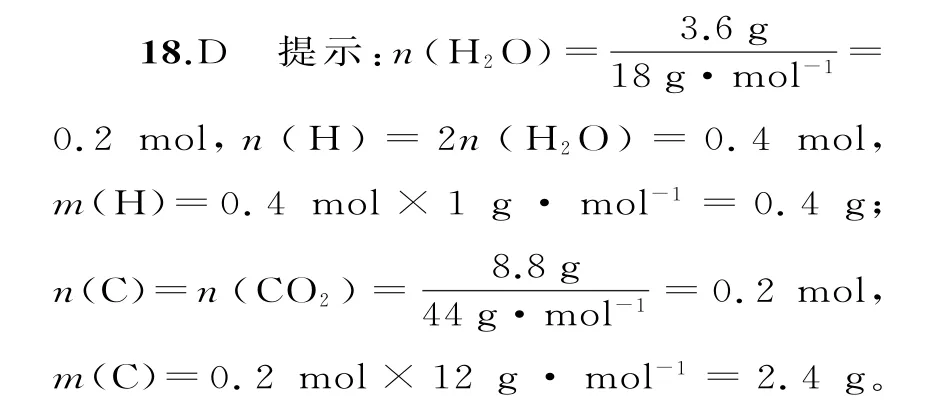

19.D 提示:过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程,故A项错误;电解饱和MgCl2溶液生成氢氧化镁,不能得到镁,应电解熔融的氯化镁,故B项错误;过程④⑥发生反应2Br-+Cl2==Br2+2Cl-,每氧化0.2molBr-需消耗0.1molCl2,但气体存在的条件未知,故C项错误;因Br2+SO2+2H2O==2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,故D项正确。

(3)H2-2e-+2OH-==2H2O
Ⅱ.(4)①245 ②乙>甲>丙
(5)Pb+SO2-4-2e-==PbSO41
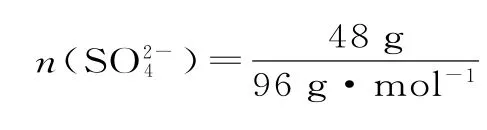
22.(1)C、E (2)过滤 萃取 (3)2I-+MnO2+4H+==Mn2++I2+2H2O (4)取少量提取碘后的水溶液于试管中,加入几滴淀粉溶液,若溶液变蓝,证明还有单质碘(5)受热均匀且温度升高慢,不会使碘升华蒸馏烧瓶

24.(1)吸收 放出
(2)A
(3)O2+4e-+2H2O==4OH-CH4-8e-+10OH-==CO2-3+7H2O
提示:(1)转化Ⅰ、Ⅱ分别为断裂FF、HH键,断裂旧的化学键需吸收热量,所以完成转化Ⅰ、Ⅱ吸收热量,转化Ⅲ为形成新的化学键HF,放出热量。(2)A图反应物的总能量高于生成物的总能量,为放热反应;B图反应物的总能量低于生成物的总能量,为吸热反应,H2和F2反应为放热反应,选A。(3)燃料电池的负极发生氧化反应,1mol氢气反应转移2mol电子,生成1mol水,正极氧气发生还原反应O2+4e-+2H2O==4OH-,氢气换成甲烷,负极为甲烷放电,电极反应式为CH4-8e-+10OH-==CO2-3+7H2O。
(2)0.0395mol·L-1·s-1
(3)B、D (4)②④ (5)65.8%
提示:(1)由图像可得,随反应进行B、C的物质的量减小,A的物质的量增大,所以B、C是反应物,A是生成物,10s后A、B、C的物质的量为定值,不为0,反应是可逆反应,且Δn(A)∶Δn(B)∶Δn(C)=(1.58-0)mol∶(1.20-0.41)mol∶(1.00-0.21)mol=2∶1∶1,参加反应的物质的物质的量之比等于化学计量数之比,故反应的化学方程式为B+C2A。(2)由图像可知,反应10s时,B的物质的量变化0.79mol,则A的反应速率为=0.0395mol·L-1·s-1。(3)一般来说,增大压强或浓度、升高温度、加入催化剂均可增大反应速率,B、D符合。(4)①2V(A)=V(B),不能说明正反应和逆反应的关系,故①错误;②单位时间内生成nmolB的同时生成2nmolA,说明正反应和逆反应速率相等,故②正确;③A、B、C的浓度之比为2∶1∶1,无法判断反应是否达到平衡,故③错误;④混合气体的颜色不再改变,C为有色气体,说明C气体的浓度不再改变,故④正确;⑤气体质量和容器体积始终不变,混合气体的密度也不会改变,无法判断是否平衡,故⑤错误;⑥气体质量和反应左右两边的气体系数始终不变,混合气体的平均相对分子质量也不会改变,无法判断是否平衡,故⑥错误。(5)该反应达到化学反应限度时,B消耗0.79mol,则转化率为

