RNAi介导的HvIAP1基因沉默对茄二十八星瓢虫存活和发育的影响
林妙金,郭木娟,潘 广,何诗淇,吴建辉,邱宝利,潘慧鹏*
(1. 华南农业大学,植物保护学院,广东省生物农药创制与应用重点实验室,广州 510642;2. 广州国家现代农业产业科技创新中心,广州 510520)
茄二十八星瓢虫Henosepilachnavigintioctopunctata属于鞘翅目瓢虫科,是茄科和葫芦科蔬菜上的重要害虫。茄二十八星瓢虫在全国各地分布,以长江以南地区发生和为害较为严重(涂小云和王国红,2010;周雷等,2014)。当前,茄二十八星瓢虫的防治主要依赖于化学杀虫剂,但是过量使用化学农药会使害虫产生抗药性,同时也会杀伤天敌以及传粉昆虫等有益生物(涂小云和王国红,2010),所以,迫切需要创制防治茄二十八星瓢虫的环境友好型的新方法。RNA干扰(RNA interference, RNAi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象(Fireetal., 1998)。以RNAi为基础的RNAi抗虫技术,通过干扰控制害虫发育或重要行为的关键基因,阻碍害虫正常的生长和繁殖,甚至直接导致害虫死亡,从而达到害虫防控的目的(Baumetal., 2007)。dsRNA在生物体内普遍存在,在环境中易降解,因此无毒、无残留,是一种新型绿色环保的害虫防控方法,展现出了广阔的应用前景。而获得高效安全的致死靶标基因是利用RNAi技术进行害虫防治的关键。近两年,本团队建立了茄二十八星瓢虫饲喂法RNAi的技术体系,在茄二十八星瓢虫中鉴定得到了几个致死能力较高的靶标基因,如HvvATPaseB(Lüetal., 2020a)、HvRPS18和HvRPL13(Lüetal., 2020b)、HvSnf7(Lüetal., 2020c)、HvvATPaseA和HvvATPaseE(Guoetal., 2021)、Hvlwr(Lüetal., 2021a)、HvαCOPI和HvγCOPI(Lüetal., 2021b)等。未来,一旦对RNAi抗性决定因素和抗性机制有了更好的了解,发现其他RNAi致死靶标基因将有助于基于RNAi技术的茄二十八星瓢虫防控技术的发展。
细胞凋亡是细胞程序性死亡,是细胞自杀的一种进化保守途径(Vauxetal., 1994)。在昆虫体内,激活和抑制细胞死亡之间建立了动态平衡,这一高度调控的过程涉及了许多基因和信号通路。细胞凋亡在昆虫的发育、组织稳态和天然抗病毒反应的许多过程中起着重要作用(Parthasarathyetal., 2008;Miuraetal., 2011)。凋亡抑制蛋白(inhibitor of apoptosis protein 1,IAP1)是一种广泛存在且高度保守的抗凋亡蛋白,通过多种机制在细胞凋亡的过程中发挥重要作用,而IAP1为其主要成员(王珮琳等,2019)。最近研究发现,干扰赤拟谷盗Triboliumcastaneum幼虫TcIAP1基因表达后能导致其死亡且能观察到其消化道细胞从肛门排出的现象。消化道细胞被排出可能是由于干扰IAP1基因表达后,导致赤拟谷盗中肠细胞IAP1基因表达水平降低,引起中肠细胞凋亡速率增加(Yoonetal., 2020)。Mills等(2017)发现经过dsCsIAP1处理后蠓Culicoidessonorensis成虫的中肠组织IAP1表达显著下降,且中肠组织细胞受到严重的损害,最终使其寿命缩短。由此可见,IAP1基因在昆虫的生长发育和代谢过程中发挥了重要作用。
本研究利用饲喂法RNAi,致力于评价HvIAP1基因是否可以作为茄二十八星瓢虫防控的高效靶标基因,为实现基于HvIAP1基因的茄二十八星瓢虫绿色防控奠定基础。
1 材料与方法
1.1 供试虫源
茄二十八星瓢虫于2018年4月采集自广州华南农业大学校园温室内的龙葵叶片上,继代饲养于广东省生物农药创制与应用重点实验室,饲养材料为茄子和龙葵叶片,茄二十八星瓢虫和叶片均放入带有滤纸和保湿棉球的培养皿中,置于人工气候箱(温度25±1℃,相对湿度70%~80%,光周期14 L ∶10 D)(Lüetal., 2018)。
1.2 HvIAP1基因在茄二十八星瓢虫不同发育阶段的表达模式
1.2.1样品收集
茄二十八星瓢虫不同发育阶段每个重复的取样个体数如下:卵20头、1龄幼虫10头、2龄幼虫5头、3龄幼虫3头、4龄幼虫1头、蛹1头、雌、雄成虫各1头,每个样本分别收集3个生物学重复,所有样本均置于1.5 mL无RNA酶的离心管中,用液氮迅速冷冻,在提取RNA前置于-80℃冰箱冷冻保存。
1.2.2总RNA提取和cDNA第一链的合成
使用TRIzol法对茄二十八星瓢虫的不同发育阶段样品进行RNA提取(Invitrogen, United States)。使用1%琼脂糖凝胶电泳检测RNA质量并使用仪器NanoDrop OneC分光光度计(Thermo Fisher Scientific, Waltham, MA United States)测定RNA浓度,所有样本RNA的OD260/OD230在1.8~2.2之间。使用试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time,Takara, RR047A),根据说明书将总RNA反转录合成cDNA,所有的cDNA稀释10倍用于后续实验。
1.2.3HvIAP1基因在茄二十八星瓢虫不同发育阶段中的表达模式
选取基因RPL13和RPS18作为内参基因(Lüetal., 2018),对HvIAP1基因在茄二十八星瓢虫不同发育阶段中的表达模式进行RT-qPCR分析(引物序列见表1)。RT-qPCR反应体系:cDNA模板2.5 μL、引物F和R(10 μM)各2.5 μL、TB Green 25 μL,ddH2O 17.5 μL。qPCR反应程序为3个阶段,分别为变性阶段95℃,30 s;定量分析阶段(95℃, 5 s;60℃, 30 s)40个循环;熔解曲线95℃, 5 s(4.4℃/s),60℃(2.2℃/s),95℃(0.11℃/s,每上升1℃拍照5次)。反应在96孔板Microseal PCR plates(BIO-RAD Inc., USA)中进行,RT-qPCR的反应仪器为Bio-Rad C1000 Real-Time PCR system(Bio-Rad C1000 Real-Time PCR system, BIO-RAD, USA)。最终的结果计算采用2-△△Ct法(Ct表示循环数)进行计(Livak and Schmittgen, 2001)。
1.3 取食dsRNA的RNAi效应
1.3.1dsRNA的体外合成
根据茄二十八星瓢虫转录组(PRJNA592380)获得HvIAP1基因的部分序列,利用E-RNAi网站(https://www.dkfz.de/signaling/e-rnai3//)设计dsHvIAP1和dsGFP的特异性引物(表1)。PCR反应体系:ddH2O 35 μL、2×PCR Taq MasterMix 50 μL、cDNA/GFP质粒5 μL、上游引物(10 μM)5 μL、下游引物(10 μM)5 μL。PCR反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min(Lüetal., 2021a)。

表1 本实验所用的引物Table 1 Primers used in this experiment
反应完成后使用1%琼脂糖凝胶电泳检测上述2种PCR产物,然后使用DNA纯化回收试剂盒(Universal DNA Purification Kit, TIANGEN, China)回收,作为合成dsRNA的模版。使用MEGAscriptTMT7试剂盒(Thermo Fisher Scientific, Waltham, MA, USA),根据说明书步骤合成dsRNA。dsRNA的合成体系:10×Reaction Buffer 5 μL、ATP Solution 5 μL、GTP Solution 5 μL、CTP Solution 5 μL、UTP Solution 5 μL、PCR回收产物1 μg、Enzyme mix 5 μL,用RNase-Free Water补足50 μL。上述体系混匀后,置于37°C 4 h。反应结束后加入2.5 μL的TURBO DNase去除残留的模版DNA和单链RNA,然后纯化dsRNA,用50 μL ddH2O溶解dsRNA后,置于-80℃冰箱中保存,分别得到dsHvIAP1和dsGFP。使用1.5%琼脂糖凝胶电泳检测dsRNA质量并使用仪器NanoDrop OneC分光光度计(Thermo Fisher Scientific, Waltham, MA United States)测定dsRNA浓度(Lüetal., 2021a)。
1.3.2dsHvIAP1对茄二十八星瓢虫的沉默效率影响
为了探究取食dsHvIAP1对茄二十八星瓢虫基因表达的影响,茄二十八星瓢虫1龄幼虫分别用200 ng/μL dsHvIAP1和dsGFP进行饲喂法RNAi处理,24 h后收集5头幼虫为1个生物学重复。用200 ng的dsHvIAP1和dsGFP分别饲喂单头茄二十八星瓢虫4龄幼虫,48 h后收集1头幼虫为1个生物学重复。所有样本均设置3个生物学重复。液氮速冻后,-80℃储存。提取所收集样品的总RNA并反转录为cDNA,用RT-qPCR分析dsHvIAP1对茄二十八星瓢虫的沉默效率。
1.3.3dsRNA对茄二十八星瓢虫的存活率和取食的影响
茄二十八星瓢虫1龄幼虫处理组(dsHvIAP1):在放有滤纸和加湿棉球的培养皿中放入10头茄二十八星瓢虫的1龄幼虫,10头为1个重复,设置5个重复,用浓度200 ng/μL的dsHvIAP1溶液浸泡直径为12 mm的圆形龙葵叶片1 min,风干后饲喂幼虫,每隔24 h更换一次叶片,饲喂用dsHvIAP1浸泡的叶片2 d后,用未经处理的茄子叶片每天饲喂幼虫。以相同浓度和方法设置对照组(dsGFP)。培养皿置于人工气候箱中(温度25±1℃,相对湿度70%~80%,光周期14 L ∶10 D)。每隔24 h统计每个培养皿中茄二十八星瓢虫的死亡数目,并计算存活率。同时拍照观察和记录处理组和对照组茄二十八星瓢虫的取食和生长发育情况差异(Lüetal., 2020c)。
茄二十八星瓢虫4龄幼虫处理组(dsHvIAP1):4龄幼虫饥饿处理24 h后,每头4龄幼虫饲喂1 μL浓度为200 ng/μL dsHvIAP1,1头幼虫为1个重复,共设置20个重复,然后将幼虫放入带有滤纸和加湿棉球的培养皿中,用直径为30 mm圆形龙葵叶片每天饲喂幼虫。以相同浓度和方法处理对照组(dsGFP)。培养皿置于人工气候箱中(温度25±1℃,相对湿度70%~80%,光周期14 L ∶10 D)。每隔24 h统计每个培养皿中茄二十八星瓢虫的死亡数量,并计算存活率的变化。同时拍照观察和记录处理和对照条件下茄二十八星瓢虫的取食和生长发育情况(Lüetal., 2020c)。
1.4 数据分析
单因素方差分析用于比较HvIAP1在茄二十八星瓢虫不同发育阶段之间的表达水平,使用Tukey检验进行两两比较。单因素方差分析(Breslow两两比较,P<0.05)用于检验饲喂dsRNA后,对照和处理之间的死亡率差异,使用Cox回归程序创建基于幼虫死亡率的生存曲线。
2 结果与分析
2.1 HvIAP1基因在茄二十八星瓢虫不同发育阶段中的表达模式
茄二十八星瓢虫1龄幼虫和3龄幼虫中HvIAP1基因表达量最高,2龄幼虫的基因表达量次之,卵、4龄幼虫和蛹中HvIAP1的表达量无差异,雌虫和雄虫表达量最低(图1)(F7, 16=37.799,P<0.05)。

图1 HvIAP1基因在茄二十八星瓢虫不同发育阶段中的表达模式Fig.1 Expression profiles of HvIAP1 across developmental stages in Henosepilachna vigintioctopunctata注:图中数值为平均值+标准误。不同字母表示组间差异显著(Tukey, P<0.05)。Note: Values were means+SE. Different letters indicated differences in gene expression at P<0.05.
2.2 dsHvIAP1对茄二十八星瓢虫沉默效率的影响
RT-qPCR分析结果表明,dsHvIAP1饲喂茄二十八星瓢虫1龄幼虫和4龄幼虫后,其HvIAP1基因的表达水平被显著抑制,与对照组相比,分别明显下降了2.40倍(F1,4= 976.597,P<0.05)(图2-A)和2.58倍(F1,4= 848.499,P<0.05)(图2-B)。
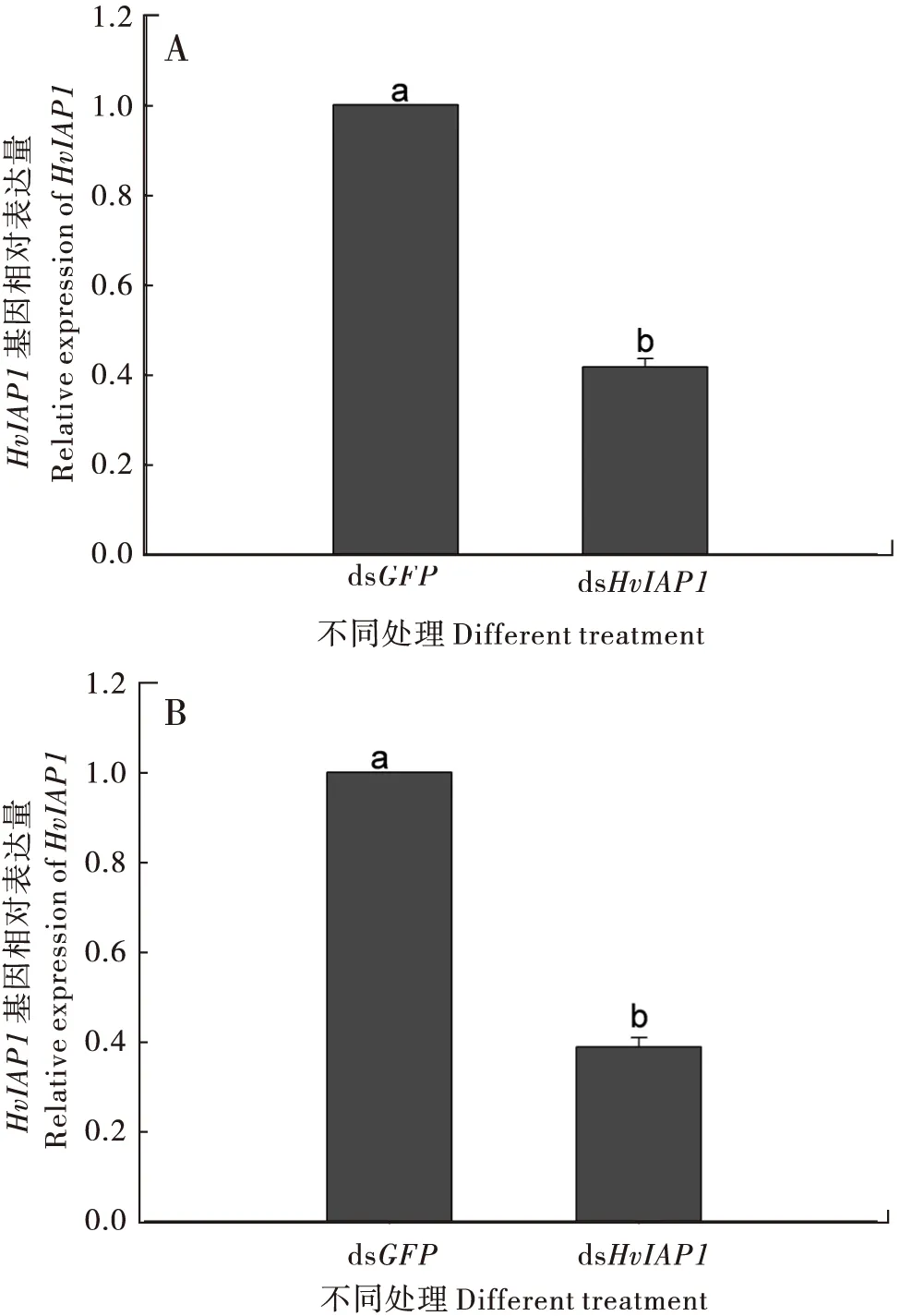
图2 取食dsHvIAP1对茄二十八星瓢虫1龄幼虫(A)和4龄幼虫(B)HvIAP1的沉默效率影响Fig.2 Effect of ingestion of dsHvIAP1 on the expression of HvIAP1 in 1st instar larvae (A)and 4th instar larvae (B)of Henosepilachna vigintioctopunctata注:图中数值为平均值±标准误,不同字母表示组间差异显著(Tukey, P<0.05)。Note: Values were means±SE, Different letters indicated differences in gene expression at P<0.05.
2.3 dsRNA对茄二十八星瓢虫存活率的影响
与对照组相比,经过dsHvIAP1处理的茄二十八星瓢虫1龄幼虫死亡率显著上升,处理后第10天其死亡率达92%(P< 0.0001),特别是在取食dsRNA后的第2天和第3天,死亡个数骤增(图3-A)。在茄二十八星瓢虫4龄幼虫中,与dsGFP相比,取食200 ng的dsHvIAP1后的前6 d其死亡率急速上升,处理后第10天致死率为70%(图3-B)(P< 0.0001)。
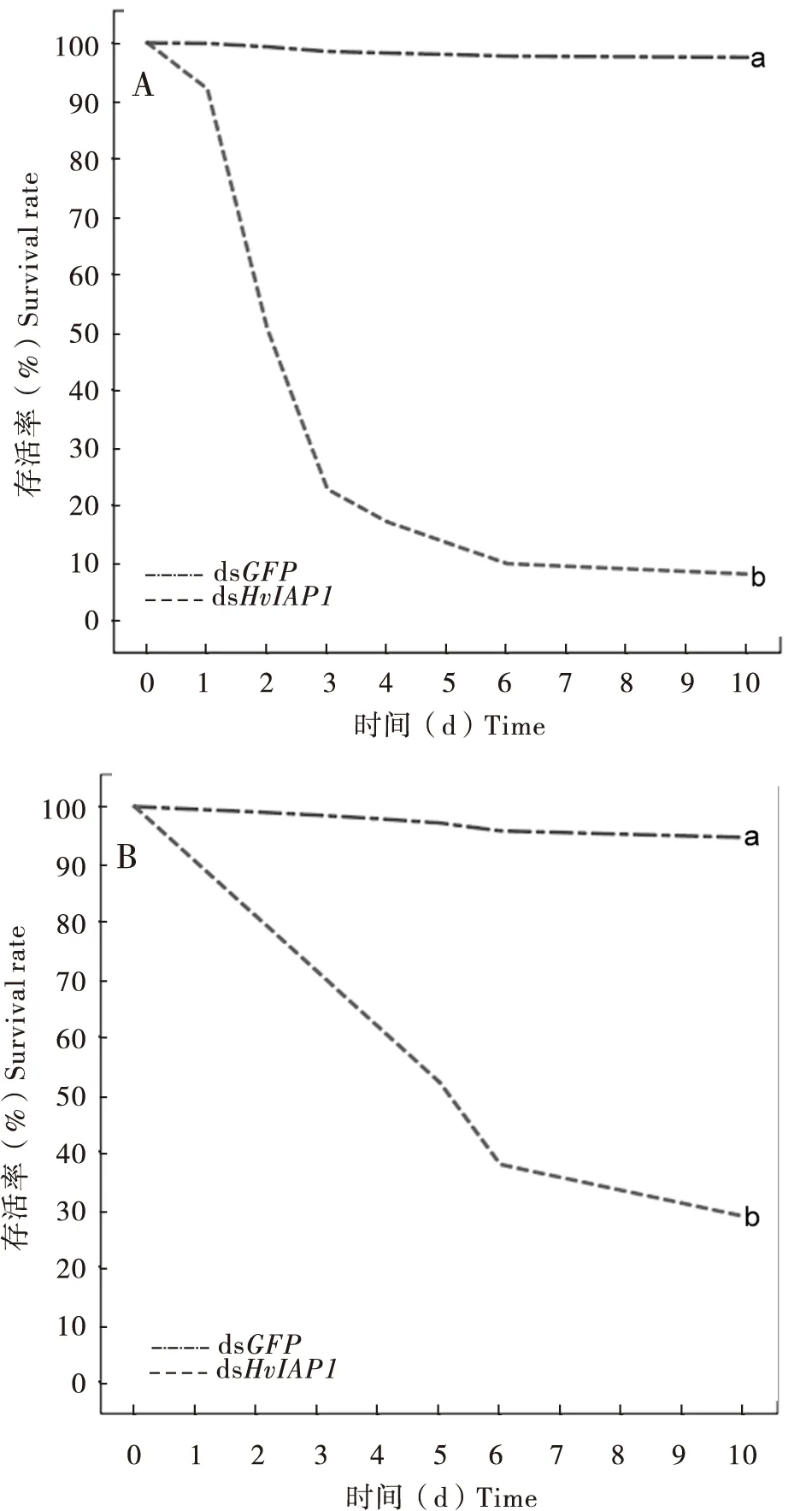
图3 dsHvIAP1对茄二十八星瓢虫1龄幼虫(A)和4龄幼虫(B)存活率的影响Fig.3 Effect of dsHvIAP1 on survival rate of 1st instar larvae (A)and 4th instar larvae (B)of Henosepilachna vigintioctopunctata注:图中不同字母表示组间差异显著(P<0.0001)。Note: Different letters indicated differences in gene expression at P<0.0001.
2.4 dsRNA对茄二十八星瓢虫取食和生长发育的影响
与对照相比,使用dsHvIAP1分别饲喂茄二十八星瓢虫1龄幼虫和4龄幼虫后均出现取食明显减少或不取食的情况(图4,图5)。在1龄幼虫中,dsGFP处理后第3天,全部发育为2龄幼虫,但dsHvIAP1处理后第3天组中存活的个体仍然处于1龄幼虫阶段。同样地,在4龄幼虫的实验中,当对照组发育到蛹期时,处理组中所有存活的个体仍处于4龄幼虫阶段。该结果表明dsHvIAP1能导致茄二十八星瓢虫幼虫生长发育受阻。

图4 饲喂dsHvIAP1和dsGFP后茄二十八星瓢虫1龄幼虫在24 h和48 h取食叶片情况Fig.4 Representative leaf consumed by the 1st instars ofHensosepilachna vigintioctopuntata after ingestion of dsHvIAP1 and dsGFP at 24 h and 48 h time point

图5 饲喂dsHvIAP1和dsGFP后茄二十八星瓢虫4龄幼虫在24 h、48 h和72 h取食叶片情况Fig.5 Representative leaf consumed by the 4th instars of Hensosepilachna vigintioctopuntata after ingestion of dsHvIAP1 and dsGFP at 24 h, 48 h and 72 h time point
3 结论与讨论
本研究通过饲喂dsHvIAP1来抑制茄二十八星瓢虫HvIAP1基因的表达,诱导了茄二十八星瓢虫急性进食障碍,并导致其1龄幼虫和4龄幼虫发育缓慢以及较高的死亡率。这些结果表明,HvIAP1基因可以作为茄二十八星瓢虫防控的高效靶标基因。
IAP1基因的表达模式在不同昆虫和不同发育阶段中存在差异。Powell等(2017)发现黑腹果蝇DrosophilamelanogasterDmIAP1基因在蛹期表达量最高,其他发育阶段的表达量都较低;Cao等(2018)发现赤拟谷盗TcIAP1基因在其卵期表达量最高,在幼虫发育阶段处于较低水平,然后在预蛹和蛹期表达量再次上升。本研究采用RT-qPCR对茄二十八星瓢虫不同发育阶段中HvIAP1基因的表达进行了分析,发现其在茄二十八星瓢虫的成虫期表达量最低,在其他发育阶段的表达均较高,1龄幼虫和3龄幼虫的表达量最高,表明HvIAP1基因在茄二十八星瓢虫的生长发育过程中起着重要的作用。
茄二十八星瓢虫HvIAP1基因的沉默导致较高的死亡率。本实验中,1龄幼虫取食dsHvIAP1后的第2天,死亡率接近50%,到第3天,累计接近80%幼虫死亡。而Lü等(2021a)发现干扰茄二十八星瓢虫1龄幼虫Hvlesswright基因,同样是饲喂200 ng/μL dsRNA处理的叶片,干扰实验开始后的第7天,死亡率达到50%,干扰后的第9天,死亡率达到80%。由此可见,dsHvIAP1对于茄二十八星瓢虫有更高效的致死作用,突显了HvIAP1基因作为茄二十八星瓢防治候选靶标基因的巨大潜力。
除了快速的高致死率,dsHvIAP1干扰茄二十八星瓢虫幼虫后,还导致了其具有急性进食障碍。在dsRNA饲喂试验中,HvIAP1基因沉默会导致1龄幼虫和4龄幼虫48 h内急性停止进食,并且这种进食障碍现象持续至其死亡,这种现象也直接保护了作物免受虫害。一般认为,害虫的死亡可以使作物得到直接保护,而本实验出现了急性的取食障碍,也直接保护了作物,可以认为这是害虫防治的另一个新标准(Guoetal., 2021)。HvIAP1基因沉默引起的茄二十八星瓢虫急性进食障碍的机制尚不清楚,它可能与中肠组织的细胞凋亡程度增加、中肠组织的完整性和大小受到严重损害有关。
RNAi作为一种具备高效、特异、环境友好型的新技术,在基因功能研究以及害虫防治的领域展现巨大的潜力,为害虫控制方法提供了新思路和新途径。而在本研究中,饲喂dsHvIAP1能引发茄二十八星瓢虫强烈的RNAi反应,因此,HvIAP1基因是一个潜在的可高效防治茄二十八星瓢虫候选靶标基因。

