基于烷基醇/酸的超分子溶剂及其在分析前处理中的应用
戴 沛,朱丽华
华中科技大学化学与化工学院,湖北 武汉430074
液液萃取技术利用组分在不同溶剂中溶解度的不同来分离混合物,是分析化学与化工领域中最重要的分离技术之一。然而,由于水样与有机溶剂的亲和力差、接触面积小,因此传统液液萃取在操作中往往需要使用大量的有机溶剂,这不但会提高萃取成本更将造成对环境的污染。通过向萃取体系中加入两亲性的分散剂(如甲醇、乙醇、乙腈等),可以提高有机萃取剂在水相中的分散程度,大大减小有机溶剂的使用量。与液液萃取相比,这种分散液液萃取技术(dispersive liquidliquid microextraction,DLLME),增加了水相与萃取相之间的接触表面,加快了目标化合物从样品溶液向萃取剂中的转移。
表面活性剂作为一种典型的两亲性物质,已被广泛应用于样品前处理之中;Yazdi[1]、Moradi和Yamini[2]也对表面活性剂在现代样品前处理技术中的各类应用进行了总结。当表面活性剂的浓度足够高,超过其临界胶束浓度时,就会在溶液中聚集形成水相胶束、反相胶束或囊泡,这些纳米级的三维聚集体可作为萃取单元,均匀分散于样品溶液中,对宽极性范围内的目标物有良好的亲和力。
烷基醇/酸同时具有亲水的羟基/羧基和疏水的长碳链,对人体毒性小且易于生物降解,是一种绿色表面活性剂。Ruiz首先利用烷基羧酸制备了囊泡[3]和反相胶束[4-5]溶液,用于有机化合物的萃取。在此基础上,Ballesteros-Gomez等[6]在2009年首次提出了超分子溶剂(supramolecular solvents,SUPRASs)的概念,将这类由表面活性剂依靠分子间作用力自组装形成的,具有独特纳米结构的三维聚集体溶液统称为SUPRASs。这种新型的超分子溶剂微萃取技术(supramolecular solvent microextraction,SSME)具有简单、快速、富集倍数高、成本低、环境友好等优点[7-8],极有可能取代传统的有机萃取剂,实现分析萃取过程甚至是分离工业的革命性突破与发展。
1 SUPRASs的组成单体
一般情况下,SUPRASs的形成需要经过连续的两步自组装过程,包括分子间的自组装和纳米尺度的自组装。同时含有亲水基团和疏水基团的两亲性分子单体,依靠其分子间的弱相互作用(包括氢键、疏水作用、库伦力、范德华力等)和浓度诱导效应,在水相中有序自组装形成纳米尺度的三维聚集体,并进一步组装形成更大的聚集体,由于这种组装聚集体在水中的溶解度变差,最终会从水相中分层,形成一个新液相层,即SUPRASs。现用于制备SUPRASs的两亲性物质主要有传统表面活性剂和长链的烷基醇/酸。
1.1 传统表面活性剂
表面活性剂指的是具有亲水亲油基团,溶于水能够显著降低水的表面能的物质。传统的表面活性剂一般含有一个大的头基,如磺酸基,季铵基,聚氧乙烯醚基,甜菜碱基等,因此具有良好的水溶性;根据亲水头基的不同,这些表面活性剂一般可被分为离子型表面活性剂(包括阳离子表面活性剂与阴离子表面活性剂)、非离子型表面活性剂、两性表面活性剂。
当表面活性剂在水溶液中的浓度超过其临界胶束浓度(critical micelle concentration,CMC)时,会在水相中自发聚集;它们的疏水碳链朝内作为内核,亲水基朝外与水接触作为外壳,形成纳米级的三维聚集体,即水相胶束。由于水相胶束外层亲水,因此将其从水相中分离时常需要较为严苛的实验条件;如通过升高温度使非离子表面活性剂与水分子间氢键断裂实现浊点萃取(cloud point extraction,CPE),通过调节pH改变离子型表面活性剂溶解度实现凝聚萃取(coacervative extraction,CAE)。Seebunrueng等[9]在以阴离子表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)为单体制备水相胶束时,通过加入反电荷的阳离子表面活性剂四丁基溴化铵(tetrabutylammonium bromide,TBABr)和无机盐AlCl3与SDS头基发生中和,以降低SDS头基间的静电排斥作用,这样避免了浓酸的使用,实现了温和条件下的液液分离,但仍需消耗大量无机盐(质量体积比15%),对环境造成额外负担。除此之外,这类水相胶束不适于热不稳定分析物的提取,且萃取相条件与色谱系统的兼容性较差。这种具有较大亲水头基的传统表面活性剂可溶于水,其反相胶束需在与水不互溶的非极性有机溶剂中制备,而囊泡的制备则更为复杂且不稳定;因此,以传统表面活性剂为单体的反相胶束及囊泡通常被用作载体或微反应器,而不是萃取剂。
1.2 烷基醇/酸
长链的烷基醇/酸同样有疏水的长碳链和亲水的羟基/羧基,与传统表面活性剂相比,其具有无毒、无污染、可降解的优点,是一种绿色表面活性剂。然而,这类烷基醇/酸在结构上往往只有一个羟基或羧基,亲水头基小,这导致它们的亲水亲脂平衡值低(HBL=3~5),不溶于水,因此无法直接在水相中形成水相胶束,需要引入与水分子亲和性好的第三相来帮助其溶解分散,如图1所示。
四氢呋喃(tetrahydrofuran,THF)是一种万能溶剂,能完全溶解长链的烷基醇/酸,且在室温下能与水完全混溶,因此被广泛用作长链烷基醇/酸的分散剂,使其在有机相中形成反相胶束。Rubio课题组[6]最早利用癸酸(decanoic acid,DeA)、THF与水制备出反相胶束SUPRASs,其中DeA含量高达0.6 mg·μL-1,较水相胶束有更多活性结合位点。

图1 基于烷基醇/酸的SUPRASs制备示意图Fig.1 Schematic diagram of preparation of alkyl alcohol/acid-based SUPRASs
除了以THF为分散剂外,还可利用有机碱作为助溶剂,诱导烷基酸在水相中形成聚集体。Moral等[10]将摩尔比为2∶1的DeA与四丁基氢氧化铵(Bu4NOH)混合,制备了一种囊泡型SUPRASs。在这种囊泡结构中,两亲性分子的含量最高可达1 mg·μL-1。Mpupa等[11]的工作表明,采用三辛基甲基氯化铵(Aliquat-336)替代Bu4NOH,同样可诱导DeA聚集形成囊泡,说明这种制备囊泡型SUPRASs方法具有普适性。
相较于传统表面活性剂,以绿色的烷基醇/酸为单体的SUPRASs具有更高的萃取效率,同时还避免了水相胶束在分离时必需的高温(35~90℃)或高浓度酸/盐(0.6~7 mol/L)的严苛条件。因此,由烷基醇/酸制备的新型SUPRASs在液液萃取中具有独特的优势。表1对基于各类SUPRASs的萃取技术和传统DLLME的不同进行了对比总结。
2 基于烷基醇/酸的SUPRASs的特点及应用
基于长链烷基醇/酸的SUPRASs包括两大类,分别为:以THF为分散剂的反相胶束和以有机碱为助溶剂的囊泡。这两种聚集体的稳定性及萃取容量,直接决定了萃取时样品相与萃取相之间的体积比,而相比的大小又与前处理过程的富集倍数和检测灵敏度息息相关;如表1所示,这两类SUPRASs分别具有不同的萃取驱动力,这也表明它们适用于不同的目标化合物。因此,针对各类SUPRASs的特点及萃取机理进行的基础研究,将为它们的应用提供指导。以烷基醇/酸为组成单体的SUPRASs也已广泛应用于环境[12-16]、食品[17-19]和生物[20-21]分析领域中的前处理过程。表2已对基于长链烷基醇/酸的SSME在各类化合物检测中的典型应用进行了总结。

表1 各类SSME与DLLME的比较Tab.1 Comparison between various SSME and traditional DLLE
2.1 以THF为分散剂的反相胶束
在反相胶束中,表面活性剂的极性基团在内形成一个具有溶解极性物质能力的极性核,而排列在外的非极性基团则分散在非极性的有机溶剂之中;因其外表面具有疏水性,因此可快速与水相样品分离。
利用烷基醇/酸制备反相胶束SUPRASs时,只需将烷基醇/酸与THF、水按适当比例混合。图2(a)为典型的THF/DeA/水三元相图,其表明了三者能形成反相胶束的比例[22]。其他烷基醇/酸制备的反胶束SUPRASs的混合比例也可以用类似的三相图来表示[23-24]。如图2(a)所示,基于DeA的反相胶束具有较强的耐水性,适用于水溶液或高含水量固体样品中的萃取过程。为了在萃取过程中达到较高的萃取相比及富集倍数,除了聚集体的高稳定性外,还应保证萃取剂的萃取容量足够高。反相胶束的萃取驱动力主要是两亲分子与目标物之间的氢键和色散力,因此其萃取容量的决定因素即为SUPRASs中两亲物的含量;但是,这类反相胶束SUPRASs中两亲物的最终含量并不取决于烷基醇/酸的使用量,而是制备过程中THF与水间的比例[25]。
制备过程中THF用量越少,则反相胶束SUPRASs中两亲分子与结合位点含量越高。由于外部疏水,反相胶束在非极性/中极性分析物的萃取中具有独特的优势,因此被广泛应用于各类有机目标物、金属-配体复合物的提取。除此之外,反相胶束的极性内核也可用于提取极性目标物,Altunay等[26]已用DeA制备的反相胶束成功提取了肉类中的亚硝酸盐,并以紫外光谱进行检测。由于反相胶束对宽极性范围内的目标物都有良好的亲和能力,Keddar等[27]还用其同时提取了微藻中的极性与非极性抗氧化物。而两亲分子的选择要同时考虑两种萃取驱动力:长链烷基醇/酸对目标物具有更强的疏水力,而短链烷基醇/酸则更容易与目标物间形成氢键。Zhao等[28]优化了用于萃取三唑类杀菌剂的两亲物碳链长度,发现以癸醇(C10)制备的SUPRAS对其萃取回收率要高于辛醇(C8)、十一醇(C11)和十二醇(C12),即癸醇(C10)与三唑类杀菌剂间相互作用更强。
与之相反,大体积的THF会稀释烷基醇/酸浓度,降低两亲物在SUPRASs中的含量;但会相应地增大所形成的反相胶束的水腔大小及SUPRASs的体积[图2(b)]。这种尺寸可调的聚集体溶液表现出尺寸限制的性质[29],它可以排除蛋白质、多糖、腐植酸等大分子物质在胶束外,一步实现样品清洁和小分子分析物的提取[30-31]。此外,还可以通过控制THF/水的比例,实现不同尺寸极性/离子目标物的选择性萃取[32]。Ballesteros-Gomez[25]以体积比为1的THF/水及200 mg DeA制备了反相胶束SUPRAS并用其提取具有不同分子量的极性目标物,结果表明,由此制得的SUPRAS可完全提取赭曲霉毒素A(MW=403.8)和酸性红97(MW=698.6),而将亮蓝G(MW=825.9)排除在外。
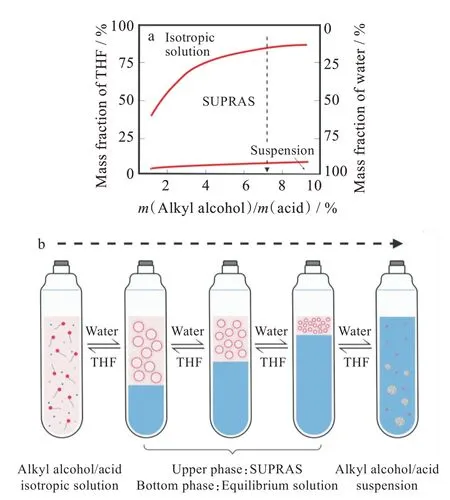
图2 反相胶束SUPRASs的组成、体积与THF/水比例的关系:(a)烷基醇(酸)/THF/水三元混合物相图示意图,(b)相同两亲物用量,不同THF/水比例下所得的混合溶液Fig.2 Relationship between composition,volume of reverse micellar SUPRASs and THF/water ratio:(a)phase diagrams for ternary mixtures of alkyl alcohol(acid)/THF/water,(b)mixed solution at different THF/water ratios with same usage of amphiphile
2.2 以有机碱为助溶剂的囊泡
以有机碱四丁基氢氧化铵(Bu4NOH)作为长链烷基羧酸的助溶剂,按1∶2的摩尔比进行混合,可以得到具有两层封闭结构的囊泡型三维聚集体。如图1所示,在囊泡形成的过程中,Bu4NOH分子中的氢氧根可以中和一半的烷基羧酸,增大了烷基酸在水中的溶解度;而Bu4N+基团降低了羧酸根之间的静电斥力,诱导形成具有2条烃链和1个大头基的DeA-Bu4N+DeA-gemini结构[33]。为了保持体系稳定,上述gemini结构以尾对尾的形式聚集在一起,最终形成具有封闭双层结构的有序组合体——囊泡(Vesicles)。该制备方法进一步避免了有机溶剂THF的使用,因而具有更低的毒性和制作成本。
囊泡的萃取驱动力主要是氢键、范德华力以及Bu4N+的4价氮与分析物的苯环之间的π-阳离子相互作用。基于这种特殊的π-阳离子作用力,囊泡SUPRASs常用于萃取芳香族化合物。如表2所示,虽然囊泡的两亲物含量最高,但结构紧凑、尺寸大的特点也导致其在萃取时的传质速度比反向胶束更慢,尤其是对于弱极性目标物质的提取。Rezaei等[34]比较了由DeA制备的反相胶束和囊泡型SUPRASs萃取三嗪类除草剂的效果。结果证实,两种SUPRASs对三嗪类除草剂均有较好的萃取富集效果,但利用囊泡进行萃取的时间更长约为70 min。这主要是由于囊泡外层亲水性好,因此通常需要采用冰浴固化的方法将其与水样分离,导致了耗时较长。近年来,SUPRASs与其他前处理方法的结合可以有效地解决其分离和收集困难的问题,得到了广泛的研究。
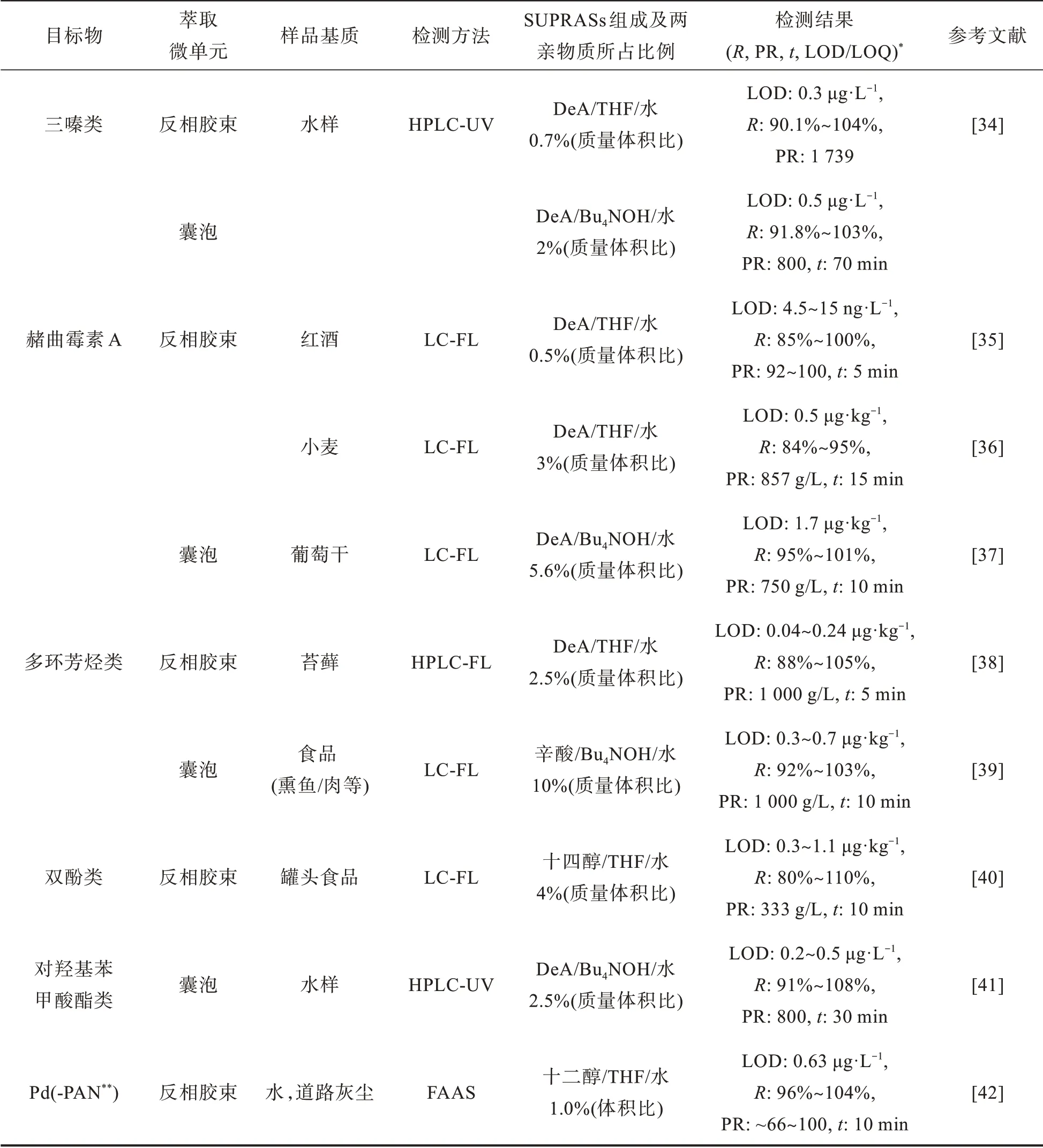
表2 基于长链烷基醇/酸的反相胶束和囊泡型SUPRASs在各类化合物萃取中的典型应用Tab.2 Typical application of alkyl alcohol/acid-based reverse micellar and vesicular SUPRASs in extraction of various compounds
3 SUPRASs与其他前处理方法的联用
SSME能够在短时间内达到优异的萃取效果,在样品前处理中得到了广泛的应用。然而,由于萃取中SUPRASs用量极少,因此存在着样品纯化效果差、萃取相回收不方便的问题。近年来,研究者们设法将SSME与其他前处理方法相结合,以达到简化操作、提高萃取效果的目的(图3)。
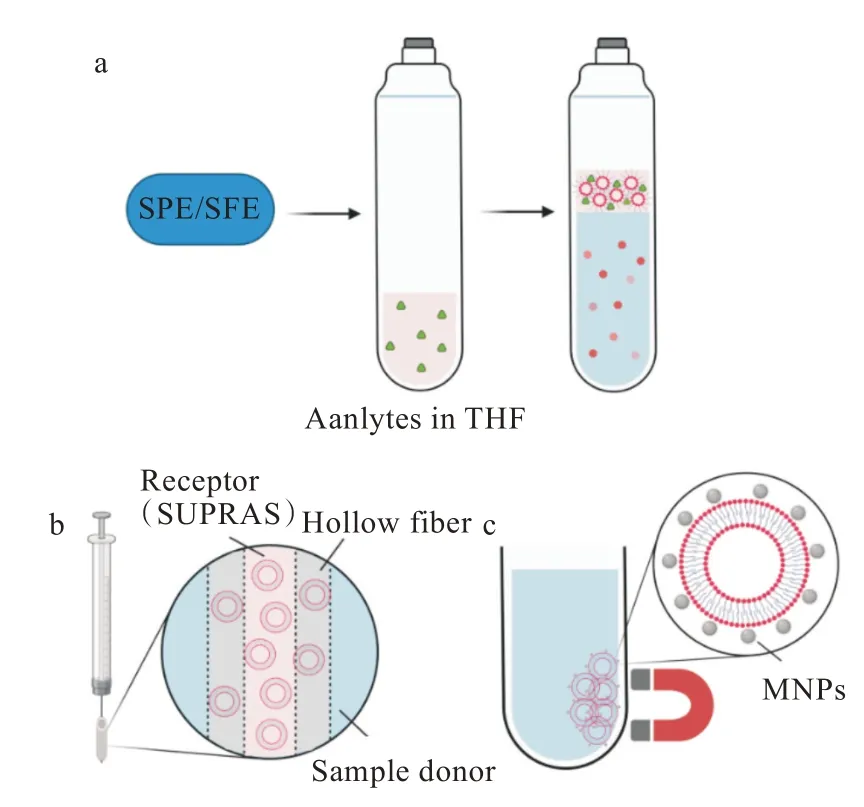
图3 SSME与其他前处理方法的联用示意图:(a)通过THF串联SPE/SFE与反相胶束型SUPRASs,将囊泡负载于(b)中空纤维和(c)MNPs上的并联联用Fig.3 Schematic diagram of SUPRASs combined with other pretreatment methods:(a)tandem combination of SPE/SFEwith reserve micelles through THFas connector,Parallel combination through loading vesicles onto(b)hollow fibers and(c)MNPs
3.1 以THF为收集溶剂的串联联用——提高样品纯化及富集效率
以THF作为固相萃取(solid phase extraction,SPE)的解吸溶剂或超临界流体萃取(supercritical fluid extraction,SFE)的收集溶剂,再将其用于反相胶束型的制备,即可实现SSME与传统SPE/SFE方法的串联联用[图3(a)],进一步提高了分析物的富集倍数。目标物预先通过SPE/SFE在THF中富集,因此在后续形成反相胶束时,免去了目标物由样品相向THF的传质过程。此外,SUPRASs对宽极性范围内目标物的萃取本身不具有选择性,而SPE/SFE可以作为一种样品清洁的方法,有效消除基底杂质的干扰。另一方面,这种串联方式也减少了传统SPE/SFE中有机溶剂的用量,避免了后续耗时耗能的溶剂蒸发步骤,及溶剂蒸发时可能导致的目标物分解和流失。
3.1.1 SPE SUPRASs中两亲物含量高,萃取容量足够大;因此,SUPRASs在超大体积液体样品中的稳定性是限制其相比和检测灵敏度的关键性因素。利用SPE预先萃取大体积液样,可以浓缩富集目标物。因此,样品相与最终萃取相的体积比可以达到更高值。Kashanaki等[43]将分散微固相萃取(μSPE)与SSME相结合,实现了水样中铜离子的高富集提取。该方法最终萃取相(40μL)与水样(100 mL)的体积比高达2 500,回收率为90%~96%,对铜的检出下限达0.2 ng·L-1,μSPESSME前处理过程总耗时23 min,与一般的SSME用时相近。Rezaei等[44]采用C18柱作为固相萃取剂,最终在25 min内将30 mL双氯芬酸和甲灭酸废水浓缩为20μLSUPRASs,回收率为93.8%~102%。同时,他们还发现在提高样品体积到200 mL时,目标物回收率几乎不变,表明该方法的最终萃取相比可高达1×105。
3.1.2 SFE SFE与SSME的结合进一步扩展了SUPRASs在固体样品中的应用。通过SFE将固体样品中的目标物转移至THF中,可以避免大量两亲物质吸附在固体表面,烷基醇/酸的用量较直接采用SUPRASs萃取固体要少得多。Asiabi等[45]将SFE与SSME结合,萃取富集土壤样品中的磺酰脲类除草剂,最终萃取相比可达1.7×104g·L-1,回收率为87%~101%。不过,由于SFE耗时较长(45 min),整个样品前处理过程需要约50 min。
3.2 基于SUPRASs负载的并联联用——便于萃取相的转移与收集
以极微量SUPRASs作为萃取相时,可获得高的萃取相比,提高目标物的检测灵敏度。然而萃取过程中,微量萃取相的收集和转移是研究者们不可避免的难题之一,尤其是对于外表面亲水的囊泡结构;而萃取相与样品的分离不完全将会直接影响结果的准确度与重现性。
长链烷基醇/酸具有低毒、熔点接近室温(10~30℃)、密度小于水的特点。除了利用特殊的用自制容器进行离心分离外[46],还可以通过漂浮液滴固化的方式进行收集[47]。近年来,研究者们设法通过负载SUPRASs的方式,实现SSME与其他分离方法的耦合联用,以期达到简化操作、提高萃取效率的目的。
3.2.1 基于SUPRASs的中空纤维液液微萃取技术 在中空纤维-液相微萃取(hollow fiber-liquid phase microextraction,HF-LPME)中,多孔的HF作为接触界面,处于样品供体和微量的萃取相受体之间。由于大分子杂质无法进入纤维孔,因此HFLPME具有出色的样品净化能力,适用于复杂基质的直接萃取,可以起到微滤样品、稳定和保护萃取剂的作用。
传统有机溶剂稳定性差、挥发性高,在作为受体时可能会流失而导致萃取效率降低。而SUPRASs黏度高、蒸汽压低,将其用作HF-LPME的萃取剂可以有效克服上述不足。萃取相可直接通过注射器从HF内回收,大大简化了对微量萃取相的收集过程。
Moradi等[48]开发了一种新型的中空纤维-囊泡介导微萃取(hollow fiber-vesicle mediated microextraction,HF-VMME)技术,用于水样中卤代苯胺类物质的萃取。首先通过浸泡和注射器吸取的方式,将基于DeA/DeBu4N的囊泡型SUPRASs负载到HF的微孔和空腔内(如图3b),萃取完成后再将其抽回注射器,注入HPLC进行检测。Rezaei等[49]也成功地将同一体系应用于果汁、尿液等复杂基质中苯二氮类药物的萃取。结果表明,该方法检出限达0.5~0.7μg·L-1。在HF上负载SUPRASs可简化收集萃取相步骤,保证萃取剂与样品间的完全分离;然而,它限制了囊泡在水样中的均匀分散,因此萃取用时较长(表3)。3.2.2 基于SUPRASs的铁磁流体微萃取技术 铁磁流体是一种磁性纳米粒子(magnetic nanoparticles,MNPs)稳定悬浮于载体液体中的胶体分散系,利用外磁力进行磁选分离可以简化分离过程,提 高 相 分 离 效 率[50]。如 图3(c)所 示,将SUPRASs作为MNPs的载体液体即可实现SUPRASs的磁性响应。
Zohrabi等[51]用油酸包裹MNPs使其表面疏水,再分散于囊泡SUPRASs中制得铁磁流体,以该铁磁流体作为萃取剂富集提取果汁样品中残留的有机磷农药。这种将MNPs负载在囊泡上的方式有利于SUPRASs的在水相中的均匀分散和完全分离,该萃取过程仅耗时5 min,整个前处理步骤不超过10 min。在萃取时直接加入MNPs也可实现负载,但此过程中囊泡与MNPs的结合需要一定时间,会导致萃取时间增长[52]。
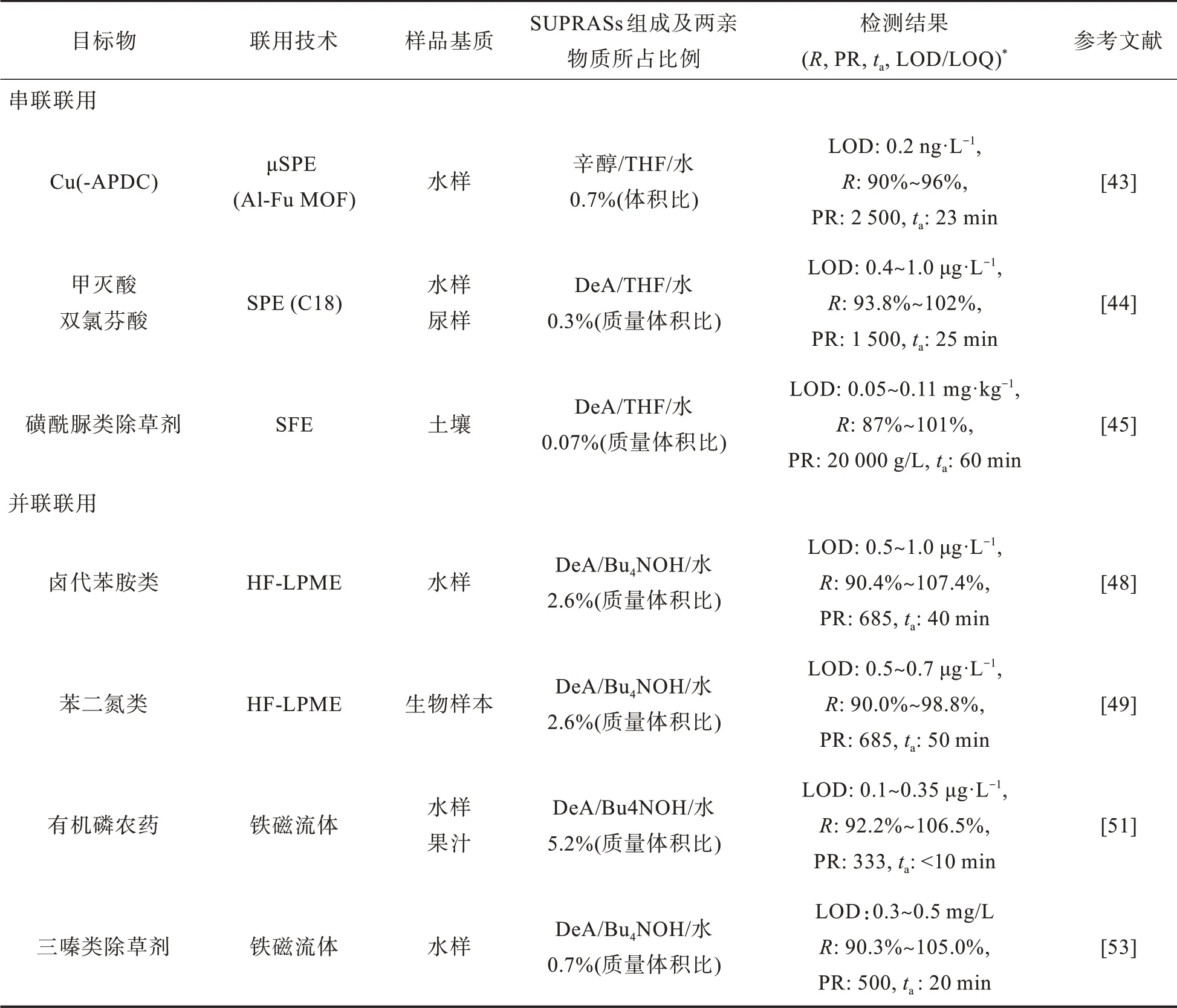
表3 SUPRASs萃取技术与其他前处理方法的联用Tab.3 Combination of SSME with other pretreatment methods
Safari等[53]借助MNPs在酸性条件下表面带正电的特性制备了铁磁流体:用正电荷的MNPs替代Bu4NOH诱导DeA/De-自组装,并通过静电相互作用与所形成的囊泡结合。所得的铁磁流体用于提取水样中的三嗪类除草剂,萃取时间为15 min,整个预处理过程耗时约20 min。此外,将MNPs负载于固相吸附剂[54]或HF[55]上,再与SUPRASs相结合,也可以实现SUPRASs的磁回收。
4 结论与展望
SUPRASs在样品溶液中分散性好、两亲物质含量高,因此比传统的液液萃取方法具有更高的萃取效率。其中,由长链烷基醇/酸组成的SUPRASs主要包括反相胶束与囊泡两类,相较于由传统表面活性剂制备的水相胶束而言,这类基于长链烷基醇/酸的SUPRASs具有更好的萃取效果与温和的萃取条件,近年来得到了研究者们的关注,被广泛应用于样品前处理过程中。其中,反向胶束可以通过色散力、氢键和尺寸排阻特性,萃取宽极性范围内的目标物;而由于Bu4N+中的四价氮能与分析物通过π-阳离子相互作用结合,因此囊泡型SUPRASs对于萃取芳香类化合物具有独特的优势。基于这些萃取机理,我们可以在理论上选择合适的SUPRASs,并根据目标物调整所需的烷基醇/酸。
将SSME与其他前处理方法相结合,可以解决SUPRASs萃取相回收难、样品净化效果差的问题。以THF为串联接口,可以实现SSME与SPE/SFE的联用,SPE/SFE步骤不仅净化了样品,还进一步提高了目标物的富集倍数;将SUPRASs负载于中空纤维或MNPs上,可实现SSME与HFLPME/铁磁流体的并联联用,大大简化了微量萃取相的收集和转移。
由于SUPRASs对分析物的萃取没有选择性,因此适用于多组分的同时分析,但难以避免杂质的干扰。因此,萃取相的检测方法需要具有选择性,如可以进一步分离分析物的色谱法,或对目标金属离子有特异性响应的原子光谱法。我们应着力于开发其他更小型化的、快速便捷的萃取相分析方法,使这种简单快速、富集倍数高的前处理方式能够应用于现场快检领域。指纹光谱可以表征分子中振动/转动能级的跃迁,从理论上讲,具有这种分析检测非选择性萃取相的潜力。

