纳米硅铝酸盐沸石晶体的合成及其对重金属的吸附机制
陈 晨,王 磊,程 婷,张 晓,3,邓 琴
(1.江苏科技大学环境与化学工程学院,江苏镇江 212018;2.江苏开放大学环境生态学院,江苏南京 210017;3.南京大学盐城环保技术与工程研究院,江苏盐城 224005)
重金属污染是我国水环境污染所面临的主要问题之一,其主要来源于冶金、电镀、印染等工业所排放的废水,这类废水不经过处理直接排放会严重威胁生态环境和人类健康[1-3]。重金属通过污染水体富集在鱼、虾体内,或通过土壤富集在植物内,通过食物链累积在人体内,造成慢性中毒与三致效应(致癌、致畸、致突变)。
目前,水环境中重金属的处理方法主要有吸附法、化学沉淀法、离子交换法等[4-7]。凭借成本和技术应用等方面的优势,以沸石作为吸附剂的处理方法受到研究人员的关注[8-10]。作为一类硅铝晶体多孔材料,沸石被广泛地用在环境保护,石油化工以及精细化工等各个工业领域[11-13]。Linde F(K)沸石(以下简称K沸石)是一种新型人工合成沸石,其对水环境中的重金属污染物具有较好的吸附效果[12-14]。然而,由于其微观结构限制,沸石材料对溶液中重金属的吸附性能并没有得到完全的发挥,如粉煤灰钾基沸石对重金属Cu2+的吸附量为49.58 mg/g[15],粉煤灰改性沸石对Cr6+的吸附量为4.5 mg/g[16]。根据经典的“Ostwald ripening 理论”[17],在液相中形成晶体时,由于热力学的作用,小晶体不断萎缩,大晶体不断增大,导致液相反应体系中形成的晶体微粒的尺寸往往是其基本晶体单元的几千甚至上万倍。基于此理论,在强碱的水热环境下制备的K沸石可充分地生长发育,其形成的晶体微粒往往具有微小的空间尺寸(如图1所示)。将具有此种微观结构的K沸石运用于水体中重金属的吸附时,由于受到孔道扩散作用的限制,绝大部分的吸附作用发生在沸石表面,限制了Linde F(K)沸石吸附潜力的发挥。

图1 纳米沸石晶体合成方法Fig.1 Synthetic method of nanozeolite crystal
本研究旨在以前期合成的Linde F(K)沸石为基础,通过优化重构其微观结构,制备出具有纳米级尺寸的沸石晶体材料,提高其对重金属的吸附能力,阐明其吸附机制。在沸石制备过程中引入双特征官能团长链有机物作为结构限制模板,使沸石微观结构有效地从微米级尺寸转变成纳米级尺寸,激发其内部吸附活性位点,减小吸附过程扩散阻力。在此基础上通过实验证实其对重金属的强化吸附能力。
1 材料和方法
1.1 材料与仪器
硅酸钾、偏铝酸钾、氢氧化钾、硝酸铜、硝酸镉等 均为分析纯,国药集团化学试剂有限公司。
PHS-25型pH计 上海精密科学仪器有限公司;THZ-82型恒温振荡器 金坛市顺华仪器有限公司;101A-0型电热鼓风干燥箱 金坛市良友仪器有限公司;AA240DUO型原子吸收光谱仪 美国安捷伦科技有限公司;NEXUS870型傅里叶变换红外光谱仪 美国NICOLET公司; JEM-2100型透射电子显微镜 日本JEOL公司;PHI5000 Versa Probe X射线光电子能谱仪 日本ULVAC-PHI公司。
1.2 实验理论设计
在液相中形成晶体时,晶体会自由地向空间三个方向进行生长,成长为大的沸石晶体微粒,如图1中纳米沸石晶体合成方法为一般沸石合成方法。如要缩小其尺寸,就必须在空间上对三个方向的生长进行限制,使其只能发育为较小的沸石颗粒。根据现有理论及前期的实验结果[18-20],在形成的液相溶液中引入双特征官能团长链有机物作为沸石生成限制剂。在此有机物的两端,是疏水的长链烷基基团,而在其中部是亲水基团。在这种结构模板存在的水热环境下,K沸石更倾向于在其中部亲水的基团附近形成并生长,同时结构模板两端的疏水长链烷基阻止了K沸石的发育生长。受到这种限制,K沸石最终只能发育为具有较小尺寸的沸石材料。而将这种具有纳米尺寸的沸石材料用于重金属的吸附时,其吸附性能可能会得到有效提升。
1.3 纳米沸石晶体的合成方法
纳米沸石晶体的合成方法为:向10 mol/L的KOH中,加入硅酸钾、偏铝酸钾以及丙撑基双[十八烷基二甲基氯化铵](以下简称C18-3-18)。基于前期预实验研究,硅酸钾、偏铝酸钾与C18-3-18的最优质量比为1∶0.674∶0.12;之后将混合物质在反应温度75 ℃下进行水热反应32 h;反应后产物进行过滤并用纯水洗涤至为中性,然后加入甲醇对丙撑基双[十八烷基二甲基氯化铵]进行洗脱,合成材料在鼓风干燥箱中105 ℃干燥至恒重,即可获得纳米沸石晶体材料,之后对合成材料的性能进行表征。
1.4 合成材料的表征方法
利用Shimadzu XD-3A衍射仪,Cu-Kα辐射(λ =1.54056)对纳米沸石晶体样品进行了X射线衍射的分析。利用JS94H型凝胶成像仪(POWEREACH)测定材料表面的Zeta电位。利用傅里叶变换红外光谱仪进行FT-IR分析。利用XIGO液相比表面积分析仪测定纳米材料的比表面积。利用透射电子显微镜进行TEM分析。合成材料的所有表征均由南京大学现代分析测试中心完成。利用X射线光电子能谱仪进行XPS分析。
1.5 吸附实验
1.5.1 吸附实验步骤 在单一和竞争性溶质体系中进行了批量吸附实验。在每次吸附试验中,将一定量的吸附材料分散在20 mL重金属溶液中,置于25 mL聚四氟乙烯瓶中,并将其浸泡在水浴中以200 r/min的速度搅拌。吸附实验后将混合液通过0.45 μm滤膜过滤每一种分散体,采用原子吸收光谱仪测定滤液中残余重金属浓度,并用Excel数据处理软件对未知样品进行分析计算,每个样品重复3次。
1.5.2 pH对重金属吸附的影响 在单一溶质体系中进行批量吸附实验,考察溶液pH对重金属Cu和Cd吸附效果的影响。单一重金属吸附体系中Cu和Cd的初始浓度均为100 mg/L,初始pH分别为2、3、4、5、6、7、8、9,吸附实验在水浴中进行,反应温度为35 ℃,吸附完成后将混合液通过0.45 μm滤膜过滤,分析残余液体中重金属浓度。
1.5.3 吸附时间对重金属吸附的影响 在单一和竞争性溶质体系中进行批量吸附实验,考察反应时间对重金属Cu和Cd吸附效果的影响。在单一吸附体系和竞争吸附体系中,反应时间为0~480 min,重金属Cu和Cd的初始浓度均为280 mg/L,初始pH为6,反应温度为35 ℃,吸附实验在水浴中进行,吸附完成后将混合液通过0.45 μm滤膜过滤,分析残余液体中重金属浓度。
1.5.4 重金属离子浓度对重金属吸附的测定 重金属离子浓度的测定采用AA240DUO火焰原子吸收光谱仪进行。采用一次性注射器吸取部分实验结束后的样品,通过0.45 μm滤膜进行过滤后,利用仪器测定的标准曲线进行分析未知样品的重金属浓度。之后用Excel数据处理软件对未知样品数据进行分析计算,每个样品重复3次。
2 结果和讨论
2.1 纳米沸石晶体的表征
2.1.1 比表面积分析 根据液相比表面积分析仪测定,并由计算机程序拟合的分析结果(图2),纳米沸石晶体的液相比表面积为2123.6 m2/g。

图2 纳米沸石晶体的液相比表面积Fig.2 Liquid surface area of nanozeolite crystals
2.1.2 XRD分析 图3显示的是纳米沸石晶体的XRD分析结果。一些主要衍射峰的位置分别在2θ:12.7°、13.4°、18.6°、25.6°、28.7°、28.9°、30.1°、31.8°、33.5°和39.9°,根据相关文献[12,21],这些衍射峰均归属于硅铝酸盐晶体(分子式为KAlSiO4·1.5H2O PDF 38-0216)。

图3 纳米沸石晶体的XRD Fig.3 XRD of nanozeolite crystals
2.1.3 FT-IR分析 纳米沸石晶体的FT-IR结果见图4。其主要的红外峰出现在3384、1633、933 cm-1和603 cm-1。根据前期的研究和相关文献,3384 cm-1和1633 cm-1归属于O-H基团的伸缩振动[12];603 cm-1归属于O-Si(Al)-O基团的弯曲振动[21];而933 cm-1归属于Si(Al)-O-Si(Al)的伸缩振动[12]。这就说明材料中的主要基团是由Si(Al)-O结构所组成的,是典型的沸石材料的基本结构。

图4 纳米沸石晶体的FT-IRFig.4 FT-IR of nanozeolite crystals
2.1.4 SEM分析 图5a和5b为纳米沸石晶体的SEM分析结果。材料呈四方晶体结构且晶体尺寸在200~500 nm之间。这样的尺寸主要得益于加入了[C18H37(CH3)2- N+- (CH2)3- N+- (CH3)2C18H37]Cl2作为导向剂,有效降低了沸石的尺寸[22-23]。与研究组前期合成的Linde F(K)相比[12-14],尺寸明显由微米变成纳米。图5c和5d为纳米沸石晶体的EDS结果,从EDS结果谱峰电脑分析结果可知,纳米沸石晶体的主要组成为: K2O (22.41%), SiO2(35.27%), Al2O3(39.77%)。
2.1.5 TEM分析 图6显示了纳米沸石晶体的TEM分析结果。从图6中可以观察到大量长方形规则形貌,这应当是沸石的规则四方晶体结构在TEM分析结果中的反映。与SEM的分析结果类似,这些规则晶体的微观尺寸在200~500 nm之间,这进一步表明实验合成得到的沸石晶体具有明显的纳米微观尺寸。而纳米尺寸的沸石材料可有效提高其结构比表面积,这在图2中得以验证。
2.1.6 XPS分析 图7显示了纳米沸石晶体的XPS分析结果。从图7a中可以看出,纳米沸石晶体的全谱扫描结果中出现的主要XPS峰归属于Si 2s(151.2 eV),Si 2p(100.21 eV),Al 2s(117.1 eV),Al 2p(71.96 eV),K 2s(376.4 eV),K 2p(292.5 eV),O 1s(530 eV)以及C 1 s(测试中加入)。全谱分析的结果表明纳米沸石晶体的主要元素组成为K、Si、Al和O,这与XRD和EDS的分析结果是一致的。图7b和图7c显示了Al 2p和Si 2p的高精度扫描和分峰拟合结果。Al和Si的XPS峰均可分解为Al 2p 2/1、Al 2p 3/2、Si 2p 2/1和Si 2p3/2 的峰,说明材料中存在以Al和Si为中心的Al-O和Si-O四面体结构[24]。
2.2 纳米沸石晶体对重金属的吸附
2.2.1 pH对重金属吸附的影响 图8为溶液pH对纳米沸石晶体吸附Cu和Cd的影响。随着溶液pH的增大,沸石晶体对Cu和Cd的吸附量明显增大。溶液pH增大到6以后,Cu和Cd的吸附效率均可接近100%。在pH相同的条件下,沸石晶体对Cd的吸附量比对Cu的吸附量大。例如,pH为4时,Cu的吸附量为67 mg/g,Cd的吸附量为87 mg/g;pH为8时,Cu的吸附量为99 mg/g,Cd的吸附量为99 mg/g。推测导致这种现象的原因有以下几点[13]:首先,溶液中存在OH-和H+,由于H+带正电荷,其在溶液吸附过程中就会与Cu2+和Cd2+产生竞争吸附作用。低pH时溶液中H+浓度很大,此时竞争吸附效果更加明显,从而影响Cu和Cd的吸附效果。其次,沸石晶体表面带有电荷,而带电荷是吸附重金属离子的重要因素。结合图9纳米沸石晶体表面Zeta电位分析得出,纳米沸石晶体表面Zeta电位随溶液pH增大而减小。当溶液pH为2时,纳米沸石晶体表面Zeta电位为4.6;当pH为4时,吸附剂表面Zeta电位为-2.1;当pH>4以后,沸石晶体表面均带负电荷。表面负电荷越多,对正价金属离子的吸附效果越好(图8)。此外,当吸附体系溶液pH增大到7以上时,Cu和Cd会产生氢氧化物沉淀,这也可能是其去除率升高的原因。

图5 纳米沸石晶体的SEM和EDSFig.5 SEM and EDS of nanozeolite crystals

图6 纳米沸石晶体的TEM Fig.6 TEM of nanozeolite crystals
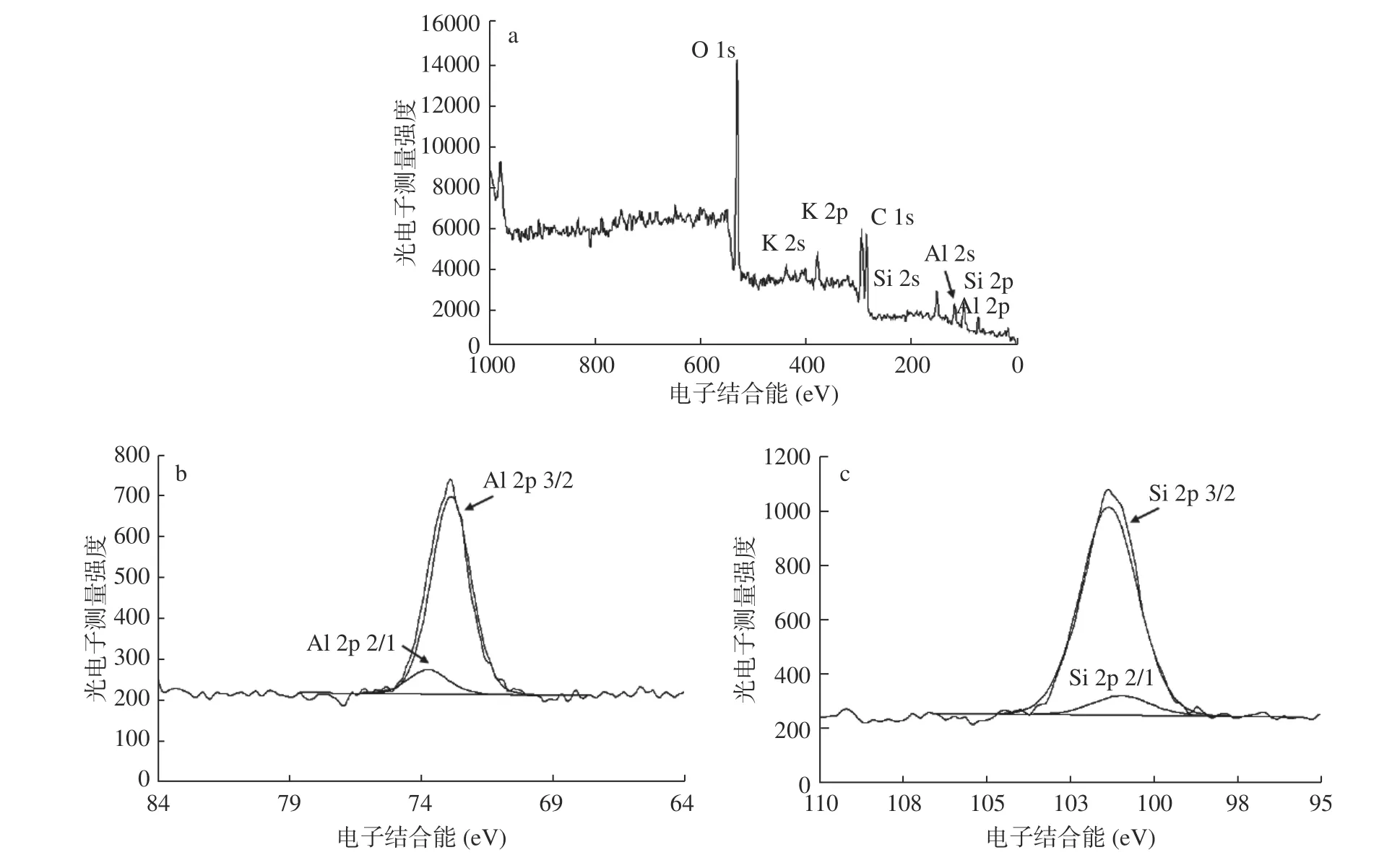
图7 纳米沸石晶体的XPS分析Fig.7 XPS Analysis of nanozeolite crystals
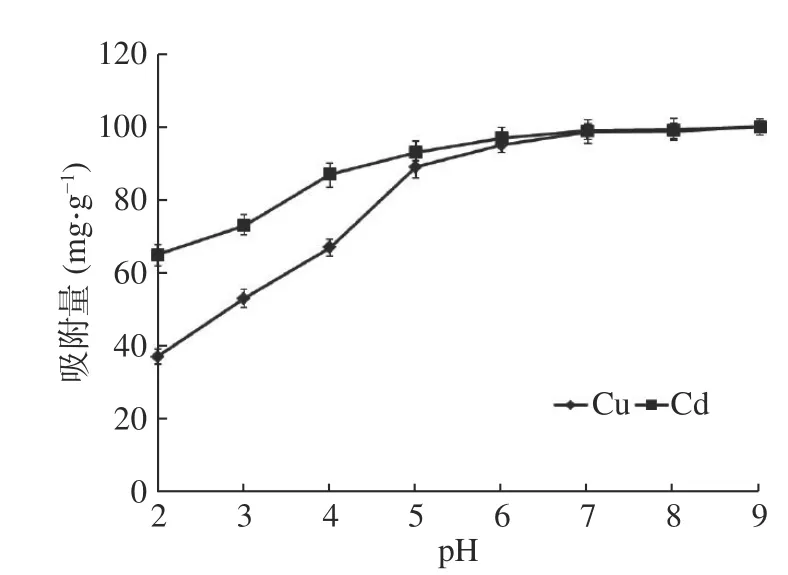
图8 溶液pH对吸附效果的影响Fig.8 Effect of solution pH value on adsorption

图9 纳米沸石晶体表面的Zeta电位分析Fig.9 Zeta potential analysis of nanozeolite crystal surface
2.2.2 吸附时间对重金属吸附的影响 图10为单一吸附体系下吸附时间对吸附效果的影响。从图10中可以得出,随着时间的延长,Cu和Cd在纳米沸石晶体上的吸附量增加,并且在200 min左右达到吸附平衡。同时,在任何吸附时间,沸石晶体对Cd的吸附量都大于Cu。如210 min时,Cu的吸附量为118 mg/L,Cd的吸附量为186 mg/L。
图11为复合吸附体系下吸附时间对吸附效果的影响。与图10的结果类似,在复合吸附体系下,随着反应时间的延长,Cu和Cd在纳米沸石晶体上的吸附量仍然增加,吸附体系在200 min左右达到吸附平衡。纳米沸石晶体对Cd的吸附量同样大于Cu。但是,复合吸附体系与单一吸附体系的结果也有所不同,主要体现在纳米沸石晶体对Cu和Cd的吸附量都有所下降,且Cd的下降幅度相对Cu更大。

图10 单一吸附体系下吸附时间对吸附量的影响Fig.10 Effect of adsorption time on adsorption capacity under single adsorption system

图11 复合吸附体系下吸附时间对吸附量的影响Fig.11 Effect of adsorption time on adsorption capacity under competitive adsorption system
2.2.3 吸附动力学 吸附过程的动力学方程如下[12]:准一阶动力学模型为:
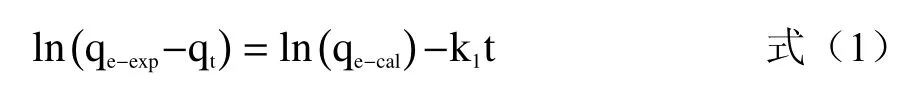
式中,qt:吸附剂在吸附时间t时单位质量吸附的重金属质量,mg/g;qe-exp和qe-cal:吸附剂在吸附平衡时单位质量吸附的重金属量,mg/g;k1:一阶模型的速率常数,min-1;t:时间,min。
准二阶动力学模型为:

式中,qt:吸附剂在吸附平衡时单位质量吸附的重金属的质量, mg/g;qe-cal:吸附剂在从模型计算获得的吸附平衡的单位质量吸附的重金属量,mg/g;k2:二阶模型的速率常数,g·mg-1·min-1;t:时间,min。

图12 单一吸附体系的准一级吸附动力学分析Fig.12 Quasi-first-order adsorption kinetics analysis under single adsorption system

图13 复合吸附体系的准一级吸附动力学分析Fig.13 Quasi-first-order adsorption kinetics analysis under composite adsorption system

图14 单一吸附体系的准二级吸附动力学分析Fig.14 Quasi-second-order adsorption kinetics analysis under single adsorption system
利用准一级与准二级动力学方程将图10和图11的实验结果进行拟合,具体结果显示在图12~图15、表1和表2中。无论是单一吸附体系还是复合吸附体系,由准二级动力学模型拟合结果的R2>0.99,而准一级动力学模型拟合结果的R2<0.88。同时,在两个吸附体系下,准二级动力学方程计算得出的qcal值与实验获得的qexp值更相吻合。因此,准二级动力学方程更加适合于描述纳米沸石晶体对Cu和Cd的吸附行为。

图15 复合吸附体系的准二级吸附动力学分析Fig.15 Quasi-second-order adsorption kinetics analysis under composite adsorption system

表1 单一吸附体系准一级和准二级速率常数Table 1 Pseudo-first-order and pseudo-second-order rate constants in single adsorption system

表2 复合吸附体系准一级和准二级速率常数Table 2 Pseudo-first-order and pseudo-second-order rate constants in composite adsorption system
2.2.4 吸附等温线 Langmuir等温式如下[25]:

式中,qe和Ce是吸附量和溶液上重金属浓度,单位分别为mg/g和mg/L,均处于平衡状态;kL是与吸附能量有关的Langmuir常数, L/mg;qm是最大吸附量,mg/g。
Freundlich等温式如下[26]:

式中,kF和n是Freundlich等温式的常数,分别表示吸附容量(mg/g)和吸附强度。
图16~图19显示的是Cu和Cd在纳米沸石晶体上吸附过程的Langmuir吸附等温线与Freundlich吸附等温式拟合结果。相关计算结果显示在表3和表4中。由图13、表3和表4可以得出,无论是单一吸附体系还是复合吸附体系,用Langmuir等温式计算得到的R2值均大于0.9,拟合程度高于Freundlich等温式计算得到的R2值。因此,Langmuir等温式更适用于描述沸石晶体对Cu和Cd的吸附行为。

图16 单一吸附体系的Langmuir等温式拟合结果Fig.16 Langmuir isotherm fitting results for single adsorption system
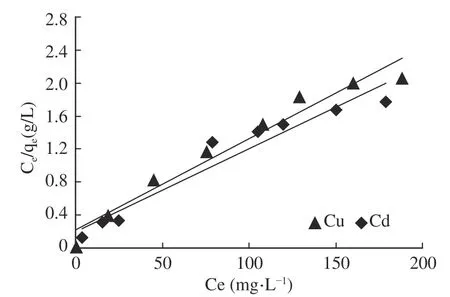
图17 复合吸附体系的Langmuir等温式拟合结果Fig.17 Langmuir isotherm fitting results for composite adsorption system

图18 单一吸附体系的Freundlich等温式拟合结果Fig.18 Freundlich isotherm fitting results for single adsorption system

图19 复合吸附体系的Freundlich等温式拟合结果Fig.19 Freundlich isotherm fitting results for composite adsorption system
2.2.5 吸附效果对比 表5总结了文献中典型吸附材料对于Cu、Cd的吸附量。本研究中纳米硅铝酸盐沸石晶体对Cu与Cd的吸附量分别为120 mg/g与190 mg/g,表5中除壳聚糖和MOF-2外,其它吸附材料对Cu与Cd的吸附量均小于纳米硅铝酸盐沸石晶体。通过表5的吸附结果可以看出,本研究所合成的纳米沸石晶体材料对于重金属Cu与Cd的吸附量总体处于较为良好的吸附水平,这表明纳米晶体沸石在重金属废水吸附领域有良好的应用前景。
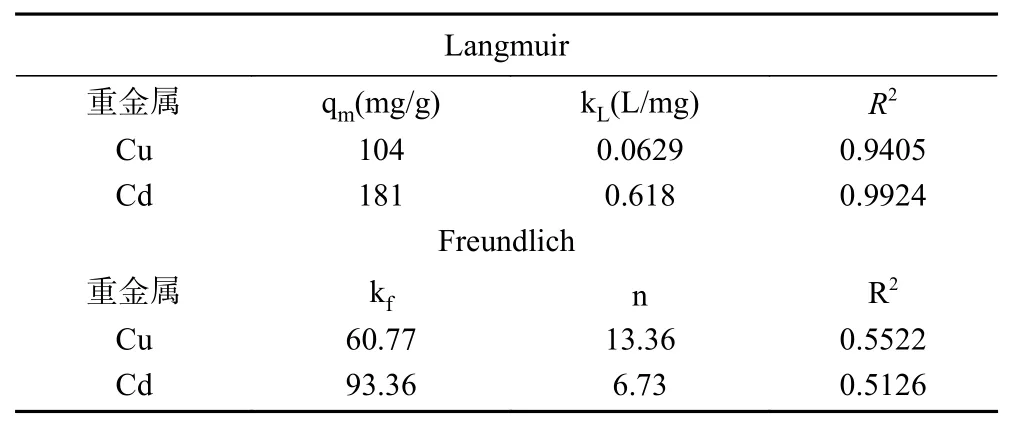
表3 单一吸附体系的吸附等温线常数Table 3 Adsorption isotherms constants in single adsorption system

表4 复合吸附体系的吸附等温线常数Table 4 Adsorption isotherms constants in composite adsorption system

表5 不同吸附剂对Cu和Cd的吸附效果Table 5 Adsorption effect of different adsorbents on Cu and Cd
3 结论
在沸石制备过程中引入双特征官能团长链有机物作为结构限制模板,使其微观结构从微米级尺寸转变成纳米级尺寸,SEM分析与TEM分析结果显示合成材料的尺寸为200~500 nm,FT-IR、XRD与XPS分析结果显示该材料属于纳米硅铝酸盐沸石晶体,比表面积分析结果显示材料的液相比表面积高达2123.6 m2/g。
纳米沸石晶体对重金属的吸附效果良好。随着溶液pH的增大,材料对Cu和Cd的吸附量明显增大,而材料表面的Zeta电位随着溶液pH的增大而减小,在pH达到4之后,纳米沸石晶体表面基本带负电荷。在单一吸附体系与复合吸附体系下,随着反应时间的延长,Cu和Cd在纳米沸石晶体上的吸附量增加,且材料对Cd的吸附量均大于Cu;准二级动力学方程可描述两个吸附体系下纳米沸石晶体对Cu和Cd的吸附行为;Langmuir等温式更适用于表达两个体系下纳米沸石晶体对Cu和Cd的吸附行为。与其它吸附材料相比,纳米沸石晶体对重金属Cu与Cd的吸附量较高,其在重金属废水吸附领域有良好的应用前景。

