复水干土的无机氮组分及对鲜土检测的可替代性
李仰征, 李 兰, 柯西祥, 赵曼昀, 贺 茂, 雷兴庆, 殷 健
(贵州工程应用技术学院 生态工程学院, 贵州 毕节 551700)
0 引言
【研究意义】氮素是植物生长的重要影响元素之一。无机氮虽然在土壤全氮中占比较低,但其是植物直接利用氮的主要形式,因此在土壤研究领域受到广泛关注。由于野外采样和室内检测的复杂性,往往导致使用新鲜土样进行检测的要求无法得到保障,以致风干土样作为一种便捷的预处理模式被国内外学者所广泛采纳[1-4]。【前人研究进展】与鲜土相比,风干过程会导致有机物质矿质化加速,致使无机氮含量不同程度地提高[5-7]。风干过程最直接的表现是土壤水分的损耗,使得氮的转化与平衡受到干扰。因此,复水过程能否消除干土效应、恢复原有土壤生境并用于后续其他研究值得关注。国外的研究起步较早且主要集中在土壤微生物领域。BIRCH[8]研究发现,复水培养后,土壤呼吸作用明显增强。PLACELLA等[9]研究发现,复水干土前后氨氧化微生物种群结构并未发生明显变化。国内也有零星报导,沈其荣等[3]开展了复水干土过程对无机氮的影响研究工作;周雪等[10-11]比较了复水干土过程对土壤微生物增殖的影响。鲍俊丹等[12-13]发现,土壤亚硝态氮含量与氮肥施用量和水分含量均呈直线正相关,且相关性达显著水平。【研究切入点】总体而言,有关复水干土过程对土壤无机氮影响方面的研究偏少且风干时长随意性较大,涉及的无机氮指标也不全面,亚硝态氮往往被忽略。虽然亚硝态氮是硝化作用的过渡产物,但可通过植物根系吸收或淋溶进入其他环境介质,进而可能产生更深远的生态风险。综上,复水干土过程不同时段无机氮组分的变化规律目前仍未见专题报导,干土过程中的土壤能否替代新鲜土壤进行相关形态氮的检测工作仍无明确论断。因此,专题研究复水干土过程对土壤各无机氮组分的时间序列影响,在丰富土壤氮素循环理论和改进检测手段等方面具有重要意义。【拟解决的关键问题】以毕节市七星关区林下鲜土及复水风干土为研究对象,通过检测分析土壤全氮、铵态氮、亚硝态氮与硝态氮等指标,研究复水干土过程对林下土壤无机氮组分的影响,进而确定鲜土无机氮的可替代性时间节点等,旨在为改进土壤氮素检测手段提供参考依据。
1 材料与方法
1.1 研究区概况
毕节市七星关区位于贵州省西北部,为滇东高原向黔中山原过渡地带,海拔1 400~1 500 m,年均温与降雨量分别为12.8℃和900 mm。地表出露岩石以二叠纪和三叠纪的沉积灰岩为主,属亚热带高原季风气候,岩溶地貌发育充分。在城市郊区选择植被郁闭度差异明显的景观林地3个,分别对应《土地利用现状分类》(GB/T 21010—2017)中的乔木林地、灌木林地和其他林地3种土地类型。3个样地环境条件如表1所示。样地空间间距0.5~1 km,以保证母质和气候等成土因素较为接近。
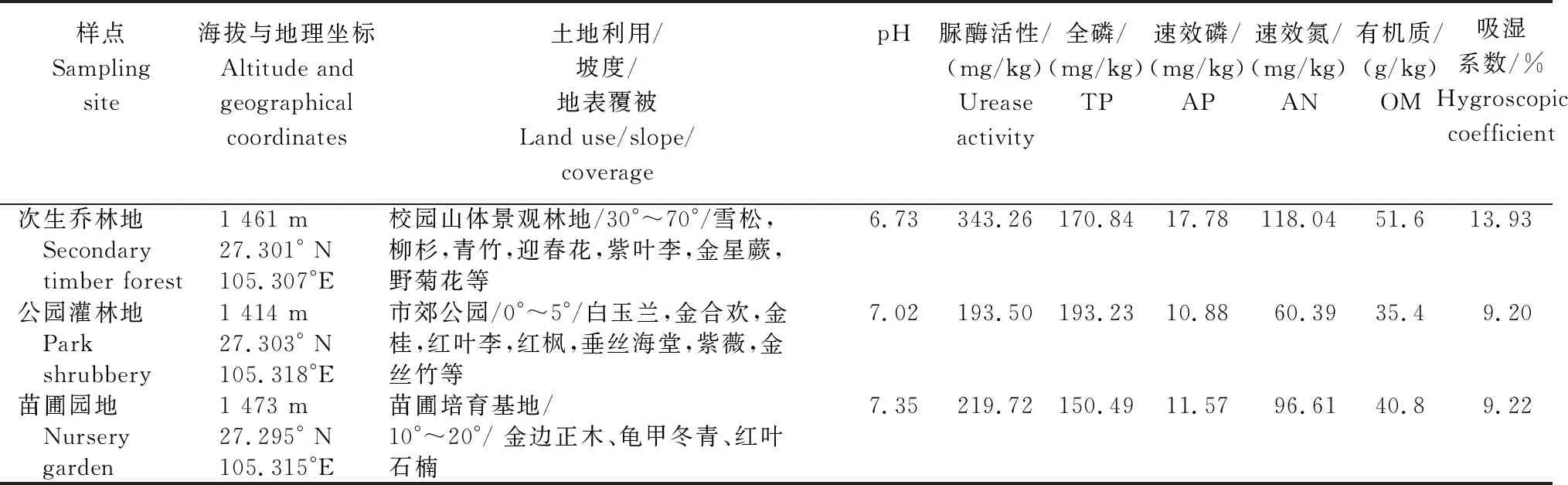
表1 样点地理坐标、环境条件及土壤理化性质
1.2 材料
1.2.1 土样 于2019年8月梅花布点采集表层鲜土,去除杂物四分法保留土样备用。
1.2.2 试剂 相关化学药品纯度级别均为分析纯或化学纯,实验用水为二次蒸馏水。
1.3 方法
1.3.1 土样预处理 24 h内检测鲜土全氮、铵态氮、亚硝态氮、硝态氮和脲酶活性等指标。取过2 mm筛的自然风干土样测定其酸碱度、有机质、全磷、速效磷、速效氮等指标。复水干土过程是将盛有饱和硫酸钾溶液的烧杯置于玻璃质容器底部,再平铺风干土于烧杯周边并用凡士林密闭玻璃容器,整个过程为厌气环境,10 d后每天测定其土壤含水率,直至其数据基本恒定不再增长即代表复水过程结束,此时土壤吸湿水含量达最大,随即取出复水后土壤置于室温下好气环境再次自然风干。
1.3.2 复水干土过程土壤相关氮含量检测 于风干过程第1天(9月16号)、第3天、第5天、第7天、第10天、第15天、第20天、第25天、第30天、第40天、第55天、第70天和第85天检测其土壤相关氮含量。分别采用重铬酸钾外加热法、钼锑抗比色法、酸溶比色法、靛酚蓝比色法、N-(1-萘基)-乙二胺光度法、酚二磺酸光度法、碱解扩散法及氨释放量法测定土壤有机质、速效磷、全磷、铵态氮、亚硝态氮、硝态氮、速效氮及脲酶活性等指标[14],3次平行。各指标计算时均以扣除水分的干土计量。为研究土壤含水率和环境温度对土壤相关氮含量的影响,同时采用烘干法测当天土壤含水率和记录气温均值。
1.3.3 干土过程对鲜土无机氮检测的可替代性 干土不同时段无机氮含量变化显著[11],因此,为比较不同复水干土各时段土壤与新鲜土无机氮含量的差异,将数据作归一化处理:以铵态氮为例,某风干时间节点各样地铵态氮含量除以各自新鲜土铵态氮含量,得到无量纲的比值R。然后计算3个土样此时间节点R的标准差N,如N值为整个干土过程的最小值,说明该时间节点的干土与新鲜土壤的铵态氮含量最为接近。为对3种无机氮作出统一评判而引入综合可替代性指数M,其为3种无机氮在某时刻标准差N的算术平均值。
1.4 数据统计与分析
数据采用Excel 2003和SPSS 17.0进行处理分析,采用CorelDRAW 12进行作图。
2 结果与分析
2.1 复水干土过程土壤全氮含量变化
从图1看出,全氮含量在干土过程中并不稳定。3个土样在风干早期均表现出上升态势。其中,苗圃园地和次生乔林地在第15天出现明显峰值,全氮含量分别为1 112.41 mg/kg和1 322.56 mg/kg,为各自干土第1天含量的1.44倍和1.50倍,峰值效果明显。之后出现不同程度的下降态势并逐渐趋于稳定。第85天时3个样地全氮均值与新鲜土壤含量(图1中虚线纵轴右侧所示)相差较小,比率均值为95.56%。对3个样地土壤全氮均值与干土天数的方差分析也表明,第15天时全氮含量与第3天、第5天、第7天、第10天和第20天时无显著差异,而与其他时段差异达显著水平。
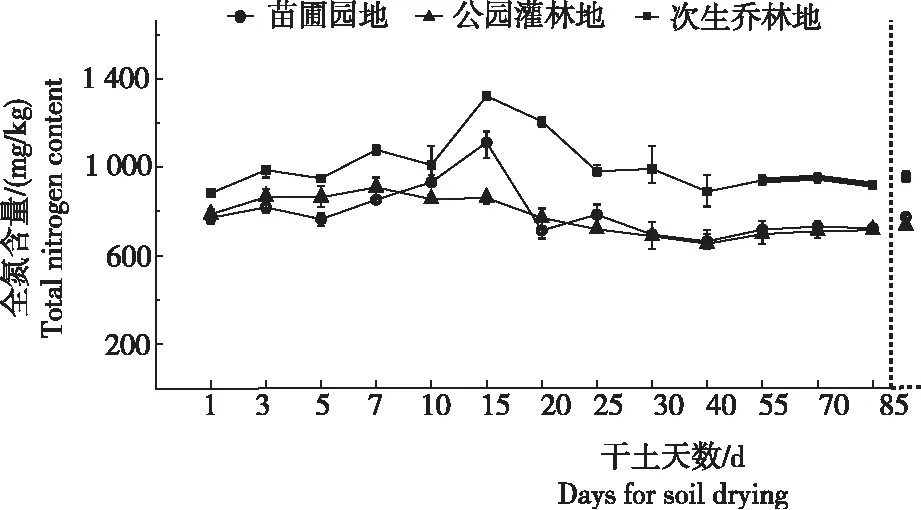
图1 复水干土过程土壤全氮变化曲线
2.2 复水干土过程土壤无机氮含量及环境条件变化
从图2看出,整个干土过程无机态氮含量的变化存在较大差异。最大的为铵态氮,含量为18.79 mg/kg,占无机氮的85.44%;其次是硝态氮,为3.11 mg/kg;亚硝态氮含量最低,为0.10 mg/kg,占比仅0.52%。与大多数土壤无机氮的研究报导结果是一致的,证实了亚硝态氮只是中间过渡产物含量有限的结论。干土第1天土壤铵态氮含量为最大,之后下降并稳定,第40天以后与鲜土含量(图2中虚线纵轴右侧所示)基本持平。根据干土过程不同时段无机氮含量的特点,可将整个过程大致划分为干土早期(1~10 d)、中期(10~40 d)和后期(40 d以后)共3个时段。干土早期铵态氮含量递减速率显著大于中期和后期,3个样地氨氧化速率(AR)均值为4.41 mg/(kg·d),与苏瑜等[15]的研究结果3.22 mg/(kg·d)较为接近,且铵态氮在干土早期结束时含量已趋稳。亚硝态氮和硝态氮也有类似情况,但其时间略有提前,均在第5天或第7天以后曲线已基本平稳(硝态氮的次生乔林地例外)。表明,干土早期阶段是复水后土壤氮素平衡的调整期,之后各无机氮含量理应稳定少变。但亚硝态氮与其他形态无机氮相比,其曲线并没有稳定地保持到整个干土过程结束。第30天后出现明显的上升态势,硝态氮的2个样地也在第70天出现明显波动。以苗圃园地为例,第70天其硝态氮含量为2.40 mg/kg,而其前后的第55天和第85天分别仅为0.84 mg/kg和0.86 mg/kg,峰值特点显著。整个干土过程3个土样含水率均出现明显变化,总体表现为干土过程早期土壤含水率逐步下降,干土中期趋于平稳,而干土后期由于受到大气温度影响土壤含水率又出现波动。
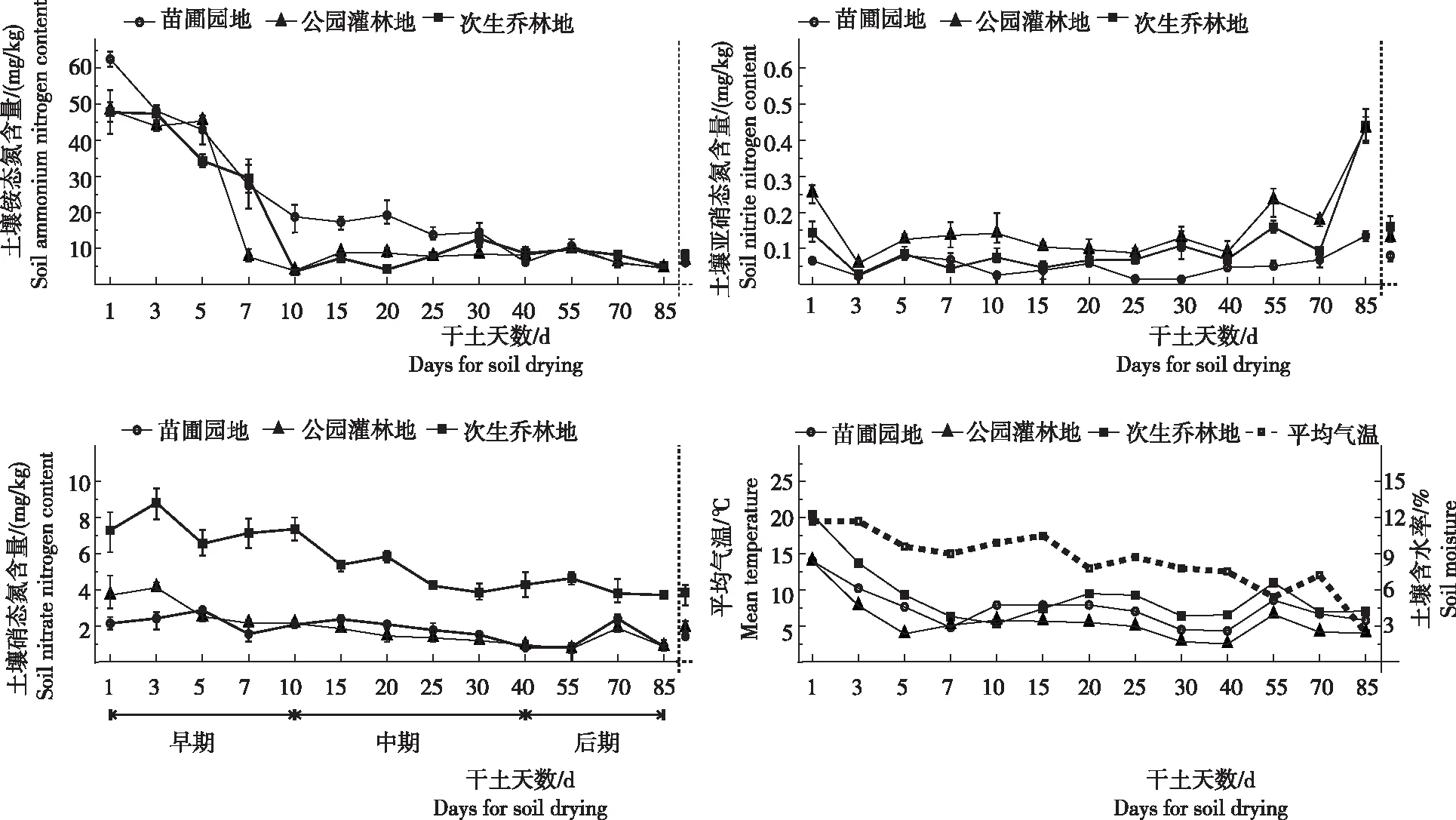
图2 复水干土过程土壤无机氮含量及土壤水分与大气温度曲线
2.3 干土过程对鲜土无机氮检测的可替代性
从图3看出,铵态氮在干土中期以后(40 d)与新鲜土壤含量最为接近,直至干土过程结束其标准差变化都较小。硝态氮则在整个干土过程中变化均不显著;在第30天与新鲜土含量最为接近,标准差为0.23。亚硝态氮在干土第1天和干土后期与鲜土差异最大。由此可见,干土过程各无机氮的替代性时间节点并无明显联系及规律所循。鉴于干土过程各无机氮的替代性时间节点关联性不强,为作出统一评判故而引入综合可替代性指数M进行评价。在第40天时M值仅为0.20,且该时间节点以后土壤全氮已经稳定。40 d以后的硝态氮与亚硝态氮波动导致该值出现起伏(在第55天较为明显)。如果整个干土过程大气环境相对恒定,无论后续干土时长有多久,土壤氮素循环应接近平衡状态。因此,大气环境稳定条件下40 d以后可以作为复水干土替代新鲜土进行无机氮检测的时间节点。

图3 复水干土过程土壤无机氮标准差及可替代性指数分布
3 讨论
土壤全氮主要源于成土母质中的矿物风化、动植物残体返还、人为施加、大气沉降和微生物固氮等途径。被采集时生物返还和大气沉降就即刻终止,矿物的风化速率又极为缓慢,短时间内不可能有矿物晶体分解对土壤全氮产生影响。所以,微生物固氮是导致干土过程中全氮升高的唯一可能因素。土壤中很多的自生固氮菌属,如柄杆菌、红球菌等[16]均可通过自身固氮酶直接把空气中的氮分子转化为自身生长发育的营养所需,待其消亡后又以有机态形式补给土壤。吴越等[7]在对福建某林区新鲜土壤的风干过程中也发现7 d后全氮含量比第1天有明显增大的现象(增幅为20%~30%),但其只进行2个时段的对比。并且,人为筛选菌种的固氮效率则更为高效,黄慧岳等[17]在湖南分离的某株固氮菌,接种培养第20天土壤全氮含量达到整个培养过程的最大值(为初始含量的4倍),且之后全氮含量基本稳定。其固氮效率远大于吴越等[7]和本研究结果,可能与其土壤接种后是恒温恒湿培养环境有关,且接种前的灭菌处理排除了其他菌种对该菌种后期固氮效果的干扰。
复水过程是密闭厌气环境,干土过程前期土壤全氮出现明显增长,表明研究区域土壤固氮菌是以好气性菌群为主体的。目前已发现的固氮菌也多属此类,张崇邦等[18]在浙江天台山发现好气性固氮菌群无论从种类还是数量均比厌气菌占优势。本研究结果表明,15 d以后3个样地土壤全氮均出现不同程度的递减现象,与干土过程导致的土壤水分丧失有关。以次生乔林地为例,干土第1天含水率为12.23%,但到第15天时则仅为4.43%。魏万玲等[19-20]研究证实,土壤微生物活性、丰度与水分含量呈明显的正相关关系;林江辉等[11]发现,复水培养5 d时土壤中放线菌和真菌数量甚至还大于新鲜土样。而地域空间紧临的公园灌林地之所以全氮峰值不明显,可能与其是城市休憩公园,农业生产(改建以前为农业用地)与园林管理的药物喷洒抑制了土壤微生物的活性有关;其土壤脲酶活性为3个样地最低,也说明该样地微生物活性有限[21-22]。张瑞福等[22-23]研究表明,固氮菌活性因农药影响而受到不同程度的抑制。
苗圃园地和次生乔林地全氮含量均在25~30 d回落并趋于稳定,表明生物固氮与氮素矿质化的耗损在逐步接近平衡。即水分逐步降低微生物休眠甚至是死亡,导致其活性下降进而致使矿质化作用被抑制,固氮作用、氨化、硝化与反硝化等生化过程均趋于缓慢或停滞状态。复水过程虽然激活了风干土壤菌群的生物活性[10],但随着干土过程的持续推进,新增殖的固氮菌受干旱胁迫又大量消亡,其残体细胞内物质渗出并迅速被矿质化[7]。沈其荣等[3]通过施加同位素氮肥法对比发现,干土效应导致被分解的有机氮绝大多数来自于施肥而新增的微生物体,且新固定态氮的矿化率是未施肥对照土样的5倍;GROGAN等[25]也有类似研究结论,因此导致在第30~40天以后全氮含量走势平稳直至整个风干过程结束,且与新鲜土样含量基本持平。所以,复水干土后的土壤可以基本表征新鲜土样的全氮含量。但务必使土壤彻底风干,以保证新固定的氮又随微生物残体的氨化或反硝化等过程而损耗。
无机氮含量变化方面,在复水干土过程第1天土壤铵态氮出现峰值后就逐步下降并稳定。这是因为铵态氮源于蛋白酶对有机物的分解,且无论好气与否均有微生物参与该过程。厌气复水过程导致了土壤微生物的增殖,其代谢死亡残体被分解会产生氨。刘亚军等[26]也发现,土壤水分的增加对铵态氮含量有显著的提升作用。干土过程第3天3个样地土壤亚硝态氮已显著下降,而硝态氮在同一天则有明显上升态势(苗圃园地则延续到第5天仍在增长)。这是由于硝化作用的参与者氨氧化菌(AOA和AOB)和亚硝酸氧化菌(NOB)的绝大多数都是好氧菌群,虽然氨氮是其菌群增殖的底物,但厌气条件下其无法对氨进行硝化,导致干土初始时所有土样铵态氮含量都非常大。好气干土过程一旦启动,氮素的矿质化由氨化与反硝化作用为主体转变为氨化和硝化作用为主导,亚硝态氮含量迅速下降而硝化产物即硝态氮含量迅速升高。即表现为干土过程结束时(第85天)相对于第1天的硝化率(硝态氮与无机总氮含量之比)的大幅增长,公园灌林地(由7.10%增至14.70%)、苗圃园地(由3.30%增至14.94%)和次生乔林地(13.21%增至39.43%)分别增长1.07倍、3.52倍和1.98倍。增长倍数在苗圃园地为最大,并且其第1天铵态氮含量即高达62.51 mg/kg,明显大于其余2个样地。但其有机质含量和脲酶活性反而均低于次生乔林地,具体原因有待于后续研究。
干土过程中后期土壤亚硝态氮与硝态氮出现波动与风干环境密切相关。许多研究表明,微生物对介质酸碱性、含氧量、温度、水分和光辐射等环境条件敏感。鉴于该研究是在室内非恒温开放环境实施的,因此最易产生变化的环境因素就是土壤水分和大气温度。第40天以后的水分曲线波动很可能与之前的温度较高(大于15℃)有关。干土中期阶段环境条件稳定相关菌群活性也较为平稳,导致无机三氮在此时段总体上较为稳定。但是当环境条件发生明显改变时,此平衡被打破。在第55天和第85天前后有冷空气过境,气温曲线表现为低-高-低的特点。硝态氮曲线与其完全一致,而亚硝态氮则恰恰相反,呈现出高-低-高的态势。表明,硝化过程不同阶段的微生物对环境条件突变的响应存在着差异。相对于亚硝酸氧化菌,氨氧化菌在应对丰水、氧气匮乏、低温等环境胁迫方面有更强的适应性[27]。从土壤含水率看,干土早期呈近线性的下降特点,约7 d后含水率趋稳且呈微幅波动状态。这是因为在干土早期结束后,原复水过程主要存在于毛管孔隙的吸湿水分也逐步蒸发而消耗,此后土壤吸湿水含量则显著受大气湿度变化影响,而大气湿度又制约于温度条件。第55天时3个土样含水率与前后相比均有峰值,这与冷空气侵袭造成的大气饱和水汽压下降,空气中水汽在土粒表面凝结有关[28]。闫钟清等[13]原位土壤实验显示水分增加可诱发硝酸还原酶活性,而对亚硝酸还原酶则表现为抑制,两者共同作用的结果是产生亚硝态氮的累积,其他学者也有类似发现[29-30]。但含水率并不是唯一的影响因素,如第85天气温维持在4℃左右,此时3个土样含水率与各自30~40 d(气温为12℃)含水率十分接近,但亚硝态氮含量却显著高于30~40 d的含量。江秋群等[31]在对同一城区大气环境中也发现,亚硝态氮沉降通量在冬季为全年最大。这表明环境水分相对稳定条件下,低温对亚硝酸氧化菌的抑制作用较氨氧化菌明显,表现为氨氧化菌的生化产物亚硝酸根无法被有效损耗而累积。
虽然本案例得到大气环境稳定条件下第40天可以作为复水干土替代新鲜土进行无机氮检测的时间节点。但从数据本身看,即使是M值最小的第40天,干土过程中的土壤铵态氮、亚硝态氮和硝态氮与鲜土相比,都分别有0.682 mg/kg、0.053 mg/kg、和0.670 mg/kg的绝对差值,相对误差为9.89%~42.30%,最大相对误差出现在绝对含量最低的亚硝态氮指标上。因此,从严谨的治学精神和务实的研究态度来看,土壤氮的测定还是以鲜土为理想用土。
4 结论
由于复水过程激活了土壤固氮菌活性导致干土中期全氮出现显著峰值,约为复水结束时含量的1.50倍。随着水分丧失峰值逐步消退并保持到整个干土过程的结束。干土后期与鲜土相比全氮仅有约5%差异,因此彻底风干后的土壤可替代鲜土实施全氮检测。
厌气复水致使土壤铵态氮在干土初期达到最大。干土过程导致土壤硝化率明显提升,这与硝化菌的好氧性质有关。干土早期是复水后土壤氮素平衡的调整期,干土中期无机三氮则稳定少变。干土后期亚硝态氮和硝态氮含量受大气环境影响显著,尤以亚硝态氮波动最为剧烈。这是因为同等土壤水分条件下,低温对亚硝酸氧化菌的抑制作用较氨氧化菌明显,亚硝酸根无法被损耗而累积。
大气环境条件稳定情况下复水风干40 d以后可作为替代新鲜土进行无机氮检测的时间节点。但与鲜土相比会存在一定的误差。鲜土仍是土壤检测的理想用土。不同自然环境土壤涉氮微生物种类及固氮效果差异明显,土壤、大气等自然环境与土地利用等人文环境也不尽一致,该研究结果的普适性如何,有待于与其他地域作对比和验证。

