奶牛犊牛腹泻源大肠埃希氏菌耐药情况及LEE相关基因的检测
高海慧,王建东,高小斐,王培柱,吴学青,厉 龙,康晓冬
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.陕西省榆林市定边县樊学镇畜牧兽医站,陕西定边 718699;3.宁夏吴忠市利通区扁担沟镇畜牧兽医工作站,宁夏吴忠 751100;4.宁夏石嘴山市惠农区动物疾病预防控制中心,宁夏平罗 753200)
犊牛腹泻是犊牛饲养中常见的、危害性较大的一种传染性疾病,由致病性大肠埃希氏菌引起的占90%[1],尤其使得7日龄以内犊牛出现腹泻,其发病率较高[1]、病死率很高[2]。 临床上主要表现为动物消化机能损伤,出现腹泻、发热、脱水、消瘦,急性病例可突然死亡。在大群饲养环境中,犊牛腹泻发病可达90%~100%,病死率高达30%以上[1]。大肠埃希氏菌是兽医临床上最常见的病原之一[3],也是人和动物的肠道组织中探索较为清楚的细菌之一[4]。大肠埃希氏菌是一种条件性致病菌,受到环境、应激、自身免疫力等影响会引起发病,患病机体还可能继发感染其他病原,呈地域性流行。大肠埃希氏菌的血清型众多,给大肠埃希氏菌病的预防带来困难,目前仍没有有效的疫苗可用于大肠埃希氏菌病的预防[5],使用广谱抗菌药物为主要的治疗手段,抗菌药物在各个养殖场的普遍和大量使用使得大肠埃希氏菌耐药性问题越发严重,包括禽、猪、牛、羊等源性菌[6-9]。大肠埃希氏菌的致病性越来越强,耐药性和多重耐药性也就越来越强,二者之间存在密切的联系[10-11],同时,细菌的毒力与其毒力岛有着密切联系。肠细胞脱落位点 (locus of enterocyte effacement, LEE) 毒力岛。主要对动物的肠黏膜细胞产生黏附-抹去损伤,ler基因为LEE毒力岛中心调节基因,eaeA基因编码外膜蛋白紧密素[6]。因此,本试验采集宁夏地区奶牛场1~2月龄腹泻犊牛肛门拭子,开展腹泻源性大肠埃希氏菌的耐药性及LEE毒力岛携带检测,以期为预防及治疗犊牛腹泻提供参考。
1 材料与方法
1.1 材料
1.1.1 病料 于2018年1月至2019年9月采集宁夏地区5市16个规模化奶牛场腹泻犊牛(1~2月龄)肛门拭子157份,装于灭菌离心管收集,标记时间,年龄,场别,4 h内送回实验室增菌培养。
1.1.2 主要试剂 营养肉汤培养基(NB)(20170704),北京陆桥技术有限责任公司产品;伊红美蓝琼脂培养基(EMB)(20170704)、麦康凯琼脂培养基(MAC)(20170831),青岛海博生物技术有限公司产品;16S rRNA、eaeA、ler基因扩增引物,上海生物工程技术有限公司合成;药敏试纸片,杭州天和微生物试剂有限公司;革兰氏阴性细菌鉴定卡、VITEK 2 Compact全自动细菌鉴定及药敏分析系统,法国梅里埃公司产品;细菌基因组DNA提取试剂盒、DNA标准DL600、2×TaqPCR MasterMix,天根生化科技(北京)有限公司产品。
1.1.3 主要仪器 洁净工作台(SW-CJ-1FD),苏净集团安泰公司产品;全自动细菌鉴定系统(VITEK 2 Compact),法国生物梅里埃股份有限公司产品; PCR仪(T-100)、电泳槽(Sub-Cell®GT Cell)、凝胶成像仪(Gel DocTMXR+),美国Bio-Rad公司产品。
1.2 方法
1.2.1 大肠埃希氏菌的分离 无菌采集的肛门拭子放入营养肉汤培养管,37℃培养16 h~24 h,增菌培养物接种于EMB、MAC,37℃培养16 h~24 h,疑似菌镜检纯化。
1.2.2 大肠埃希氏菌菌种鉴定 镜检为杆菌,纯化培养物用电子比浊仪测定菌液浓度并调整为0.5个麦氏单位,全自动微生物鉴定系统(VITEK 2 Compact)进行菌种鉴定。
1.2.3 细菌16S rRNA鉴定 参考16S rRNA通用引物序列[12],引物序列见表1。PCR扩增反应体系为50 μL,上游、下游引物(10 μmol/L)各1.0 μL,2×TaqPCR Master Mix 25.0 μL,DNA模板2.0 μL,ddH2O补足。扩增条件为:95℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 10 min,29个循环;72℃ 10 min。阳性产物测序,测得序列进行Blast比对。
1.2.4 药敏试验 选择19种药敏纸片,采用K-B法,根据临床实验室标准化委员会 (CLSI) 标准判定结果。
1.2.5 LEE相关基因PCR检测 参考文献设计ler[13]、eaeA[14]的特异性引物,具体见表1。eaeA、ler基因的PCR条件为:50 μL体系:2×TaqPCR MasterMix 25 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板4 μL,ddH2O补全。eaeA基因的PCR条件为:94℃ 3 min;94℃ 30 s,66.1℃ 30 s,72℃ 1 min,29个循环;72℃ 10 min;ler基因的PCR条件为94℃ 10 min;94℃ 40 s,57℃ 30 s,72℃ 30s,29个循环,72℃ 10 min。
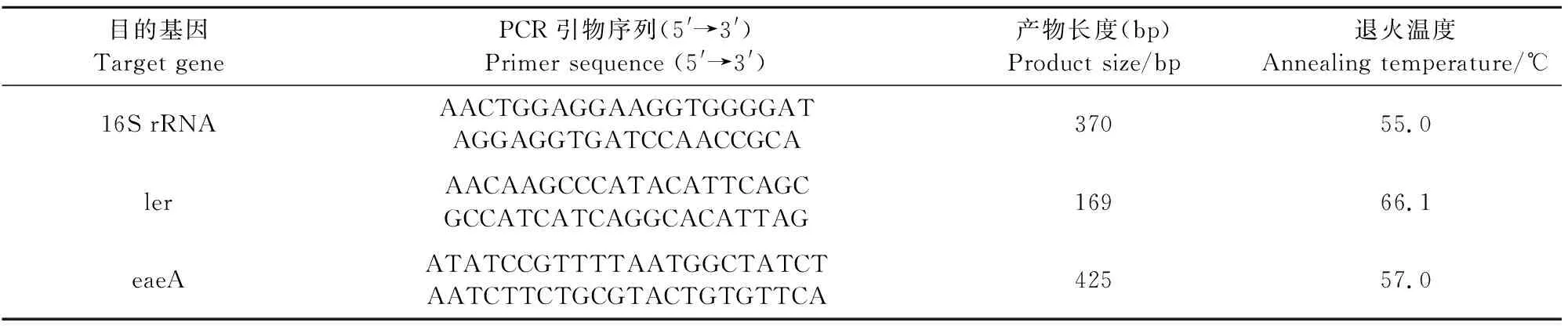
表1 16S rRNA和LEE基因检测引物序列及大小
2 结果
2.1 疑似菌的分离鉴定
共采集157份奶牛犊牛腹泻样本,分离得到62株疑似大肠埃希氏菌,革兰氏染色可见红色、两端钝圆的短杆菌。纯化培养后,VITEK 2 Compact进行生化鉴定,根据生化反应结果,初步确定均为大肠埃希氏菌。
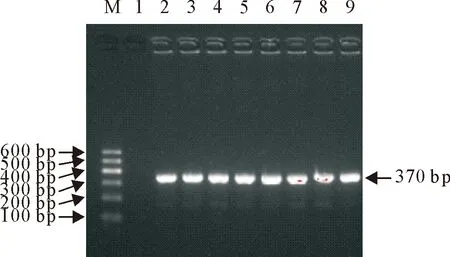
M.DNA标准DL 600; 1.阴性对照; 2~9.部分分离株16S rRNA PCR产物
2.2 大肠埃希氏菌的16S rRNA扩增
提取2.1鉴定为E.coli的基因组DNA,扩增16S rRNA基因,目的条带为370 bp(图2),部分阳性产物送测序,Blast比对确定为大肠埃希氏菌。

M.DNA标准DL 600;1.阴性对照;2~13.部分分离株eaeA基因PCR产物
2.3 药敏试验结果
62株分离株对阿米卡星较为敏感,耐药率为11.29%,对四环素耐药率为100%耐药,对阿莫西林、氟苯尼考、哌拉西林、氨苄西林、头孢唑啉、复方新诺明、恩诺沙星、头孢拉定、头孢氨苄的耐药率均大于90.00%,对头孢曲松的耐药率为87.10%,对链霉素、卡那霉素、诺氟沙星、庆大霉素、环丙沙星的耐药率大于70%,对红霉素、氧氟沙星的耐药率分别为69.35%和58.06% 。具体见表1,按照药物敏感程度依次排列。

表2 62株分离株药敏试验结果
2.4 LEE相关基因扩增结果
LEE毒力岛基因ler和eaeAPCR产物大小与预期相符,携带eaeA基因的检出率为11.29%(7/62),携带ler基因检出率为79.03%(49/62),共检出携带ler和eaeA两种基因大肠埃希氏菌2株,检出率为3.23%(2/62)。
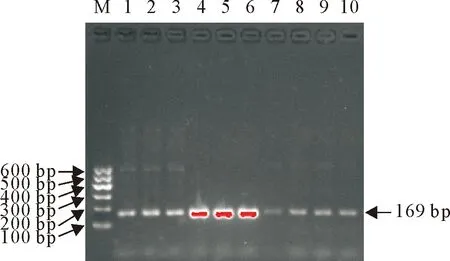
M.DNA标准DL 600;1~10.部分分离株ler基因PCR产物
3 讨论
大肠埃希氏菌病是由致病性大肠埃希氏菌引起的以新生和幼龄动物为主要感染者的肠道疾病,由某些血清型大肠埃希氏菌引起[15],在严重情况下可导致死亡[16]。临床上常见的动物性细菌疾病的病原菌多为大肠埃希氏菌,产肠毒素大肠埃希氏菌、肠致病性大肠埃希氏菌(EPEC)、肠出血性大肠埃希氏菌(ETEC)都是人兽共患的病原,牛是该病原的储存库[17],细菌毒力影响动物感染的严重程度和范围[18]。牛源大肠埃希氏菌及菌株耐药性可以通过食物链、接触传播等途径传染传递给人类,造成身体损害。毒力岛是成簇排列的毒力相关基因,是为20 kb~100 kb大小的染色体DNA片段,致病性大肠埃希氏菌中都存在毒力岛,可能是一个或多个。LEE可以在其编码的蛋白质的分泌作用下发生种与种之间的变异[19]。
3.1 大肠埃希氏菌耐药严重
宁夏地区牛源大肠埃希氏菌的耐药情况越来越严重,这与饲养管理、兽医治疗手段等密切相关。王理想等研究发现犊牛腹泻大肠埃希氏菌对对恩诺沙星、头孢噻吩不敏感,对庆大霉素、左氧氟沙星、卡那霉素高度敏感[20]。李慧等研究发现,石河子某牛场29 株犊牛腹泻大肠埃希氏菌对阿奇霉素最敏感,对头孢他啶、恩诺沙星、卡那霉素等的耐药率均大于58.62%,而对青霉素、链霉素等表现出耐药性[21]。韩和祥发现,肉牛场致犊牛腹泻的50株致病性大肠埃希氏菌对多黏菌素、强力霉素、磺胺间甲氧嘧啶耐药严重,对头孢克肟、头孢曲松、头孢他啶耐药率较低[22]。吴同垒等发现,秦皇岛地区的12株犊牛腹泻大肠埃希氏菌,对林可霉素100%耐药,对庆大霉素和阿米卡星的耐药率均为83.3%;对氧氟沙星和诺氟沙星最敏感[23]。本研究显示分离株对阿米卡星较为敏感,耐药率为11.29%,对四环素耐药率为100%耐药,对其他药物的耐药率均大于58.00%,大多数处于90%以上。大肠埃希氏菌对抗菌药物的耐药机制十分复杂[24],耐药基因和整合子介导的机制是其中两种[25]。耐药的大肠埃希氏菌引起的疾病给牧场防治带来压力,除了滥用、无序地使用抗生素外,养殖生产中还把抗菌药作为饲料添加剂来预防疾病,造成抗生素的残留和大肠埃希氏菌耐药性增强[26]。超广谱β-内酰胺酶/头孢菌素酶(ESBLs/Ampc )大肠埃希氏菌是动物传染病的潜在传染源[27],很多β-内酰胺酶的编码基因已经被发现[28],不同地区抗生素耐药性有一定差异。我区治疗相关疾病,可以首选阿米卡星。
3.2 LEE相关基因的检测
LEE引起的病变为黏附和脱落,编码的主要基因有eaeA、ler、espAB和SepA-I,LEE是外源基因,是为了适应环境进化而来的,它借助于插入序列、整合酶、转座子、质粒复制起始区等可移动性元件进入菌体[13],使菌体产生毒力。大肠埃希氏菌通过细菌外膜蛋白紧密黏附素等局灶性黏附于小肠上皮细胞表面,引起病变。在肠杆菌科细菌中,LEE毒力岛与致病性密切相关,常见于肠出血性大肠埃希氏菌和肠致病性大肠埃希氏菌[13,19]。本研究中的62株分离菌,eaeA基因的检出率为11.29%(7/62),ler基因检出率为79.03%(49/62),ler和eaeA两种基因共同检出率为3.23%(2/62),可能所检测的大肠埃希氏菌中一部分为非致病性大肠埃希氏菌,也可能携带其他毒力岛的相关基因,还需要进一步探索。LEE相关基因广泛存在于各市区各奶牛场,可能是某些奶牛场犊牛腹泻大肠埃希氏菌病的原因之一。宁夏地区人源LEE相关ler、eaeA基因的检出率均为1.80% (3/167) ,低于研究中的检出率,说明宁夏地区1~2月龄犊牛是LEE大肠埃希氏菌的潜在宿主。

