工业大麻叶对金黄色葡萄球菌的抑菌机制
张正海,董 艳,田 媛,姬妍茹,杨庆丽,石 杰
(黑龙江省科学院 大庆分院,黑龙江 大庆163319)
近年来,食品安全问题日益受到关注,已成为一个重要的公共卫生问题[1]。金黄色葡萄球菌(Staphylococcus aureus,S.aureus),是一类球形、直径约0.8μm、显微镜下呈葡萄串状排列的革兰氏阳性食源性病原体[2]。S.aureus易引起乳制品、肉类、蛋类、冰淇淋等食品腐败污染,导致人类食物中毒[3]。在许多国家,病原菌食物中毒事件中,S.aureus列居第二或第三位[4]。其引起食物中毒的主要特征是:发病迅速,通常伴有恶心、呕吐、腹痛和腹泻等症状,严重时会引发败血症、脑膜炎和中毒性毒素休克综合征等疾病,对于婴幼儿、老年人、术后患者或其他体质较虚弱的人来说,S.aureus感染具有更大的威胁[5]。当前,防止食品污染、延长保质期最简单有效的方法是使用天然或化学防腐剂[6]。盐、糖、醋和酒精是传统的防腐剂,但一些细菌和霉菌可以耐受这些传统的防腐剂。相比之下,人工合成的化学防腐剂,如苯甲酸/苯甲酸钠、山梨酸/山梨酸钾、硝酸盐等,可有效抑制细菌生长,然而长期摄入这些化学防腐剂可能造成毒性累积,引起过敏、头痛等症状,还可能产生细菌耐药性[7-8]。此外,一些化学防腐剂对食品感官品质也有一定影响。如今,植物源天然产物凭借不同抑菌机制发挥独特抑菌性能,其潜在功效和较少的副作用受到广泛关注[9]。
工业大麻(Hemp,Cannabis sativaL.)俗称火麻、汉麻,为大麻科、大麻属的一年生草本植物,是经遗传改良和人工选育的无毒新品种,其四氢大麻酚(Δ9-THC)的质量分数低于0.3%[10]。多项研究表明,大麻对人体健康有益,可预防便秘、降低胆固醇、调节免疫、抗衰老、改善记忆等[11-12]。我国大麻资源丰富,在云南、广西、黑龙江、吉林等地都有野生或人工栽培的大麻分布。近年来,医用大麻二酚在癌症治疗方面的作用日益被重视,全球工业大麻种植、生产也不断合法化,工业大麻产业链已从农业、纺织业延伸到新材料、食品、生物医药等多个行业,工业大麻的种植面积逐渐增大。随之产生了较多工业大麻叶副产物,但其利用程度有限。
多项研究证实工业大麻叶能有效抑制S.aureus生长。隽惠玲等[13]研究发现,工业大麻叶对S.aureus的最低抑菌浓度(MIC)为7.53 mg/mL;郭孟璧等[14]证实工业大麻雌株花叶多糖对S.aureus的MIC为3.125 mg/mL;张旭等[15]采用超临界CO2萃取工业大麻中的大麻二酚(CBD)、六氢大麻酚(CBN)和四氢大麻酚(Δ9-THC),这3种大麻酚的混合物对S.aureus的MIC为6 mg/mL;Giovanni等[16]研究了工业大麻叶中5种大麻素对多种耐甲氧西林金黄色葡萄球菌(MRSA)抑菌活性的影响,发现大麻素的异戊二烯基主要参与脂类亲和作用的调节,对抑菌作用影响较小,酚羟基的甲基化、乙酰化、前大麻素羧基的酯化以及第二个萜的引入都不利于抑菌活性,但其机制尚不明确。本课题组前期研究表明,来自大庆地区的工业大麻叶乙酸乙酯萃取物对S.aureus的MIC为7.81 mg/mL,且经紫外辐射、添加蔗糖和不同温度处理仍表现出良好的稳定性[17]。目前,工业大麻叶对S.aureus抑菌的研究大多围绕抑菌效果开展,而关于抑菌组成和抑菌机制的研究鲜有报道。本实验在前期研究基础上,对工业大麻叶萃取物进行硅胶柱分离,评价了按不同比例的石油醚与乙酸乙酯洗脱后,萃取物各馏分对S.aureus的抑菌活性,利用GC-MS确定高活性馏分的化合物组成,进一步分析工业大麻叶对S.aureus的作用机理。
1 材料与方法
1.1 材料与设备
工业大麻叶:经鉴定为火麻1号品种,于2019年7月中旬采自黑龙江省科学院大庆分院东风农场试验田;金黄色葡萄球菌标准菌株[ATCC 25923]:上海鲁微科技有限公司产品;硅胶粉:青岛海洋生物有限公司产品;氨苄青霉素钠:德国Ruibio公司产品;AKP试剂盒、可溶性蛋白质含量测定试剂盒、ATP含量试剂盒:南京建成生物工程研究所有限公司产品;SOD试剂盒:上海碧云天生物技术有限公司产品;戊二醛固定液:福州phygene生物科技公司产品;无水乙醇、石油醚、乙酸乙酯、叔丁醇(AR):均为辽宁泉瑞试剂有限公司产品。
7890B-7000c气相色谱质谱联用仪:安捷伦公司产品;Epoch多功能酶标仪:美国BioTek公司产品;UV-759紫外可见分光光度计:上海高致精密仪器有限公司产品;JSM7200F扫描电子显微镜:日本电子公司产品;DDS307电导率仪:上海红益仪器仪表有限公司产品;VFD-4500型冷冻干燥机:北京博医康实验仪器有限公司产品;RE-201D型旋转蒸发仪:上海互佳仪器设备有限公司。
1.2 试验方法
1.2.1 工业大麻叶提取物制备 根据张正海等[17]的方法,取1.5 kg阴干工业大麻叶,粉碎并过60目筛,以料液质量体积比为1 g∶15 mL的比例加入体积分数为88%的乙醇,超声辅助提取20 min,真空抽滤,重复3次,合并滤液,于40℃旋蒸至膏状(182 g)。乙酸乙酯萃取,减压浓缩后得浸膏57 g,用85.5 g硅胶(100~200目)拌样后干法上样,经200~300目硅胶柱分离,石油醚-乙酸乙酯梯度洗脱(体积比分别为1∶0,50∶1,20∶1,5∶1,1∶1,0∶1),根据薄层色谱(TLC)合并相似馏分,共得到Fr1—Fr6共6个馏分,旋蒸后调整质量浓度至10 mg/mL,经0.45μm微孔滤膜过滤除菌后,4℃保存,用于抑菌试验。
1.2.2 菌悬液制备 在无菌的条件下,将活化好的S.aureus单菌落接种于已灭菌的MH培养基,于37℃恒温培养16 h,室温4 000 r/min离心后收集菌体,用无菌生理盐水稀释菌悬液至单位体积的菌落数为106~107CFU/mL,现用现配。
1.2.3 最低抑制浓度(MIC)测定 参考Tang等[18]和Zhou等[19]的方法并适当修改,采用微量2倍稀释法,向96孔板中加入90μL/孔菌悬液和10μL/孔的工业大麻叶提取物,使其质量浓度分别为1 000、500、250、125、62.5、31.25、16、8μg/mL,并设空白对照(不含细菌)和阳性对照(含等质量浓度的氨苄青霉素钠),37℃恒温培养24 h,肉眼直接观察,不出现浑浊的最小质量浓度即为MIC。
1.2.4 GC-MS化学成分分析 利用Fr1—Fr6筛选S.aureus的活性后,取活性最佳的馏分并分析其组成。用甲醇稀释Fr5至质量浓度为1 mg/mL,经0.22μm微孔滤膜过滤后进行GC-MS。GC:HP-5MS(30 m×250μm,0.25μm),He气流量为:1.1 mL/min;升温程序为:100℃保持1 min,以10℃/min速率升温到280℃保持12 min;MS:四级杆温度:150℃,离子源(EI):70 eV,240℃,质量扫描范围:m/z 50.0~500.0。
1.2.5 生长曲线绘制 参考Liu等[20]的方法,按体积分数1%的接种量将S.aureus分别接种于含0 MIC、0.5 MIC、1 MIC的工业大麻叶提取物的培养基中,37℃、120 r/min振荡培养24 h,酶标仪每隔2 h测定OD600nm,绘制OD600nm-时间生长曲线。
1.2.6 菌悬液中AKP活力[21]、可溶性蛋白质质量浓度[22]、核酸相对浓度[23]和电导率的测定[24]分别向含有0 MIC、0.5 MIC、1 MIC的工业大麻叶提取物的培养基中加入菌悬液,使得菌悬液单位体积菌落数为106CFU/mL,于37℃,振荡培养,每隔2 h取5 mL菌液,4℃、4 000 r/min离心取上清液,按照各自试剂盒说明书的方法测定AKP活力和可溶性蛋白质质量浓度、紫外分光光度计测定260 nm波长下吸光值、去离子水稀释20倍后电导率仪测定各时间点电导率。
1.2.7 胞内ATP浓度[25]、SOD活性[26]测定 分别于0、2、4、6、8、10 h取1 mL菌液,4℃、4 000 r/min离心后,弃上清液,按各自试剂盒说明书方法测定菌体ATP浓度和SOD活性。
1.2.8 扫描电子显微镜(SEM)观察及样品制备 按Zhou等[27]的方法并稍加改动,将对数生长期S.aureus菌悬液单位体积的菌落数调整为107CFU/mL,加入工业大麻叶提取液使质量浓度分别为0 MIC、1 MIC,于37℃,120 r/min振荡培养10 h。取800μL菌体于室温下、4 000 r/min离心后弃上清液,用0.1 mol/mL、pH 7.2的磷酸盐缓冲液洗涤3次,离心收集菌体后用体积分数为2.5%的戊二醛溶液固定过夜。依次用体积分数为30.0%、50.0%、70.0%、80.0%、90.0%、100.0%的乙醇梯度脱水,叔丁醇置换。取细菌-叔丁醇悬浮液10μL滴于10 mm×10 mm硅片上,用真空冷冻干燥机干燥,喷金后SEM观察。
1.2.9 数据处理 试验重复3次,结果采用DPS 7.05软件对数据进行Duncan多重比较分析,GraphPad Prism 7软件绘图。
2 结果与分析
2.1 工业大麻叶不同馏分对S.aureus的抑菌活性
表1显示了不同馏分对S.aureus的最低抑制浓度(质量浓度)。在供试范围内Fr1—Fr4对S.aureus无抑菌作用,说明Fr1—Fr4馏分内可能不含或含有很少量的活性化合物。Fr5和Fr6对S.aureus的生长有明显的抑制作用,最低抑菌浓度(质量浓度)分别为31.25μg/mL和500μg/mL,其中Fr5的抑菌效果与氨苄青霉素钠的31.25μg/mL相当,此结果与Chakraborty等[28]的研究结果接近,较柱分离前最低抑菌浓度(质量浓度7.53 mg/mL)显著提高,说明抑菌活性成分大部分富集于Fr5馏分,以此为依据,选择Fr5分析其化学组成并探讨其抑菌机理。
2.2 工业大麻叶Fr5馏分的GC-MS结果
由表2可知,工业大麻叶Fr5馏分,经GC-MS分析,共鉴定出24种化合物,其中包括酯类14个,醇类3个,酚类3个,烯烃类2个。主要成分为亚麻酸甲酯(相对质量分数40.79%)、棕榈酸甲酯(相对质量分数13.12%)、9-顺,11-反-癸二烯酸甲酯(相对质量分数4.55%)。说明工业大麻叶Fr5馏分的抗菌活性可能与酯类、醇类、酚类及其他微量化合物有关,不同成分也可能产生协同效应。

表1 工业大麻叶不同馏分对S.aureus的抑菌活性Table 1 Antibacterial activity of each fraction from industrial hemp leaves against S.aureus

表2 工业大麻叶Fr5馏分GC-MS结果Table 2 GC-MSidentification of Fr5 fractions from industrial hemp leaves
2.3 工业大麻叶提取物的抑菌机理
2.3.1 工业大麻叶Fr5馏分对S.aureus生长曲线的影响 OD600nm的大小可间接反应细菌的生长情况,图1为添加了0 MIC、0.5 MIC、1 MIC 3种质量浓度的Fr5后S.aureus的生长曲线。对照组在培养后快速繁殖,2 h进入对数生长期,14 h进入稳定期,OD600nm为1.156±0.029。在0.5 MIC处理组,菌液OD600nm增长缓慢,对数增长阶段被推迟至6 h,并于12 h进入稳定阶段,OD600nm为0.427±0.023,说明抑菌作用延缓对数生长进程,减少微生物数量。而当菌液中Fr5质量浓度为1 MIC时,曲线平缓,细菌生长被严重抑制,不能进入对数生长期。因此,工业大麻叶Fr5馏分对S.aureus正常生长有抑制作用,且随着药物质量浓度增加,对生长曲线影响增大。
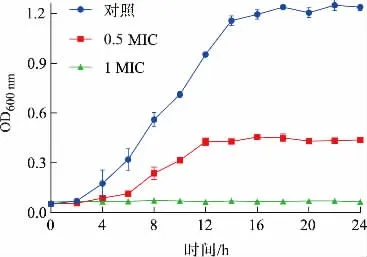
图1 工业大麻叶Fr5馏分对S.aureus生长曲线的影响Fig.1 Effect of Fr5 from industrial hemp leaves extract on growth curve of S.aureus
2.3.2 工业大麻叶Fr5馏分对菌体细胞壁的影响正常情况下AKP存在于细菌的细胞壁和细胞膜之间,当菌体细胞壁被破坏,AKP大量外泄,使培养液中AKP活力升高,因此可通过检测胞外AKP活力的变化间接反映菌体细胞壁完整性[29]。细菌细胞壁的主要功能是:维持细菌固有形态,保护细菌免受低渗环境侵袭,起到屏障作用。一旦细胞壁功能被破坏,细菌会很快死亡。如图2所示,随着培养时间的增加,对照组AKP活力始终处于相对较低水平,但经过1 MIC处理后的菌液,在2 h内AKP活力迅速上升至较高水平(0.548±0.039 U/L),之后趋于平稳状态,而0.5 MIC处理的AKP活力在8 h达到最大值(0.335±0.020 U/L)远低于1 MIC处理。这表明工业大麻叶Fr5馏分短时间内能有效破坏S.aureus细胞壁的完整性,其中1 MIC的Fr5对菌体细胞壁完整性的破坏程度较0.5 MIC更明显。
2.3.3 工业大麻叶Fr5馏分对细胞膜通透性的影响细胞膜是菌体的保护屏障,其选择性透过K+、Na+、H+等,可维持适合细菌生存的稳定内环境、胞膜功能、酶活性和菌体正常代谢[30]。当细胞膜遭到破坏,通透性增加,内部的电解质会外泄至细胞外,进而使培养液电导率提高,因此菌液电导率的变化反映了细胞膜通透性的变化[25]。如图3所示,第0小时,添加抑菌物质的菌液电导率有一定程度的下降,可能是药物与外泄的离子发生了静电结合,从而导致离子浓度降低,电导率下降。随着培养时间的增加,对照组电导率呈现稳定上升的趋势,但变化幅度较小,这可能是菌液中菌体浓度增加和正常的裂解所致[31]。当加入工业大麻叶Fr5后,在短时间内菌液电导率明显高于对照组(P<0.05),尤其是1 MIC工业大麻叶提取物作用后2 h,培养液电导率提高12%。这说明工业大麻叶Fr5可对S.aureus细胞膜造成损伤,且损伤程度与Fr5的浓度呈正相关关系。
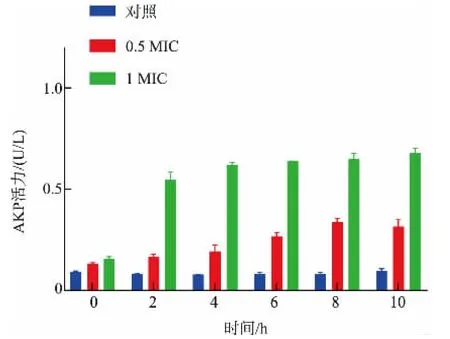
图2 工业大麻叶Fr5馏分对S.aureus细胞壁的影响Fig.2 Fr5 from industrial hemp leaves on wall of S.aureus

图3 工业大麻叶Fr5馏分对培养液电导率的影响Fig.3 Effect of Fr5 from industrial hemp leaves extract on electric conductivity of culture medium
蛋白质和核酸是影响细胞结构和遗传信息的重要大分子,菌体细胞正常生长情况下,蛋白质、核酸等大分子物质贯穿于整个胞膜和胞质当中,核酸、蛋白质等大分子物质的外溢表明胞膜完整性遭到了破坏[32]。菌悬液在260 nm处的吸光度常用来判断核酸的相对浓度[33]。如图4所示,0 h时,各组间核酸的吸光度和可溶性蛋白质的质量浓度均无明显区别。随时间增加,对照组核酸的吸光度和可溶性蛋白质的质量浓度处于较低范围且变化均较为平缓,而经0.5 MIC和1 MIC的Fr5处理后,培养液中核酸的吸光度和可溶性蛋白质的质量浓度在2 h迅速升高,与0 h相比:核酸的吸光度分别增加了0.183、0.407,可溶性蛋白质的质量浓度分别增加了0.129 g/L、0.187 g/L。0 h后,两个处理组的核酸吸光度和可溶性蛋白质质量浓度均始终高于对照组(P<0.05)。对照组蛋白质质量浓度有少量增加是因为:随菌落数大幅增加,出现部分自然死亡细胞,释放一定量蛋白质。加入抑菌物质后,S.aureus细胞膜遭破坏,DNA、RNA等大分子随小分子相继流出细胞,从而增加菌悬液核酸和蛋白质的浓度。这说明工业大麻叶提取物可导致菌体的膜功能障碍,细胞内容物泄露,无法维持内环境稳态,从而达到抑菌作用。
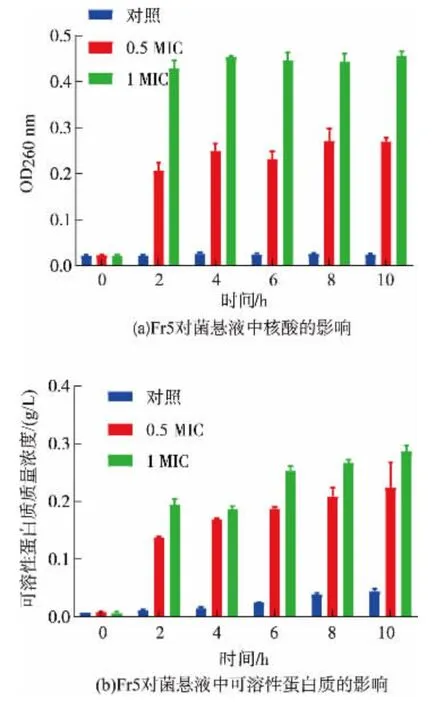
图4 工业大麻叶Fr5馏分对S.aureus核酸吸光度和可溶性蛋白质质量浓度的影响Fig.4 Effect of Fr5 from industrial hemp leaves extract on the nucleic acid absorbance and the soluble protein content of S.aureus
2.3.4 工业大麻叶Fr5馏分对菌体能量代谢的影响ATP在细胞物质运输、能量转换中发挥重要作用,其浓度的变化直接关系到细胞的能量代谢。图5反映了经过不同浓度的Fr5处理后,S.aureus胞内ATP浓度的变化:对照组样品细胞内ATP浓度随时间增加呈上升趋势,而经0.5 MIC和1 MIC Fr5处理后,细胞内ATP浓度在2 h显著升高(P<0.05),随后降低,在10 h降低至26.175±3.336μmol/L和16.154±2.672μmol/L,较0 h分别降低了51.96%和70.35%。可能是抑菌物质刺激了菌体,细胞为了维持正常生理功能出现应激,ATP浓度在2 h内迅速上升。在4~10 h,因电解质损失,细菌细胞质子动力降低,影响还原氢利用,ATP合成受抑制。另外,细胞内ATP浓度降低也可能因为:细胞过度凋亡造成ATP合成速率降低和ATP的水解速率增加[34]。其他抗菌药物,如柠檬烯等也有类似现象[24]。因此,工业大麻叶提取物会影响S.aureus的ATP合成或消耗,结合膜通透性变化,造成胞内ATP浓度下降,从而抑制菌体代谢。
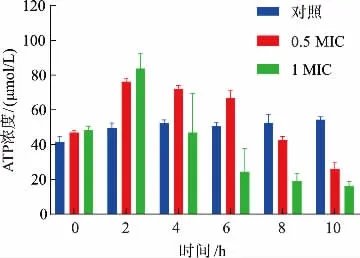
图5 工业大麻叶Fr5馏分对S.aureus ATP浓度的影响Fig.5 Effect of Fr5 from industrial hemp leaves extract on the ATP content of S.aureus
2.3.5 工业大麻叶Fr5馏分对菌体氧化损伤的影响菌体自由基能攻击生物膜并引起细胞损伤,形成丙二醛等过氧化物。SOD是细胞中重要的保护酶,SOD特异性催化超氧阴离子,将其转化为过氧化氢,CAT进一步催化过氧化氢分解为水,它们协调工作,维持细胞内活性氧的代谢平衡。由图6可知,对照组SOD活力相对稳定且维持在较低水平,说明细胞膜未受到损伤。不同浓度工业大麻叶Fr5处理后的S.aureus胞内SOD活力均呈先升高后降低的趋势,实验结束时0 MIC、0.5 MIC、1 MIC细胞内SOD活力分别为0.203±0.014、0.180±0.023、0.132±0.011 U,推测菌体在提取物的逆境胁迫下,前期SOD增加,清除有害物质从而保护菌体免受毒害,但后期由于氧自由基的累积、膜脂过氧化的加重和蛋白质变性导致保护酶水平的降低,使菌体自身防御能力下降。故推测:Fr5以剂量依赖的方式造成S.aureus的氧化损伤。
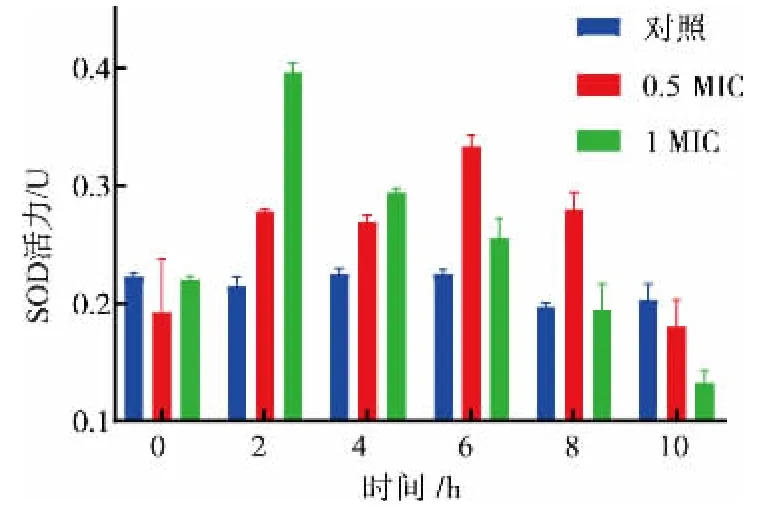
图6 工业大麻叶Fr5馏分对S.aureus SOD活性的影响Fig.6 Effect of Fr5 from hemp leaves extract on the SOD activity of S.aureus
2.3.6 工业大麻叶Fr5馏分对细胞显微特征的影响用0 MIC和1 MIC浓度的Fr5分别处理细菌,扫描电镜观察S.aureus的形态结构特征变化。结果如图7所示,对照组大部分S.aureus细胞呈球形,表面规则、光滑、外观饱满且结构完整;然而,经工业大麻叶1 MIC提取物处理10 h后,菌体表面出现皱缩,可见明显破溃的菌体。这与细胞壁完整性、细胞膜通透性研究结果一致。细菌被抑制的原因可能是细胞膜被破坏,即使是膜结构微小的变化也能极大影响细胞代谢并导致细胞死亡,其他研究也有类似结论[31,35]。以上结果再次证明:工业大麻叶Fr5馏分可以使S.aureus膜结构造成破坏。

图7 工业大麻叶提取物处理后S.aureus的扫描电镜图(50μm)Fig.7 SEM images of S.aureus with or without Fr5 from hemp leaves extract treatment
3 结 语
为了应对过度使用化学防腐剂造成的健康风险和细菌耐药性问题,本研究探索了工业大麻叶对S.aureus的抑菌组成并对其机理进行探索,证实了工业大麻叶Fr5馏分(V石油醚∶V乙酸乙酯=1∶1)可有效抑制S.aureus的生长,MIC值为31.25μg/mL。经GCMS分析,共鉴定出24种化合物。由胞外AKP活力的升高、电导率的增加和细胞内生物大分子(核酸和蛋白质)的渗漏以及扫描电镜下菌体的微观机构变化,推测:工业大麻叶可能与阳性对照氨苄青霉素钠有相似的抑菌机制,均能破坏细菌细胞壁和细胞膜完整性。在食品加工过程中,控制微生物生长的主要目标是对细菌细胞膜的灭活处理[35]。细菌细胞膜可保护细胞免受周围环境伤害,并负责运输细胞生长和代谢所必需的营养物质。当细胞膜受损时,细菌的生长和代谢就会被破坏[36]。工业大麻叶Fr5作用于S.aureus后,可能是其中的化合物通过脂质双分子层疏水羟基的积累,作用于细胞膜或导致细胞外膜脂多糖释放,从而造成膜通透性和膜电位变化[37]。维持正常膜电位是产生ATP维持细胞功能的前提[20]。由于细胞膜的通透性增加,细胞生长繁殖所需的能量和关键物质无法及时合成,影响菌体的能量代谢并造成氧化损伤,最终导致细胞生长受到抑制。这些结果为工业大麻叶在食品保鲜方面的综合利用和新型天然防腐剂的开发提供了理论基础,但抑菌物质仍需进一步分离、鉴定,并需要在分子水平上深入研究作用机制,寻找其具体靶点。

