甘草酸对高糖诱导的小鼠肾小球系膜细胞T G F-β1/S m ads信号通路的影响
冉 喆,王玉军,王 珍,赵天琪,侯绍章
(宁夏医科大学基础医学院病理学系,银川 750004)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的微血管并发症之一,国际糖尿病联盟组织近日调查显示,在我国有20%~40%的糖尿病患者并发DN[1]。与系膜细胞增殖相关的细胞外基质(extracelluar matrix,ECM)积聚是DN的主要病理变化之一,在DN病变初期,活化的肾小球系膜细胞即发生增殖,并分泌大量细胞因子影响ECM合成、分解平衡,逐渐引起ECM大量沉积,导致肾小球硬化、肾纤维化的形成[2-3]。因此,对肾小球系膜细胞功能的监测在糖尿病肾病的早期诊断和治疗中具有重要意义。在众多影响肾纤维化的信号通路中,转化因子-β1(transforming growth factor-β1,TGF-β1)/Smads信号通路是诱导肾纤维化进程中最重要的信号通路[4],高糖刺激可以导致肾小球系膜细胞TGF-β1表达增加,引起下游受体调节Smads(R-Smads)的激活,进而增加ECM相关蛋白的表达,并抑制ECM的降解,导致肾脏纤维化[5]。因此,通过阻断TGF-β1-Smads信号通路可以有效预防DN的进展。近年来,甘草酸(glycyrrhizic acid,GA)在抗肾纤维化及DN保护领域取得了长足进展,得到了广大学者的认可。Hou等[6]研究发现,在糖尿病大鼠模型中,GA可以通过抑制氧化应激对DN起防治作用。GA也可以通过提高Mn-SOD的表达减缓高糖诱导的肾小管上皮细胞损伤[7]。然而,GA对于高糖诱导的肾小球系膜细胞的影响及其作用机制尚未明确。因此,本实验通过高糖诱导的肾小球系膜细胞模拟体内环境,观察GA对TGF-β1-Smads信号通路蛋白表达的影响,以探讨GA对DN肾脏保护作用机制,为GA在商业领域的应用和推广提供理论依据。
1 材料与方法
1.1 实验材料与仪器
MCs SV40 MES13细胞购自武汉普罗塞尔公司(中国),胰蛋白酶EDTA(钙二钠)、胎牛血清(FBS)购自Hyclone实验室公司(美国),D-葡萄糖粉末购自Sigma(美国),BCA蛋白测定试剂盒购自上海碧云天生物工程研究所(中国)。6 cm皿、24孔细胞培养器、96孔细胞培养器和吸管均购自NEST GROUP公司(中国),GA购自北京索莱宝公司(中国),CCK-8试剂盒购自同仁化学研究所(日本)。抗TGF-β1来自Abcam公司(美国),抗P-Smad3、P-Smad2、COLⅠ、COLⅣ购自Affinity Biosciences(中国)。ELISA试剂盒购自上海江莱生物科技有限公司(中国)。分光光度仪购自BioTek(美国),聚偏氟乙烯膜(PVDF)购自Millipore公司(美国),BSA购自中山金桥(中国),FITC(异硫氰酸荧光素)-共轭二级抗体购自Abbkine(中国)。凝胶成像系统购自Bio-RAD公司(美国)。奥林巴斯FV1000激光扫描共焦显微镜购自奥林巴斯(美国)。
1.2 细胞培养及实验分组
将MCs SV40 MES13细胞放在DMEM(Dulbecco改良的Eagle培养基)中培养,并添加10%胎牛血清、100 U·mL-1青霉素和100μg·mL-1链霉素(37℃、5%CO2)孵育17 h。然后将细胞分为低糖对照(NG)组(5.6 mmol·L-1葡萄糖)、高糖(HG)组(30 mmol·L-1葡萄糖)和高糖GA(HG+GA)组(30 mmol·L-1葡萄糖+200μmol·L-1GA),分别培养48 h。
1.3 CCK-8法检测细胞活性
将细胞密度调整为5×104个/mL后接种于96孔板中,每孔100μL。在37℃温箱培育17 h待细胞状态稳定后,进行分组干预48 h。每孔分别加入10μL CCK-8,在37℃温箱避光孵育2 h后使用分光光度仪在495 nm处测量光密度(OD)值。
1.4 HE染色观察细胞形态
将1.5×104个细胞接种在玻璃片上,在37℃温箱中培育17 h,待细胞状态稳定后,进行分组干预48 h。干预结束后,将各组细胞依次用75%乙醇固定、苏木精-伊红染色,再采用光学显微镜来观察细胞密度和基本形态。
1.5 Western blot检测细胞中TGF-β1、P-Smad3、P-Smad2、COLⅠ、COLⅣ的表达
干预48 h后,用冷磷酸盐缓冲液洗涤细胞3次,冰上裂解提取全蛋白。BCA法检测蛋白浓度,然后将蛋白重新分装。将蛋白质提取物从十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)转移到聚偏氟乙烯膜(PVDF)上,然后进行一抗孵育,抗TGF-β1(1∶500)、抗P-Smad3(1∶1000)、抗P-Smad2(1∶1000)、抗-COLⅠ、COLⅣ、抗GADPH(1∶5000)4℃过夜,次日,二抗常温孵育,在暗视野中使用ECL发光液,采用凝胶成像系统对信号进行定量,从而测定TGF-β1、P-Smad3、P-Smad2、COLⅠ、COLⅣ蛋白的相对表达量。
1.6 细胞免疫荧光检测P-Smad3、COLⅠ、COLⅣ的表达
将细胞在玻璃盖上培养,待细胞状态稳定后进行分组处理48 h。48 h后采用4.0%多聚甲醛进行细胞固定。用PBS洗涤3次,0.1%TritonX-100处理20 min,在室温下用10%BSA封闭1 h,在4℃下与抗P-Smad3(1∶400)、抗COLⅠ、COLⅣ孵育过夜。次日,在常温下与FITC(异硫氰酸荧光素)-共轭二级抗体(1∶250)常温避光孵育。DAPI封片,并在400倍镜下随机选取5个视野采图。用Image J软件测定相对荧光强度,并取平均值。实验重复3次后进行了统计分析。用激光扫描共焦显微镜对细胞内P-Smad3、COLⅠ、COLⅣ蛋白表达位置以及荧光强度进行观察。
1.7 ELISA法检测细胞上清液中COLⅠ、COLⅣ的分泌情况
将细胞以1×105个/孔的密度接种于6孔板中,待17 h细胞状态稳定后,分组干预细胞48 h。48 h后收集各组细胞的上清液,在4℃下以1500×g离心20 min并按ELISA试剂盒说明书进行实验,在450 nm波长处测定各孔的光密度(OD)值。
1.8 统计学方法
数据使用SPSS 17.0统计软件进行分析,计量资料以均数±标准差(±s)表示,多组间比较应用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 GA对高糖诱导的MCs细胞活性的影响
本实验采用CCK-8法检测各组细胞的活性,与NG组(0.850±0.036)比较,HG组(1.47±0.130)细胞活性升高(P<0.01);与HG组比较,HG+GA组(0.966±0.086)细胞活性降低(P<0.05)。
2.2 GA对高糖诱导的MCs细胞形态的影响
HE染色结果显示,NG组MCs呈现梭形,膜完整性良好,细胞核形态规则。HG组细胞密度明显增大,部分细胞体积显著增加,细胞呈现长梭形,出现纤维化趋势,表现出损伤特征。与HG组相比HG+GA组细胞形态有一定程度的改善,见图1。

图1 光学显微镜下观察甘草酸对高糖作用下MCs形态学影响(HE×400)
2.3 GA对高糖诱导的MCs上清液中COLⅠ、COLⅣ分泌的影响
采用ELISA法检测各组细胞COLⅠ、COLⅣ分泌情况。如表1所示,与NG组相比,HG组细胞分泌COLⅠ、COLⅣ表达均增高(P均<0.01)。与HG组相比,HG+GA组细胞分泌COLⅠ、COLⅣ含量均下降(P均<0.05)。
表1 GA对高糖诱导的肾小球系膜细胞ECM分泌的影响(n=3,±s,ng·mL-1)

表1 GA对高糖诱导的肾小球系膜细胞ECM分泌的影响(n=3,±s,ng·mL-1)
与NG组相比##P<0.01;与HG组相比**P<0.01。
?
2.4 GA对高糖诱导的MCs内TGF-β1、P-Smad2、P-Smad3、COLⅠ、COLⅣ蛋白表达的影响
采用Western blot法对各组细胞TGF-β1、P-Smad2、P-Smad3、COLⅠ、COLⅣ的表达含量进行检测。与NG组相比,HG组COLⅠ、COLⅣ表达均升高(P均<0.01)。与HG组相比,HG+GA组COLⅠ、COLⅣ表达量均降低(P均<0.01)。与NG组相比,HG组TGF-β1表达水平升高(P<0.01),与HG组相比,HG+GA组TGF-β1表达水平降低(P<0.05)。与NG组相比,HG组P-Smad2、PSmad3水平均升高(P均<0.05)。与HG组相比,HG+GA组P-Smad2、P-Smad3水平均降低(P均<0.05),见图2。
2.5 GA对高糖诱导的MCs细胞P-Smad3、COLⅠ、COLⅣ荧光强度的影响
与NG组相比,HG组细胞核内P-Smad3表达增高,荧光强度增强(P<0.01),出现了明显的核转位现象。与HG组相比,HG+GA组细胞核内P-Smad3表达降低(P<0.01),荧光强度减弱。COLⅠ、COLⅣ主要表达于细胞质中,与NG组相比,HG组细胞内COLⅠ、COLⅣ荧光强度均增高(P均<0.01);与HG组相比,HG+GA组COLⅠ、COLⅣ荧光强度均减弱,即COLⅠ、COLⅣ蛋白表达量下降(P均<0.05),见图3,与Western blot、ELISA检测结果一致。
3 讨论
目前对DN以降血糖药物与血管紧张素转换酶抑制剂为主要治疗方案,但该疗法成本高,副作用大,疗程长[8]。所以探讨DN的发病机制,寻找有效的天然早期抗糖尿病药物已成为当下对于DN治疗研究的重点。GA是三萜皂苷,是豆科灌木甘草(glycyrhiza glabra)植物根提取物的主要生物活性成分[9]。课题组前期研究发现[10],GA可以有效延缓DN的进展,但其具体机制还有待于进一步研究。本研究发现GA可以有效抑制高糖诱导的系膜细胞的活性。组织病理学观察,相比于正常组,高糖培养的肾小球系膜细胞出现排列紊乱,细胞形态偏细长,胞浆和细胞核变暗以及细胞密度增大等现象,而在GA干预后高糖诱导的细胞在形态上得到了有效的改善,表明GA可以对高糖诱导的系膜细胞起到保护作用。Western blot和ELISA方法检测结果显示,GA可有效抑制高糖诱导的肾小球系膜细胞纤维化因子的表达,证实GA对高糖诱导的肾小球系膜细胞纤维化有明显的抑制作用。
TGF-β1-Smads信号通路与多种纤维化疾病的发生及发展息息相关[11],而且在DN的各个恶化进程中也起到关键性作用[12]。以往的研究发现,在DN患者的肾脏中TGF-β1因子的表达量增多,从而促进系膜基质外基质的合成并抑制其降解,导致肾小球的纤维化[13]。研究表明[14],Smads蛋白是TGF-β1的直接下游因子,介导TGF-β1诱导的纤维化过程。TGF-β1通过与其受体的结合会导致Smad2和Smad3蛋白的磷酸化,该磷酸化后的蛋白会与Smad4结合形成低聚复合物,然后进入细胞核发挥转录作用,激活ECM的启动因子[15]。因此,抑制TGF-β1因子以及P-Smad2和P-Smad3蛋白的表达量对调节ECM的表达有重要意义。本研究结果发现,GA高糖共培养组的肾小球系膜细胞TGF-β1和P-Smad2、3表达较高糖组降低,提示GA抑制高糖诱导的肾小球系膜细胞ECM的产生,延缓DN肾纤维化进程的作用机制可能与调控TGF-β1-Smads信号通路密切相关。
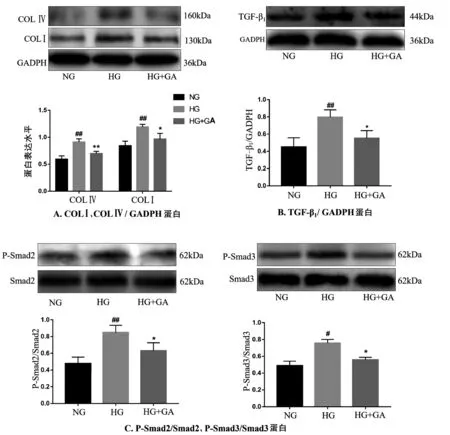
图2 Western blot检测MCs细胞TGF-β1、P-Smad2、P-Smad3、COLⅠ、COLⅣ蛋白的表达情况
综上,GA抑制高糖诱导的肾小球系膜ECM的合成与TGF-β1-Smads信号通路有关,本实验结果可以为GA药物在DN治疗领域的应用提供技术支持,但其具体的作用机制还有待于进一步的研究。
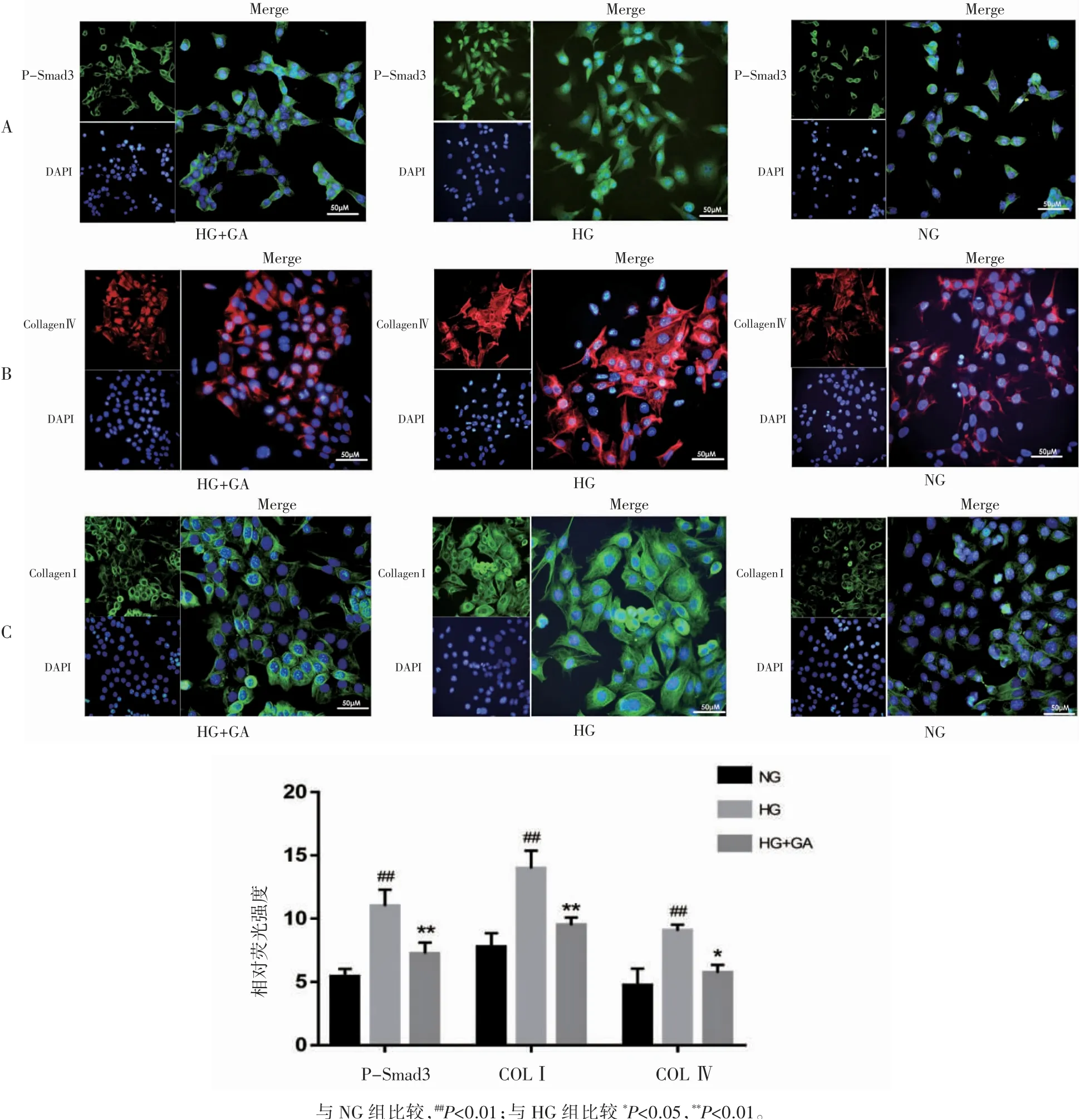
图3 免疫荧光检测MCs中P-Smad3、COLⅠ、COLⅣ表达情况

