枸杞多糖对四氯化碳致急性肝损伤小鼠的保护作用
伍智慧,冉喆,张睛睛,王玉军,侯绍章
(1.宁夏医科大学基础医学院病理学系,银川 750004;2.宁夏糖尿病及其并发症基础和临床研究创新团队,银川 750004)
肝脏是人体合成代谢的重要器官,在调节消化排泄、营养物质储存、代谢平衡、解毒等生理功能方面发挥着重要作用。由于个体差异性和基础状况的复杂性,人们在进行各种药物对症治疗的同时,各种药物所引起的不良反应未能引起重视,结果导致各脏器功能障碍也随之逐渐出现[1-3]。药物本身和(或)代谢产物引起的肝脏损害,是临床上多见且严重的药物不良反应,因此采取有效措施预防和治疗肝损害已成为亟待解决的问题。研究显示,肝脏疾病治疗过程中多糖类化合物对其具有一定的保护作用[4-6]。枸杞多糖(lycium barbarum polysaccharides,LBP)是枸杞子的主要有效成分,由阿拉伯多糖、葡萄糖、半乳糖、甘露糖、木糖、鼠李糖共同组成的一类大分子水溶性多糖,研究显示其具有抗炎、抗病毒、抗氧化、抗肿瘤、调节免疫力等多种生理作用[7]。Keich样环氧氯丙烷相关蛋白(Keich-like ECH-associated protein 1,Keap1)/核因子E2相关蛋白(necular factor erythroid 2-related factor,Nrf2)在维持细胞氧化应激状态中扮演着重要角色[8]。胃癌组织中Keap1、IKKβ表达异常,提示Keap1可能通过IKKβ对NF-kB信号通路的影响在胃癌的发生、发展、浸润、转移过程中具有一定作用[9]。IKKβ/NF-kB信号通路被称之为经典的炎性反应信号通路,参与各类疾病的炎症反应,但Keap1和IKKβ/NF-kB两者在急性肝损伤的发生发展过程中是否存在关联目前未见报道。因此本研究采用四氯化碳(CCl4)一次性腹腔注射诱导小鼠急性肝损伤,治疗组给予不同剂量的枸杞多糖溶液进行干预,探讨枸杞多糖对急性肝损伤是否具有保护作用,其保护作用是否与Keap1/IKKβ/NF-kB抗炎信号通路有关,以便为急性肝损伤的治疗方案中药物的使用提供一定的理论基础和依据。
1 材料与方法
1.1 材料
LBP(纯度90%,宁夏启元药业有限公司),由宁夏医科大学李光华老师课题组惠赠。CCl4(纯度≥99.0%,上海麦克林生物科技有限公司)。AST、ALT、TNF-α、IL-1β和IL-6检测试剂盒(上海江莱实业股份有限公司)。兔抗Keap1、IKKβ和NF-kB单克隆抗体(Cell Signaling Technology公司),鼠抗GAPDH单抗(Abways Technology公司),BCA蛋白含量检测试剂盒和SDSPAGE凝胶试剂盒(南京凯基生物技术公司)。实时荧光定量PCR(qRT-PCR)试剂(Takara)(武汉塞维尔有限科技公司),引物由上海生工生物工程股份有限公司合成。PVDF膜(0.45μm)(Thermo Fisher Scientific公司)。酶标仪(美国Thermo Electron公司),低温高速离心机(美国Thermo Electron公司),化学发光成像分析仪(美国GE公司),显微镜(日本OLYMPUS公司),石蜡切片机(美国Thermo Electron公司),垂直电泳仪,转印仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 小鼠急性肝损伤模型制备 ICR小鼠40只,体质量28~32 g,由宁夏医科大学实验动物中心提供[SCXK(宁)2015-0001]。所有小鼠饲养于温度(22±2)℃、相对湿度(55±15)%的清洁级动物实验中心,每日光照-黑暗周期12 h∶12 h。实验前所有小鼠在动物实验中心饲养1周,以适应实验环境。适应性饲养1周后随机分为5组,每组8只:正常对照组、模型组、LBP低剂量组(100 mg·kg-1)、LBP中剂量组(200 mg·kg-1)和LBP高剂量组(400 mg·kg-1)。LBP用生理盐水溶解为对应药物浓度,各组小鼠灌胃给药0.5 mL各对应浓度的LBP溶液,正常对照组和模型组灌胃等剂量生理盐水0.5 mL,每天1次,持续7 d。末次给药后1 h,除正常对照组小鼠腹腔注射等剂量花生油外,其余各组小鼠一次性腹腔注射CCl4食用花生油溶液(浓度为0.1%,10 mg·kg-1)诱导小鼠急性肝损伤。造模16 h时所有小鼠禁饮禁食,24 h时先摘取眼球采血制备血清,然后颈椎脱臼致死后取肝脏组织,用磷酸盐缓冲液(PBS)冲洗2次,称重后一半作常规固定包埋,制成蜡块备用,另一半-80℃保存备用。
1.2.2 小鼠肝脏指数变化 造模后24 h眼球取血,取血前称取小鼠体质量,取血后小鼠颈椎脱臼致死取肝脏并称重以计算肝脏指数。肝脏指数=肝脏重量(g)/小鼠体质量(g)×100%。
1.2.3 小鼠肝组织病理学观察 取各组小鼠相同部位肝脏组织,置于4%多聚甲醛浸泡固定24 h,脱水透明,石蜡包埋,切片。苏木素-伊红(HE)染色,200倍光镜下观察肝脏组织病理学变化。
1.2.4 小鼠血清肝功能指标及炎症因子检测 眼球取血室温凝固1~2 h,4℃冰箱过夜,待自然血清析出后,低温高速(4℃,15000 r·min-1)离心10 min,分离至备用干净离心管中。按照ELISA检测试剂盒说明书在室温下操作,检测肝功能指标谷丙转氨酶(ALT)、谷草转氨酶(AST)及炎性指标肿瘤坏死因子-α(TNF-α)、白细胞介素1β(IL-1β)和白细胞介素6(IL-6)表达水平。
1.2.5 qRT-PCR法检测小鼠肝组织Keap1、IKKβ、NF-kB的mRNA表达 取100 mg肝脏组织加入匀浆管中,严格按照试剂盒说明采用Trizol方法从肝脏组织中提取Keap1、IKKβ、NF-kB全RNA经反转录合成cDNA。以GAPDH为内参,引物序列见表1。PCR反应条件:94℃10 min,94℃30 s,56℃40 s,72℃40 s,循环40次,收集数据进行熔解曲线分析。反应结束后以2-ΔΔCT方法计算目的基因相对内参GAPDH的相对表达水平,重复该实验3次。
1.2.6 Western blot检测小鼠肝组织Keap1、IKKβ、NF-kB蛋白的表达 从-80℃冰箱取出冻存肝脏组织,取各组小鼠相同部位组织约100 mg,剪成小块,加入蛋白裂解液1 mL,冰上混匀研磨10 min/次,重复3次。裂解后组织匀浆低温高速(4℃,15000 r·min-1)离心10 min,取上清于备用干净离心管置于-80℃冰箱保存备用。采用BCA蛋白定量法定量蛋白并分装(40μg·μL-1),100℃使蛋白变性,保存-80℃冰箱。配制10%分离胶,灌入分离胶至2/3位置处,用水封胶,室温静置10 min后倒掉水,用滤纸吸干残留水分后加入浓缩胶插入1.0梳子,室温静置30 min后拔掉梳子蛋白上样10μL/30μg。电泳稳压100 V,待溴酚蓝至分离胶底端时停止电泳;转模280 mA,100 min。转模结束,用1×TBST洗膜液洗膜5 min/次,重复3次;5%脱脂牛奶室温摇床封闭2 h后用1×TBST洗膜液洗膜5 min/次,重复3次;加一抗Keap1、IKKβ、NF-kB于抗体孵育盒4℃过夜,次日取出室温复温1 h,回收一抗,TBST洗膜液洗膜3次,每次5 min;加二抗,在室温摇床1 h后再用1×TBST洗膜液洗膜3次,每次5 min,然后进行化学发光成像曝光条带。采用Image J软件进行分析计算灰度值(靶蛋白灰度值/GAPDH灰度值)。

表1 Keap1、IKKβ、NF-kB的引物
1.3 统计学方法
实验数据采用SPSS 23.0统计软件进行分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA)。P≤0.05为差异有统计学意义。
2 结果
2.1 LBP对CCl4致急性肝损伤小鼠肝湿重、体质量和肝脏指数的影响
与正常对照组相比,模型组小鼠肝湿重增加、体质量下降、肝脏指数升高(P<0.05或<0.01)。与模型组相比,LBP低剂量组和中剂量组肝湿重、体质量和肝脏指数差异均无统计学意义(P均>0.05),高剂量组肝湿重下降、体质量增加、肝指数下降(P<0.05或<0.01),见表2。
2.2 LBP对CCl4致急性肝损伤小鼠肝组织病理学变化的影响
正常对照组肝组织肝小叶结构完整清晰,肝细胞形态正常,肝细胞以中央静脉为中心呈放射状排列。模型组肝小叶和肝细胞结构紊乱不规则,有不同程度性水肿,呈空泡样变性,部分有炎细胞浸润。与模型组相比,LBP低剂量组、中剂量组和高剂量组有不同程度减轻,并随药物剂量的增加改善程度愈加明显,细胞排列趋于正常,细胞水肿逐渐减轻,空泡样改变逐渐消失,炎细胞浸润逐渐减少,见图1。

表2 LBP对CCl4致急性肝损伤小鼠肝湿重、体质量和肝脏指数的影响

图1 LBP对CCl4致急性肝损伤小鼠肝组织病理形态的影响(HE×200)
2.3 LBP对CCl4致急性肝损伤小鼠血清生化指标和炎性因子水平的影响
与正常对照组相比,模型组ALT、AST、TNFα、IL-1β、IL-6水平均升高(P均<0.01)。与模型组相比,LBP低剂量组IL-1β水平降低(P<0.01),其余指标差异均无统计学意义(P均>0.05);LBP中剂量组仅ALT水平无明显变化,AST、TNF-α、IL-1β、IL-6均降低(P均<0.01);高剂量组AST、ALT、TNF-α、IL-1β、IL-6均降低(P均<0.01),见图2。
2.4 LBP对CCl4致急性肝损伤小鼠肝组织Keap1、IKKβ、NF-kB mRNA表达的影响
与对照组相比,模型组Keap1mRNA的表达降低(P<0.01),而IKKβ和NF-kBmRNA表达均升高(P均<0.01)。与模型组相比,低剂量组Keap1、IKKβ和NF-kBmRNA表达差异均无统计学意义(P均>0.05);中剂量组和高剂量组Keap1mRNA表达均升高(P均<0.01),而IKKβ和NF-kBmRNA的表达均降低(P均<0.01),见图3。
2.5 LBP对CCl4致急性肝损伤小鼠肝组织Keap1、IKKβ、NF-kB蛋白表达的影响
与正常对照组相比,模型组Keap1蛋白表达降低(P<0.01),IKKβ蛋白表达升高(P<0.01),NF-kB蛋白表达升高(P<0.05)。与模型组相比,高剂量组Keap1蛋白表达升高(P<0.05);LBP中剂量组和高剂量组IKKβ和NF-kB蛋白表达降低(P<0.01),见图4。
3 讨论

图2 LBP对CCl4致急性肝损伤小鼠血清ALT、AST、TNF-α、IL-1β、IL-6表达水平的影响

图3 LBP对CCl4致急性肝损伤小鼠肝组织Keap1、IKKβ、NF-kB mRNA表达的影响
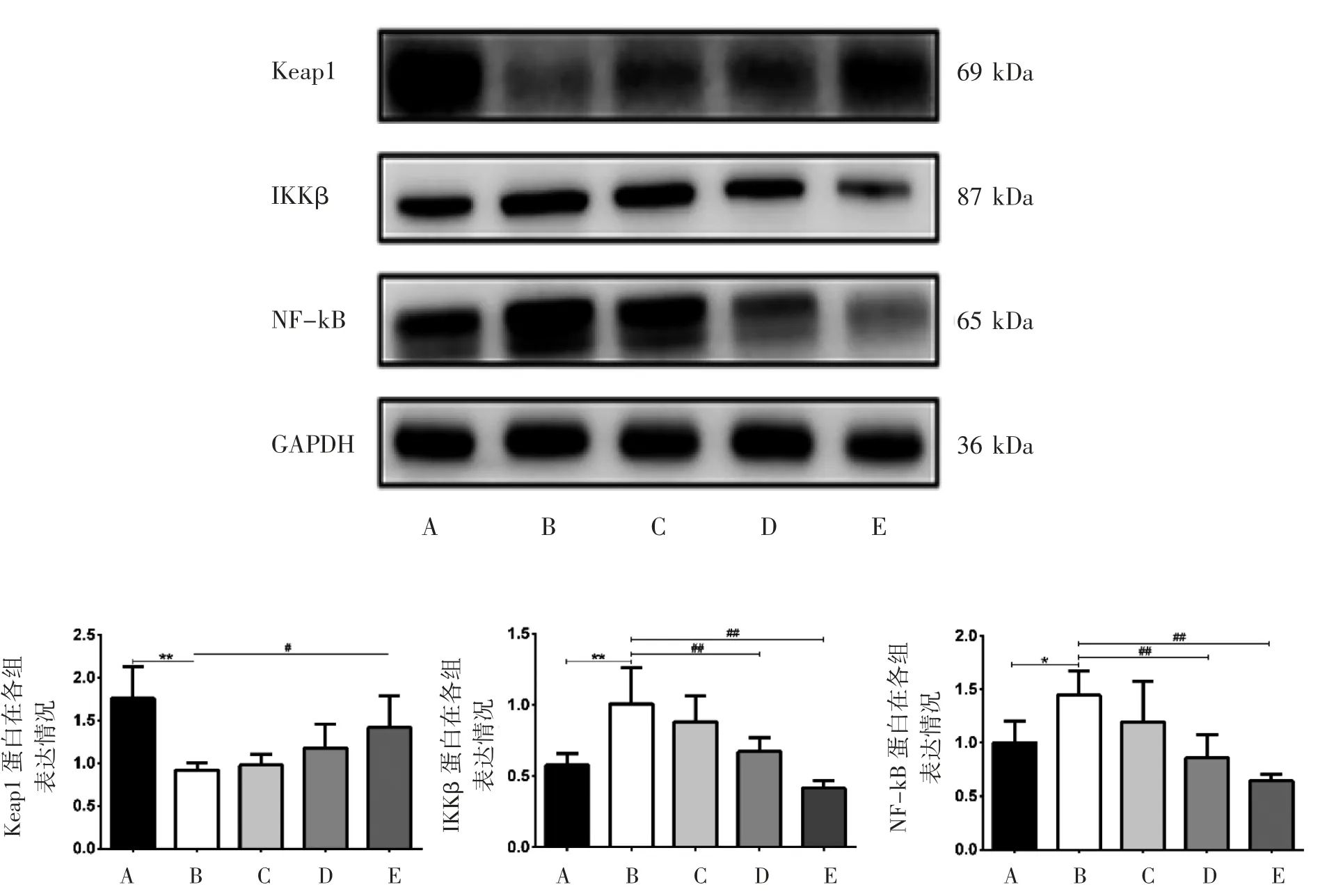
图4 LBP对CCl4致急性肝损伤小鼠肝组织Keap1、IKKβ、NF-kB蛋白表达的影响
肝脏损伤的动物模型复制途径包括化学性、免疫性、生物性、酒精性等方法。CCl4长期以来由于其诱导的动物模型所表现的症状、肝功能检查指标以及病理学变化与人体肝损伤十分相似而被广泛使用。该方法操作简单,重复性好而被认为是经典的肝损伤模型,常用来进行保肝药物的筛选。由于肝脏属于再生组织,具有强大的组织修复能力,因此造模过程中给药剂量和用药时间不同可引起急性肝损伤、慢性肝损伤和肝纤维化等不同实验所需要的动物模型[10]。本实验遂采取CCl4食用花生油溶液(浓度为0.1%)0.1 mL/10 g一次性腹腔注射诱导小鼠急性肝损伤。血清生化指标ALT和AST是存在于胞浆内的两种可溶性酶,是判断肝功能受损的重要指标。肝细胞经CCl4损伤时,细胞膜通透性增强,ALT和AST由胞质释放到胞外,血清含量升高,在一定程度上反映了肝脏损伤的严重程度。
目前,急性肝损伤的发病机制主要与氧化应激和炎症反应有着密切关系。LBP是从我国传统名贵药材枸杞中提取的主要有效成分,保肝作用是LBP目前研究比较广泛的一面,主要是通过降低肝脏受损状态下氧化应激水平来实现的[11]。急性肝损伤时,肝脏会产生一系列的免疫应答反应,作为机体最大的巨噬细胞库,又称肝库普弗细胞(Kupffer细胞)分泌大量的炎性细胞因子如TNF-α、IL-1β、IL-6等参与肝损伤的发生过程。TNF-a是肝巨噬细胞受损时释放最早的炎性细胞因子;IL-1β作为体内最强的炎性因子,是TNF-α级联反应的产物,又是免疫炎症反应的重要介质,促进炎症细胞因子的表达,诱导细胞免疫应答;IL-6是重要的淋巴因子,通过激活调节免疫细胞,参与免疫反应,当它们过度表达时介导炎性因子趋化作用加剧瀑布样炎症反应,最终导致组织损伤[12]。核因子-kB(nuclear factor-kB,NF-kB)是免疫炎症反应过程中经典的炎性因子,静息状态NF-kB与其抑制因子(inhibitor of nuclear factors-kB,Ikβ)相结合形成复合物,使NFkB滞留在细胞质中处于非活化状态呈现低表达水平。核转录因子-kβ抑制蛋白激酶(inhibitor of nuclear factors-kB kinase,IKK)是一种丝氨酸/苏氨酸蛋白激酶复合体,由IKKα、IKKβ、IKKγ3个亚基组成,其中IKKβ具有丝氨酸蛋白激酶活性,是NF-kB上游重要的调节激酶[13]。肝细胞经CCl4损伤时,白细胞介素作为一种重要的炎性介质和免疫调节因子,使IKK被激活,IkB蛋白降解,NFkB与IkB解离,NF-kB随即由胞质转位至胞核内与特异性启动子结合,介导炎性细胞因子在细胞内与细胞之间相互表达,多向调节炎症反应,引起炎症反应的级联放大效应[14-15]。
Keap1又称胞浆肌动蛋白伴侣分子,通过泛素连接酶E3与靶蛋白特异性结合促使靶蛋白泛素化降解,Nrf2是细胞抗氧化应激的转录因子,在胞质中与Keap1结合,被Keap1负性调控[8]。相关研究表明IKKβ与Keap1相互作用类似于Nrf2,可以直接作用于IKKβ,调控NF-kB信号通路[16-17]。本研究结果显示,与对照组相比,小鼠经CCl4诱导的模型组ALT和AST活性升高,Keap1表达降低,IKKβ、NF-kB、TNF-α、IL-1β、IL-6表达升高;与模型组相比,LBP低剂量对模型组的损伤基本无明显改善,中剂量组和高剂量组ALT和AST活性降低,Keap1表达升高,IKKβ、NFkB、TNF-α、IL-1β、IL-6表达降低。
综上所述,LBP可有效改善CCl4致小鼠急性肝损伤的损伤程度,降低炎性因子的表达,对CCl4致急性肝损伤小鼠具有保护作用,其保护作用可能与增强Keap1活性,降低IKKβ/NF-kB信号通路活性有关。

