腰椎管狭窄症患者间歇性跛行类型与马尾神经传导的相关性分析
张芳权
(信阳市中心医院,河南信阳 464000)
腰椎管狭窄症(lumbar spinal stenosis,LSS)是常见的腰椎退行性疾病,多发于40岁以上中老年人[1],其影像学表现包括MRI和CT脊髓造影显示马尾部的硬脑膜囊面积(dural sac area,DSCA)的减少和马尾神经冗余征(redundant nerve roots,RNRs),但部分患者通常无临床症状,临床定量评估困难[2]。神经源性间歇性跛行(neurogenic intermittent claudication,NIC)是LSS的典型症状[3]。根据患者的下肢症状,NIC可分为三种类型:马尾型(cauda equina-type,CE型)表现为麻木、灼热或感觉异常;根型(radicular-type,R型)表现为神经根性疼痛;混合型(mixed-type,MX)表现为感觉异常和神经根性疼痛混合症状[4]。既往有研究显示,在腰骶椎用磁刺激测量马尾传导时间(cauda equina conduction time,CECT)有助于诊断CE型NIC[5],但目前缺乏LSS和正常对照组患者CECT差异的报道。本研究旨在探讨LSS患者CECT与NIC类型的关系,旨在为LSS的临床诊断提供数据支持,现报告如下。
1 资料与方法
1.1 一般资料
选择2016年9月~2019年6月在本院接受手术治疗的LSS患者作为研究组。纳入标准:①经CT或MRI等影像学检查证实相应节段LSS,具有典型的间歇性跛行或神经根症状,经正规保守治疗≥3个月症状无改善或持续加重;②患者年龄40~75岁,性别不限;③患者对研究知情并签署知情同意书。排除标准:①合并腰椎滑脱、腰椎失稳者;②外周动脉疾病或血管性间隙性跛行;③合并可导致四肢麻木的神经系统疾病;④合并疑似压迫性神经病变如跗管综合征、免疫性神经病变如格林巴利综合征、慢性炎症性多发性神经病及代谢性神经病变;⑤精神疾病或认知功能障碍者;⑥既往有下肢功能障碍、下肢缺如、长期瘫痪者;⑦平行参加其他临床研究者。共纳入患者102例,其中男40例,女62例;年龄44~73岁,平均年龄(62.46±7.08)岁。抽取同期在我院健康体检的47例受试者作为对照组,对照组受试者年龄41~70岁,无LSS及其他腰部病变症状及影像学征象,对研究知情并签署知情同意书,余排除标准同研究组。对照组男20例,女27例;年龄41~70岁,平均年龄(61.38±6.29)岁。两组患者性别、年龄等基线资料比较,差异均无统计学意义(P>0.05),有可比性。研究组患者根据NIC类型分为CE型43例,MX型37例,R型22例。本研究经医院伦理会批准,所有受试者均签署知情同意书。
1.2 CECT测量方法
在外展肌(Abductor muscle,AH)放置自粘表面记录电极,在肌肉放松时记录AH肌肉运动诱发电位,采用单相刺激器连接14 cm外径线圈给予磁刺激,线圈上边缘位于S1棘突上方,S1通过触诊定位,从L5至S2棘突寻求运动诱发电位最大振幅位置,在踝关节胫神经上电刺激后记录复合肌肉动作电位和F波,测量F波最短潜伏期,通过从外周运动中减去运动诱发电位的起始潜伏期计算CECT时间。
1.3 DSCA和RNRs检测
所有LSS患者均接受MRI或CT脊髓造影检查,测量DSCA和RNRs表现,DSCA取患者狭窄最严重的截面;RNRs定义为矢状面上松弛、环状或弯曲的神经根。
1.4 统计学方法
采用SPSS 23.0软件包进行统计学数据分析,计量资料采用均数±标准差表示,采用t检验;计数资料采用率或百分比表示,采用x2检验;相关性分析采用Spearman相关分析,多因素分析采用多元线性回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组CECT比较
研究组患者中CE型、MX型、R型的CECT均显著高于对照组,且CE型、MX型明显高于R型,CE型明显高于MX型,差异均有统计学意义(P<0.05),见表1。
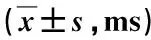
表1 两组患者CECT比较
2.2 不同亚型LSS患者DSCA比较
CE型、MX型、R型患者的DSCA差异存在统计学意义(F=124.572,P<0.05),见表2。
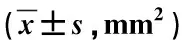
表2 不同亚型LSS患者DSCA比较
2.3 CECT和DSCA的相关性
Spearman相关性分析显示,CE分型和MX分型患者DSCA和CECT呈负相关性(P<0.001),R型患者DSCA与CECT结果不存在相关性(P>0.05),见表3。

表3 CECT和DSCA的Spearman相关性分析
2.4 关于CECT的多因素回归分析
以CECT为应变量,将年龄(连续变量)、性别(女=0,男=1)、体质量指数(连续变量)、NIC类型(R型=0,CE型=1,MX型=2)、DSCA(连续变量)引入多元线性回归分析,结果显示,CE型、MX型、DSCA与CECT存在相关性(P<0.05),见表4。
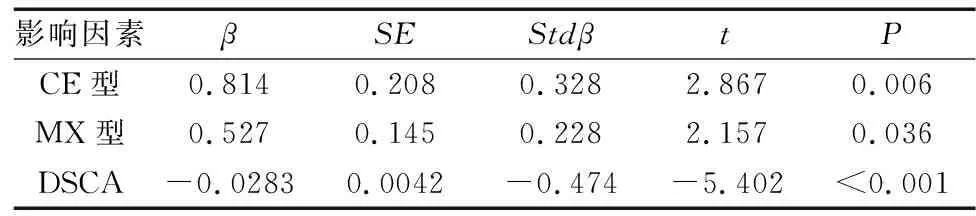
表4 CECT影响因素的多因素分析
3 讨论
本研究显示,LSS患者的CECT与NIC类型存在相关性,CE型CECT最长,MX型次之,R型CECT最低。在CE型和MX型的LSS患者中,CECT与DSCA呈负相关,几乎所有患者均检测到RNRs,CECT延长可能因为CE被局部慢性压迫,RNRs脱髓鞘导致CECT延长。
RNRs是常见的临床征象,表现为蛛网膜下腔细长、弯曲、蛇行的神经根,与腰椎管狭窄密切相关[6]。既往研究显示,LSS患者术中观察到与硬膜囊严重压迫相关的RNRs[7]。另一项研究在尸检中同样观察到RNRs,该研究发现RNRs多见于S1和S2神经根中,神经纤维排列异常和减少及其脱髓鞘是RNRs常见的病理改变,认为RNRs可能是长期椎管狭窄的病理结果[8]。国外一项研究观察RNRs术中神经传导速度约为26~36.8 m/s,而在同一患者中,非纯神经的传导速度在45~55 m/s之间,提示RNRs的病理改变是脱髓鞘所致[9]。这些结果提示,提示CECT延长预示着脱髓鞘的存在。
既往研究显示,健康成年人的CECT为(3.2±0.9)ms[10],本研究中健康对照组受试者CECT为(3.32±0.92)ms,与该研究相近。另一项研究曾经报告了7例具有CE症状的LSS患者CECT,结果显示,患者平均CECT为(6.0±2.5)ms[11],本研究CE型患者CECT为(5.73±1.08)ms,与该研究接近。Matsumot等[12]在L1和L5椎体水平用腰椎层流电刺激测量CECT,发现LSS患者CECT显著长于正常对照组,提示患者下腰骶部运动神经根因为LSS而存在局部和慢性受压。本研究同样显示,NIC的LSS患者CECT显著延长,进一步分析显示,CE型表现的患者CECT延长更为显著,提示CECT延长可用于辅助诊断CE功能障碍,而对神经根性疼痛患者的诊断意义较低。
采用MRI或CT脊髓造影分析硬膜囊大小,为LSS诊断提供了更为可靠的方式,研究显示,DSCA显示L3-4及其远端相对狭窄的截断值为100 mm2[13]。Futatsugi等[14]通过尸检报告显示,LSS患者硬膜囊的临界值为75 mm2,本研究中CE、MX和R型患者DSCA平均值均低于75 mm2,与既往研究一致。本研究显示,包括CE的类型(CE型和MX型)的DSCA显著低于R型。Ji等[15]研究显示,LSS腰痛患者L4-5水平的DSCA平均值为(136±42)mm2,根性疼痛LSS患者的DSCA平均值为(85.0±32.1)mm2,而出现CE症状的患者DSCA平均值为(68.7±20.2)mm2,该研究结果提示,LSS的CE症状与DSCA减小相关。本研究显示,CE症状的LSS患者CECT与DSCA之间存在相关性,CE型和MX型患者CECT和DSCA之间存在负相关,提示在CE型和MX型LSS中存在S2神经脱髓鞘和硬膜囊严重狭窄,其机制主要为S2神经位于硬脑膜囊中心位置,随着DSCA体积减小,内S2神经和外S2神经均受到压迫损伤,导致神经脱髓鞘,放射学上可检测到RNRs,电生理上表现为CECT延长。
综上所述,本研究结果提示CECT是评估LSS患者运动神经通路的客观、定量方法,可对LSS患者进行快速、简便的无创性检查和评价,以鉴别LSS的功能亚型。其临床意义主要在于:①MRI是评估硬膜囊形态异常的有效方式,但其不适用于检测功能损害,MRI显示的压迫与CE功能障碍相关性较弱;③间歇性跛行是LSS和周围动脉疾病的共同症状,但骨关节炎、类风湿性关节、外周动脉疾病不会导致CE脱髓鞘,因此CECT是诊断LSS功能亚型的有效手段,为临床合并骨关节病、类风湿性关节炎等下肢疼痛性疾病无法行步态负荷实验的患者提供了诊断LSS功能亚型的新手段。

