采血管预冷后保存血糖标本效果评价
李晓宗 胡燕 吴平 宋云端
(复旦大学附属浦东医院检验科,上海 201300)
现代医疗仪器及耗材在临床检验中大量使用,并对检验质量造成深刻影响。真空采血管是一种检验科大量使用的耗材,血液采集和分离是临床生化检验中极为重要的一环,影响着检测结果的准确性[1]。1990~2017年,糖尿病在中国疾病负担的位次从第19位上升到第8位[2],糖尿病患者的诊断和风险评估依赖于葡萄糖浓度的准确检测,随着检测方法学进步和试剂标准化,血糖检测的准确度和精密度大大提高,这时由糖酵解造成的分析前误差逐渐成为葡萄糖检测误差的主要原因[3]。目前国内大多数实验室均采用《全国临床检验操作规程》推荐的含有糖酵解抑制剂氟化钠的葡萄糖专用采血管采集、保存、转运血糖标本,但越来越多的研究证实由于氟化钠起效较慢,不能及时抑制标本内葡萄糖的糖酵解反应,导致检测值和真实值之间出现偏差[4],因此美国糖尿病学会(American Diabetes Association,ADA)和美国临床生物化学学会(National Academy of Clinical Biochemistry,NACB)在2011年发布的血糖标本采集指南中推荐使用柠檬酸酸化管替代氟化钠管。目前存在的问题是柠檬酸酸化血糖管亟待标准化,也缺乏分析性能方面的可靠性验证,使用柠檬酸酸化管后现有血糖参考区间和诊断阈值也需要重新评估及验证[5,6],酸化管的推广还存在一定障碍。冰水法一直作为ADA和NACB推荐方法用于血糖体外保存的研究,其要求标本采集后立即放入冰水中并在30min内完成血浆和细胞的分离,但这一方案实用性较差。现对该方法进行了适当改良,并采用基于生物学变异的质量规范来判断其保存血糖的效果,报道如下。
1 材料和方法
1.1 材料
1.1.1 真空采血管
广州阳普医疗科技有限公司提供,肝素锂采血管(Φ13×75,批号:176898),EDTAK2-氟化钠采血管(Φ13×75,批号:178798)。
1.1.2 仪器与试剂
分析仪器为ADVIA2400全自动生化分析仪。试剂由Siemens-Bayer公司生产,批号为439419,检测方法为己糖激酶法,定标品为试剂配套,批号135808B。室内质控品由Beckman公司提供,低、中、高值批号分别为M701051、M701052、M701053。标本测定前,进行质控品的测定,质控通过后再进行样本的测定,同时加测质控品,两次质控结果均符合要求则样本测定结果有效。
1.1.3 冰水混合物容器
由小型标本转运箱进行简易改装而成,冰块为实验室自行制备。放置一试管架于转运箱内,冰块放置试管架周围,加水使液面距试管架顶端2cm处。肝素锂管使用前放于箱内预冷不少于30min,标本采集时由箱内取用,标本采集完毕并标注编号信息后迅速放回箱内保存。
1.2 方法
20名自愿者由门诊患者中招募,其中男9名,女11名,年龄45±11.5岁(26~66岁),无贫血及已知重大器官疾病、肿瘤、血液、免疫性疾病,血常规检查白细胞、红细胞压积正常。自愿者取坐姿由3名经验丰富的护士同时采血,标本采集遵照《样本采集手册标本》规定程序。自愿者使用预冷肝素锂采血管连续采血4份,每份3ml,采集后立即放于转运箱内的试管架上(肝素锂管冰水组);使用EDTAK2-氟化钠管连续采血3份,每份采血为3ml,采集后放置试管架室温(25℃)保存(EDTAK2-氟化钠管室温组)。每位自愿者标本采集完成后即刻取1份肝素锂管标本立即离心分离血浆并上机检测,检测值作为基准值。然后分别在30、60、120min后按照自愿者标本编号在两组中随机取1份离心检测。所有标本离心均在中国湘仪公司KH120R低温离心机进行,温度设定为4℃,2500×g离心15min。
1.3 统计学方法
使用Graphpad Prism 7.0软件包进行统计分析及绘图。符合正态分布实验数据以表示,组间比较采用配对t检验,P<0.05为差异有统计学意义。以WESTGARD网站最新公布的个体内生物变异(CVi)与个体间生物变异(CVG)计算血浆葡萄糖实验室检测的最低、适当和最佳的质量指标,最低质量指标:TEa<1.65×0.75CVi+0.375(CVi2+CVG2)0.5=8.32%;适当质量指标:TEa<1.65×0.5CVi+0.25(CVi2+CVG2)0.5=5.90%;最佳质量指标:TEa<1.65×0.25CVi+0.125(CVi2+CVG2)0.5=2.64%,并以此标准判断结果是否可以被临床接受。
2 结果
2.1 两组检测结果及比较
肝素锂管冰水组和EDTAK2-氟化钠管室温组标本放置30、60、120min后离心检测,实验数据经检验符合正态分布,以表示(见表1);两组各时间点检测值均随着时间延长出现进行性下降,放置相同时间EDTAK2-氟化钠管室温组较肝素锂管冰水组
表1 标本放置0、30、60、120min后血糖测定结果(,mmol/L)
注:与基准值比较,*P<0.05,差异有统计学意义。
下降更为明显;肝素锂管标本在冰水中放置30、60min血糖检测值和即刻检测值进行配对t检验,P值分别为0.1670、0.0553,差异无统计学意义(P>0.05)。肝素锂管冰水组120min、EDTAK2-氟化钠管室温组30、60、120min血糖检测值与基准值比较均有统计学意义(P<0.01)。
2.2 两组检测结果偏差与质量指标的比较
肝素锂管冰水组30、60、120min检测结果与基准值平均偏差分别为-0.25%、-0.64%、-2.54%。EDTAK2-氟化钠管室温组30、60、120min检测结果与基准值平均偏差分别为-3.67%、-6.07%、-7.76%(见图1)。以WESTGARD网站最新公布的个体内生物变异(CVi)与个体间生物变异(CVG)计算出的血浆葡萄糖实验室检测最低、适当和最佳的质量指标衡量:(1)肝素锂管冰水组30、60、120min检测结果与基准值平均偏差均小于最佳质量指标;(2)EDTAK2-氟化钠管室温组30min检测结果介于最佳和适当质量指标之间;(3)EDTAK2-氟化钠管室温组60、120min检测结果与基准值平均偏差大于适当质量指标。
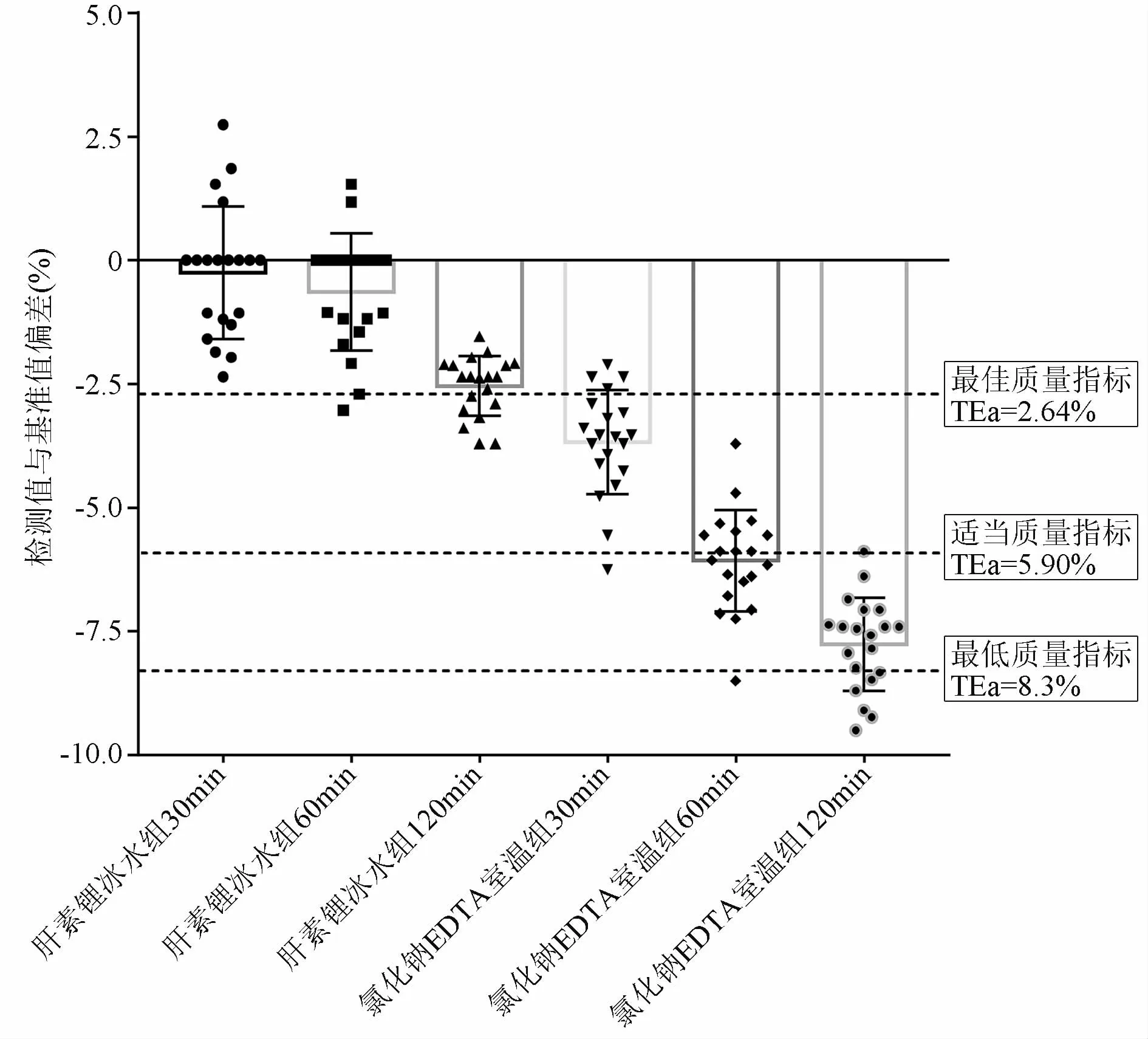
图1 标本放置30、60、120min后离心血糖测定结果与基准值偏差
3 讨论
实验耗材是专业院校或医疗单位的检验检测部门、第三方的独立检验检测机构以及其他的实验室开展实验工作的常用物品。随着医疗过程安全性与便捷性越来越受到重视,耗材逐渐在医疗技术的应用过程中发挥出更大的作用,尤其是医学检验项目的完成,必须依赖很多实验室耗材才能实现准确的分析结果。
血糖是糖尿病诊断和治疗监测最为重要的指标,但由糖酵解造成的检验前误差始终困扰着临床血糖检测[7]。糖酵解是指葡萄糖在无氧或缺氧的条件下分解为乳酸的同时产生少量ATP的过程,反应温度和酶活性可以显著影响包括糖酵解反应在内的化学反应过程,因此抑制糖酵解反应中参与酶的活性和降低温度都可以抑制、降低糖酵解的反应进程。
氟化钠作为添加剂在临床广泛使用,但因为氟化钠所作用的烯醇酶位于糖酵解过程中的最后阶段且为非限速酶,导致其4h以后才能完全发挥作用[8]。在以往的文献报道中,一般都是在标本采集后立即进行了血浆的分离检测,从而得出氟化钠是保护血糖的良好添加剂的结论,但标本离心分离前在室温下留置的这个时间段往往被忽视。据张吟眉[9]等报道,离心前的草酸钠-氟化钠采血管中的葡萄糖浓度随放置时间增加而降低,王路等[10]报道氟化钠抗凝管离心前、后放置血糖测定值有差异,放置2h后平均相差0.667mmol/L;氟化钠另外一个重要的缺点是它对红细胞的完整性破坏较为严重[11],因此在2011年ADA和NACB发布的血糖标本采集指南中推荐在采血管中加入柠檬酸替代氟化钠添加剂。柠檬酸缓冲液可以使反应体系的pH值降低为5.5,抑制了糖酵解反应初始阶段的限速酶——己糖激酶,使糖酵解在初始阶段即被终止,一些文献也表明柠檬酸管对血糖的稳定作用大大优于氟化钠管,溶血状况也得到了改善[12,13]。但亦有文献研究指出采用柠檬酸添加剂后现有的糖尿病诊断阈值、参考区间还需要大量临床数据的重新评估及验证[14],大规模临床应用尚存在障碍。温度对酶活性有显著影响,所以温度也是决定酶催化化学反应速率的关键因素,温度降低酶促反应减弱或停止,温度升高反应速度加快[15]。糖酵解反应作为一种酶催化化学反应,温度降低可以显著降低糖酵解反应。血糖标本放入冰水混合物后,由于冰水的物理降温作用,使标本温度降低,糖酵解进程减缓,标本内葡萄糖的“损耗”减少。有研究表明,血液进入采血管后其温度从体温降至0℃需要10min左右[16],因此该研究在标本采集前即对采血管进行了预冷却处理,使标本温度降低得更为迅速,减少糖酵解作用对标本内血糖的损耗。基于生物学变异的质量规范是处于1999年“建立全球检验医学分析质量规范策略”会议协商决定的目前质量规范五级层级模式中的第二级,它着重考虑了临床检验结果主要用于疾病监测和诊断的医学需求[17],优于目前大多数临床实验室采用的处于质量规范层级模式中第4级的美国临床实验室修正法规(CLIA′88),所以选用了基于生物学变异的质量规范来评价本次试验中血糖的偏差。实验表明,改良冰水法能够在2h内有效“保护”血糖,标本检测平均偏差小于基于生物学变异的最佳质量指标,能够被临床接受。该研究筛选自愿者时排除了白细胞升高、红细胞压积不在正常范围者,对于此类患者的血糖标本使用冰水法保存其效果是否理想还需要进一步研究。
4 结论
研究表明,真空采血管进行了预冷处理后其对血糖标本中血糖的保护作用明显提升,在不增加耗材成本的基础上提高了血糖检测结果的准确性。实验表明,氟化钠添加剂采血管采集葡萄糖标本后如不能及时离心检测其结果用于临床诊断及病情判断并不可靠,容易造成不良医学后果。改良冰水冷却法可以在2h内有效保存葡萄糖标本,可以被临床接受,进一步完善后可用于离心前血糖标本的保存。

