大庆市某牧场牛白血病病毒感染情况调查
何思锐,武 瑞,连 帅,王建发,张 迪,高 丽
(1. 黑龙江八一农垦大学动物科技学院, 黑龙江 大庆 163319;2. 黑龙江省牛病防制重点实验室, 黑龙江 大庆163319)
牛白血病病毒(bovine leukemia virus,BLV)属于逆转录病毒, 主要引起牛地方流行性白血病(enzootic bovine leukosis,EBL)。 该病的特征主要包括持续性B 淋巴细胞增多及全身淋巴结肿大,潜伏期(一般为4~5 年)临床症状不明显,临床发病后死亡率较高。 BLV 可将自身RNA 转变为DNA,并整合至宿主基因组中以前病毒形式存在,且大多数BLV 感染牛因无明显临床症状被忽略。BLV 感染造成的奶牛泌乳量下降、淘汰率增加、免疫功能受损、患病风险升高及进出口限制等问题,制约着奶牛养殖业的健康可持续发展。 有调查显示,子宫内传播是垂直传播的重要途径,病毒载量(proviral load levels,PVL) 越高,BLV 传播的风险越高[1]。 目前,牛白血病的常规检测方法是采用酶联免疫吸附试验(ELISA)检测血清BLV 抗体,但检测成本较高且易出现假阴性和假阳性结果的问题[2-3],因 此,将 荧 光 定 量PCR 检 测BLV 前 病 毒DNA 作为牛感染BLV 的辅助检测方法。
近年来,诸如芬兰[4]、瑞士[5]、丹麦[6]、荷 兰[6]等西欧发达国家已相继在全国范围内消灭了该病毒。 但在世界上其他地区,BLV 的感染和传播仍然非常普遍,诸如阿根廷、哥伦比亚、日本、韩国和中国台湾地区奶牛BLV 感染阳性率均超过40%[7-11]。 杨奕[12]2018 年调查研究发现,我国大陆地区奶牛BLV 阳性感染率为49.1%。 2014 年师庆伟等[13]通过ELISA 方法检测黑龙江省规模化奶牛场BLV 感染率为9.76%。 Yu 等[14]2019 年调查了黑龙江地区的9 个养殖场的BLV 感染情况,感染率在0~31.00%,大庆地区感染率为10.00%。但随着国内规模化牧场的快速发展和管理水平的提高,BLV 感染情况可能有所改变。 定期检测、早期预防BLV 感染对规模化牧场防控、净化该病具有重要意义,因此,该试验采用ELISA 和荧光定量PCR 法对大庆某规模化牧场进行了BLV 感染情况调查。
1 材料
1.1 试验样品
随机选取大庆市某规模化牧场泌乳期奶牛107 头,于尾根静脉采集5 mL 血液至含EDTA 真空采血管中, 一式两份并做好标记,2~8 ℃保存带回实验室。
1.2 主要试剂
BLV 阳性质粒, 由哈尔滨兽医研究所惠赠;BLV 抗体ELISA 检测试剂盒 (P02110-5), 购自IDEXX 公司;天根DNA 提取试剂盒(DP304-03),购自天根生化(北京)科技有限公司;SYBR Premix Ex Taq(Tli RNaseH Plus)(2×),购自宝日医生物技术(北京)有限公司;红细胞裂解液购自北京索莱宝科技有限公司。
1.3 主要仪器
荧光定量PCR 仪(CFX96) 产自美国伯乐公司; 核酸蛋白质测定仪产自美国热电公司; 移液器、离心机均产自德国Eppendorf 公司。
2 方法
2.1 ELISA 检测BLV 抗体
①试剂准备:用稀释缓冲液N.2 对阴、阳性对照品和样品进行20 倍稀释;用去离子水对浓缩洗涤液N.2 进行10 倍稀释;用稀释缓冲液N.1 对浓缩酶标抗体进行100 倍稀释。
②阴性对照孔:任取两孔加入100 μL 稀释好的阴性对照品;阳性对照孔:任取两孔加入100 μL稀释好的阳性对照品;样品孔:加入100 μL 待检样品。旋涡振荡器振荡,充分混匀,盖上盖板,置于37 ℃恒温培养箱中孵育1 h。
③取出孔板,弃掉孔中液体,每孔加入300 μL洗涤液,洗涤3 次,在最后一次弃掉液体后,甩净拍干。
④每孔加入100 μL 稀释的酶标抗体,盖上盖板,置于37 ℃恒温培养箱中孵育30 min。
⑤重复步骤③。
⑥每孔加入100 μL TMB 底物溶液N.13,室温条件下,避光孵育20 min,每孔加入100 μL 终止溶液N.3。 利用酶标仪检测样品和对照品在450 nm 下的吸光值。
2.2 荧光定量PCR 检测
2.2.1 引物设计参考文献中BLV pol 基因特异性引物序列[15]设计引物,由生工生物工程(上海)股份有限公司合成, 上游引物序列:5′-CCTCAATTCCCTTTAAACTA-3′; 下游引物序列:5′-GTACCGGGAAGACTGGATTA-3′; 扩增片段长度为120 bp。
2.2.2 DNA 的提取吸取300 μL 全血样本置于1.5 mL 离心管中, 加入900 μL 的红细胞裂解液,颠倒混匀, 室温放置5 min,10 000 r/min 离心1 min,吸取上清液,留下白细胞沉淀;加入200 μL 缓冲液GA,振荡至彻底混匀;加入20 μL Proteinase K溶液,混匀;加入200 μL 缓冲溶液GB,混匀,70 ℃水浴10 min 至清亮,去除内壁水珠;加入200 μL无水乙醇,混匀15 s 后,将所得溶液和絮状沉淀都加入吸附柱CB3,12 000 r/min 离心30 s; 倒掉废液, 向吸附柱CB3 中加入500 μL 缓冲液GD,12 000 r/min 离心30 s;倒掉废液,将CB3 放入收集管, 向吸附柱CB3 中加入600 μL 漂洗液PW,12 000 r/min 离心30 s, 倒掉废液, 将吸附柱CB3放入收集管;重复上一步骤;12 000 r/min 离心2 min,倒掉废液,彻底晾干吸附材料中残余的漂洗液;将吸附柱CB3 转入一个干净的无RNA 酶离心管, 向吸附柱中间部位悬空滴加50 μL 洗脱缓冲液TE, 室温5 min 后扯掉吸附柱CB3 的盖子,将离心管管盖扣在吸附柱CB3 上,12 000 r/min 离心2 min,将溶液收集到离心管中。
2.2.3 质粒标准品的制备用核酸蛋白质测定仪测定BLV 阳性质粒浓度, 根据拷贝数计算公式[ 拷 贝/μL =(6.02 ×1023) ×(ng/μL ×10-9)/(DNA Length×660)]计算拷贝数为4.17×1010拷贝/μL。并进行10 倍倍比稀释(102~108),作为荧光定量PCR的标准品。 反应程序:95 ℃30 s,95 ℃5 s,60 ℃30 s,40 个循环进行扩增。
2.2.4 样品检测以提取的样品DNA 为模板进行扩增, 总体系为25 μL。 反应体系:ddH2O 9.5 μL, 上、 下游引物各0.5 μL (10 μmol/L),SYBR Premix Ex Taq(Tli RnaseH Plus)(2×)12.5 μL,DNA模板2 μL,按上述荧光定量PCR 反应条件进行检测,并与ELISA 检测结果进行比较。
3 结果
3.1 ELISA 与荧光定量PCR 检测结果
将107 份牛血清样品进行ELISA 检测, 共检出阳性样品34 份,ELISA 检测阳性率为31.78%;利用上述荧光定量PCR 检测方法加以验证,对107 份DNA 样本进行检测,结果显示,阳性样本数为40 份,阳性率为37.38%;两种检验方法的阳性重合率为85.00%(见表1)。

表1 ELISA 检测与荧光定量PCR 检测结果
3.2 荧光定量PCR 标准曲线的绘制
以665 ng/μL 的BLV 标准品为模板, 以起始模板浓度的对数为横轴、Ct 值为纵轴绘制标准曲线, 曲线方程为y=-3.478x+36.157, 相关性系数R2=0.999 8。 在102~108拷贝/μL 范围内具有良好的线性关系(见图1)。
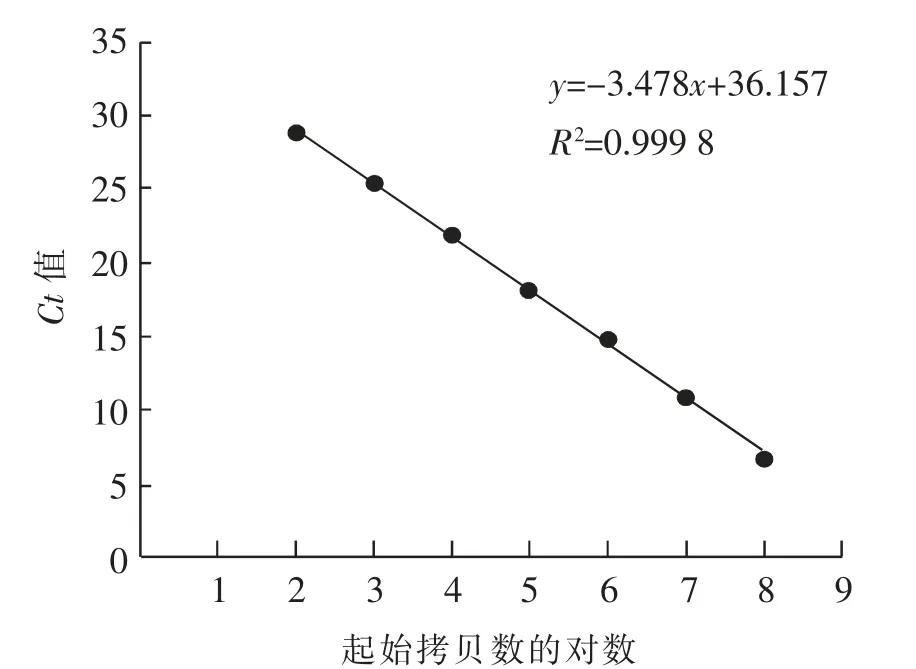
图1 荧光定量PCR 标准曲线
3.3 荧光定量PCR 检测结果
根据荧光定量PCR 检测结果中的阳性牛Cq值计算前病毒DNA 拷贝数,按照“高载量病毒>1 000 拷贝数/ng>低载量病毒”标准分出高、低病毒载量牛,高载量牛28 头,占牛总数的26.17%,低载量牛12 头,占阳性牛总数的11.21%,结果见表2。

表2 荧光定量PCR 检测结果
4 讨论
为了解大庆市某规模化牧场牛白血病病毒感染情况, 对采集的107 份样品进行了ELISA 检测与荧光定量PCR 检测,结果显示,ELISA 与荧光定量PCR 检出率基本一致, 分别为31.78%和37.38%, 表明该牧场牛群中存在一定程度的BLV感染。 目前,OIE 规定的国际动物贸易牛白血病检疫指定试验为ELISA 试验[16],ELISA 试验操作简单便捷、敏感、快速,但对于处在感染早期的动物,检测灵敏度较低, 特异性抗体的检出通常需要1个月以上[17-18],围产期母牛可将BLV 母源抗体通过初乳转移给新生犊牛[19],用血清学方法检测早期和处于围产期的BLV 感染牛易产生假阴性结果。 已知外源性BLV 感染牛后主要侵害B 淋巴细胞,以前病毒DNA 形式终生存在于宿主细胞染色体中[20-21],检测外周血淋巴细胞(PBMC)中的BLV前病毒DNA 可作为牛感染BLV 的证据。 该试验除采用ELISA 检测外,又使用荧光定量PCR 法进行了辅助确认。 一些国家也通过ELISA 试验结合荧光定量PCR 检测的措施筛查BLV 感染牛[22]。
该牧场存在一定程度的BLV 感染,可能与牧场动物之间频繁接触有直接关系, 这会导致病毒在牛群中水平传播。美国一项报告显示,有65%的BLV 感染牛呈高病毒载量, 而且高病毒载量的牛传染性高于低病毒载量牛[23]。 由于病毒载量是EBL 进展的一个重要危险因素,将感染BLV 的奶牛进行高、低病毒载量筛选,对防止病毒传播有重要意义。 该次试验中,除检测BLV 感染率外,通过计算发现,BLV 阳性牛中70%(28/40)是高病毒载量牛,30%(12/40)是低病毒载量牛,这一结果与此前日本的一项报道结果相似[24]。 澳大利亚某牧场曾将BLV 感染牛,尤其是BLV 高病毒载量牛单独饲养, 远离健康牛群从而使牧场BLV 感染率从63.8%下降到13.9%[25]。 由此可知,有效的BLV 监测、BLV 阳性牛的隔离以及良好的管理是将BLV传播风险降至最低的关键。 BLV 对畜牧行业的影响还处在研究阶段, 基于EBL 亚临床性流行的特点,EBL 的流行性调查对养殖业净化该病有着重大的意义。在今后的研究中,应扩大检测范围,明确东北地区乃至全国范围BLV 感染情况。
5 结论
通过ELISA 方法对大庆市某牧场107 头奶牛白血病病毒感染情况进行调查, 并用荧光定量PCR 法加以验证。ELISA 检测结果显示:BLV 感染阳性率为31.78%(34/107);荧光定量PCR 结果显示:BLV 感染阳性率为37.38%(40/107)。 此外,通过计算发现,BLV 高载量牛占总数的26.17%(28/107),低载量牛占总数的11.21%(12/107),说明该牛群中的BLV 可能存在较高传染性。

