血清超敏C反应蛋白与伴躯体症状抑郁症的临床相关性研究*
庄二阳 乔 娟 赵后锋 孟俊廷 耿德勤
近年来,抑郁症已经成为全球性精神问题,我国目前抑郁症患者超过2 600万人,近10%~15%的抑郁症患者最终死于自杀[1]。抑郁症(Depression)是一种常见的精神障碍,其典型症状是心境低落、兴趣下降、愉悦感丧失等,具有高患病率、高复发率、高致残性、高自杀率等特点[2]。2019年中国精神卫生调查研究报告显示,抑郁症的终身患病率为3.4%,12个月患病率为2.1%,该数据还在不断升高[3]。抑郁症逐渐成为全球卫生工作的重点之一[4]。抑郁症患者的躯体症状发生率非常高。躯体症状临床表现复杂多变,牵涉全身各部位,可模拟任何疾病,极易造成临床漏诊误诊,且半数以上患者严重程度达到中重度,在抗抑郁治疗过程中易残留,严重影响了患者的认知功能、抑郁程度及生活质量等[5]。
超敏C反应蛋白(hs-CRP)是由肝脏合成的一种全身性炎症反应急性期的非特异性标志物,相关研究显示,hs-CRP和抑郁症的发病有一定联系[6],其机制可能是血清C反应蛋白(CRP)浓度的增加可使与之相关的前炎性细胞因子水平迅速增高[7],进一步引起中枢5-羟色胺(5-HT)浓度降低、下丘脑-垂体-肾上腺轴功能异常,导致神经元死亡,快感缺失,引起抑郁发作[8]。同时,焦虑、抑郁等不良情绪会导致机体的神经内分泌功能异常,引起免疫功能紊乱,诱导机体的炎症反应,促进细胞炎症因子刺激肝脏和上皮细胞合成CRP[9~11]。
盐酸度洛西汀是一种选择性5-HT和去甲肾上腺素(NA)再摄取抑制剂。其起效迅速,尤其对伴有躯体症状的抑郁症改善具备优势,相应的临床痊愈率更高[12]。盐酸度洛西汀临床疗效好,同时不良反应症状轻,大部分患者均可耐受,便于完成长期治疗[13]。度洛西汀对血清hs-CRP水平较高的抑郁症患者可能具有更好的疗效[14],那么盐酸度洛西汀抗抑郁治疗是否对抑郁症患者的hs-CRP有一定影响?
目前国内外关于抑郁障碍患者血清hs-CRP水平的研究越来越多,但其与抑郁症躯体症状的相关性研究相对较少,并且针对抑郁症患者本身病情变化与血清hs-CRP的关系研究资料缺乏,因此本研究试图探讨血清hs-CRP与伴有躯体症状的抑郁症病情的关系,以便以后进一步研究药物治疗对血清hs-CRP的影响,为后续寻找抑郁症诊断与预后评估的生物学指标作一定铺垫。
1 对象与方法
1.1 对象 选取2018年12月~2020年11月徐州医科大学附属徐州东方医院的住院患者作为研究组。入组标准为:(1)符合国际疾病分类第10版(ICD-10)抑郁发作的诊断标准;(2)选择量表评估工具为24项汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD-24)≥20分;(3)年龄为18~60岁;(4)患者知情同意,签署同意书;(5)既往无躁狂发作者;(6)首次抑郁发作,入院前未曾抗抑郁药物治疗者;(7)无严重躯体疾病如感染性疾病、肝肾疾病以及内分泌系统疾病等。根据其症状自评量表(SCL-90)躯体化因子分是否大于2分,将研究组分为伴躯体症状组和不伴躯体症状组。排除标准:(1)患其他精神疾病者;(2)严重躯体或神经系统疾病、肝肾功能障碍者;(3)入组前3个月内使用过抗抑郁药物和其他精神药物或精神活性物质(如酒精);(4)入组前1个月内有输血史;(5)入组前6个月内接受过电休克治疗者;(6)既往曾有严重脑外伤史导致意识丧失24 h者。对照组来自于同期徐州医科大学附属徐州东方医院的健康体检者。入组标准:(1)年龄18~60岁;(2)无精神疾病史;(3)无精神类疾病家族史;(4)无重大躯体疾病包括躯体感染、肝肾功能障碍者;(5)近1个月内未服用任何药物者。本研究共纳入研究组120例,其中伴躯体症状组60例,男31例,女29例,均为汉族,年龄(37.83±9.71)岁,受教育程度为(10.02±4.14)年,病程为(5.94±2.92)个月,HAMD总分为(32.57±3.91)分;不伴躯体症状组60例,男32例,女28例,均为汉族,年龄(35.01±11.20)岁,受教育程度为(9.75±3.98)年,病程为(5.80±2.82)个月,HAMD总分为(31.58±3.32)分。共收集对照组60名,包括男29名,女31名,均为汉族,年龄(38.90±9.95)岁,受教育程度为(8.58±4.22)年。三组人群性别、年龄、受教育程度方面比较差异均无统计学意义(P>0.05)。伴躯体症状组和不伴躯体症状组病程、HAMD总分方面比较差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 研究工具 (1)采用自制的一般情况调查表,剔除不符合调查要求的病例。调查内容包括姓名、性别、年龄、住院号、受教育程度、家族史、病程时间、病前诱因;(2)采用HAMD-24进行评估,各项目采用5级评分(无、轻度、中度、重度、极重度)。总分<8分为正常;总分8~19分为可能有抑郁症;总分20~35分为肯定有抑郁症;总分>35分为严重抑郁症。以HAMD减分率来评定好转程度。HAMD评分减分率≥75%,且HAMD评分<8分为痊愈;减分率50%~74%为显著进步(减分率≥50%为显效);减分率25%~49%为好转;减分率<25%为无效。同样对对照组采用HAMD-24进行评分。显效率=(痊愈+显著进步)/总例数×100%;有效率=(痊愈+显著进步+好转)/总例数×100%。
1.2.2 治疗方法 研究组使用盐酸度洛西汀肠溶片(规格20 mg)治疗,初始剂量40 mg/d,在2周内加量至适宜剂量(60 mg/d),疗程为6周。伴躯体症状组盐酸度洛西汀用量为(56.67±7.52)mg/d,不伴躯体症状组盐酸度洛西汀用量为(58.00±6.05)mg/d,两组盐酸度洛西汀用量比较,差异无统计学意义(t=1.07,P=2.867)。不合并其他精神药物。单一用药的基础上联合使用支持性心理治疗,不采用系统性心理治疗、其他抗抑郁药、抗精神病药、抗焦虑药以及重复经颅磁刺激、无抽搐电休克治疗等物理治疗。
1.2.3 血清hs-CRP检测方法 仪器采用飞测®免疫荧光检测仪(广州万孚生物技术股份有限公司生产),试剂由广州万孚生物技术股份有限公司提供。检测方法:所有受试人员在入组后的第2天及研究组在治疗后第1、2、4、6周末的晨间06∶00~08∶00检测,要求患者空腹8 h以上,采用真空采血管抽取5 ml肘静脉血,分离血清,并且置于-70℃冰箱中保存。采用速率散射比浊法,测定按照飞测免疫荧光检测仪的标准操作规程进行。分析指标:空腹hs-CRP,正常参考值为0~5 mg/L。
1.2.4 统计学方法 应用SPSS 21.0进行统计分析处理。计数资料的比较采用χ2检验;计量资料的比较采用单因素方差分析和t检验。采用Pearson相关分析对HAMD总分及各因子分和hs-CRP水平进行相关分析。检验标准α=0.05。
2 结果
2.1 伴躯体症状组、不伴躯体症状组、对照组治疗前后血清hs-CRP水平比较 伴躯体症状组和不伴躯体症状组治疗后第1、2、4、6周末的hs-CRP水平均较治疗前降低(P<0.05)。伴躯体症状组、不伴躯体症状组的hs-CRP均随治疗时间延长逐渐下降。三组治疗前及治疗后第1、2、4、6周末hs-CRP水平比较差异均有统计学意义(P<0.01)。进一步两两比较结果显示,伴躯体症状组治疗前及治疗后第1、2、4、6周末血清hs-CRP水平均高于不伴躯体症状组和对照组(P<0.05),不伴躯体症状组治疗前及治疗后第1、2、4周末血清hs-CRP水平均高于对照组(P<0.05)。见表1。

表1 伴躯体症状组、不伴躯体症状组、对照组治疗前后血清hs-CRP水平比较
2.2 伴躯体症状组、不伴躯体症状组治疗前后HAMD评分比较 伴躯体症状组治疗后第1、2、4、6周末HAMD评分均较治疗前降低(P<0.05),不伴躯体症状组治疗后第1、2、4、6周末HAMD评分均较治疗前降低(P<0.05),伴躯体症状组、不伴躯体症状组的HAMD评分随治疗时间延长均逐渐下降。见表2。

表2 伴躯体症状组、不伴躯体症状组治疗前后HAMD评分比较
2.3 伴躯体症状组治疗前血清hs-CRP水平与HAMD评分相关分析 经Pearson相关分析显示,伴躯体症状组血清hs-CRP水平与HAMD总分及躯体症状因子总分、睡眠障碍、胃肠道症状、全身症状因子分均呈正相关(P<0.05)。见表3。
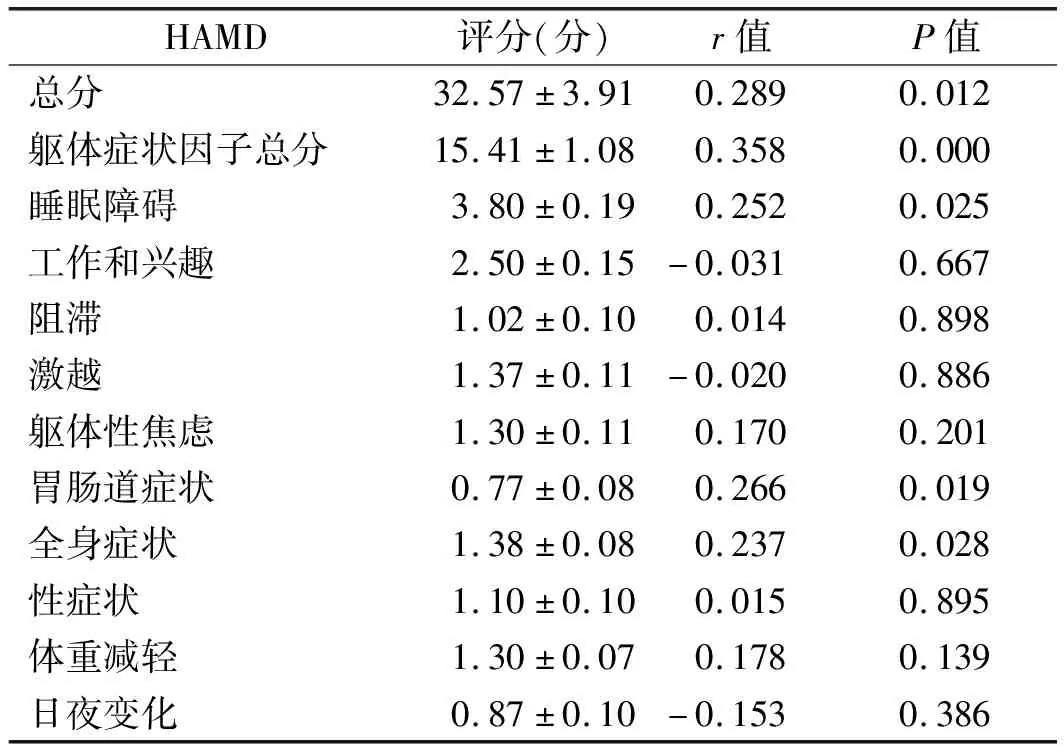
表3 伴躯体症状组治疗前血清hs-CRP水平与HAMD评分相关分析
2.4 伴躯体症状组治疗前后血清hs-CRP水平与HAMD评分相关分析 Pearson相关分析显示,伴躯体症状组治疗前及治疗后第1、2、4、6周末血清hs-CRP水平与HAMD评分均呈正相关(P<0.05)。见表4。
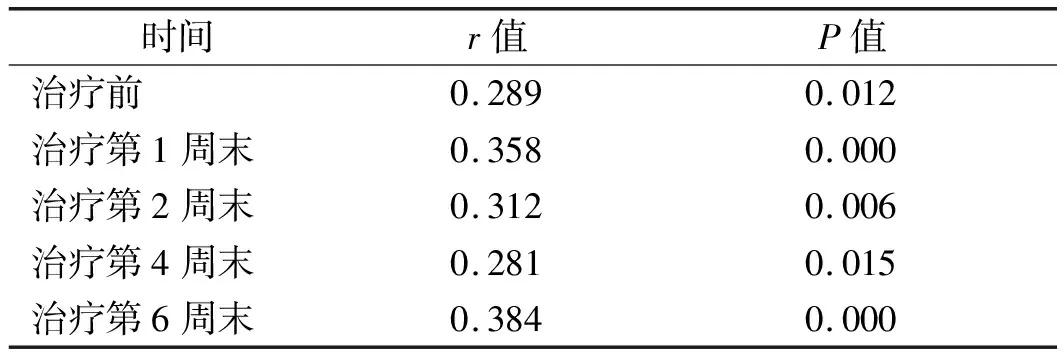
表4 伴躯体症状组治疗前后血清hs-CRP水平与HAMD评分相关分析
3 讨论
抑郁症属于慢性复发性精神疾病,对患者家庭和社会造成沉重的负担[15]。抑郁症的炎症假说近年来逐渐成为研究热点,提示抑郁症与免疫炎症之间存在一定的关系[16, 17]。抑郁症患者通常伴有免疫失调,其脑脊液、外周血中炎症因子水平发生了明显变化[18],促炎细胞因子增多,导致抑郁相关的脑功能异常[19]。
本研究发现,与健康对照相比,抑郁症患者血清hs-CRP水平提高,可能是因为抑郁情绪对于免疫系统有一定抑制作用[20],免疫系统功能紊乱导致细胞因子调节炎性淋巴因子刺激肝脏和上皮细胞合成CRP,从而使血清中CRP水平含量增加[21]。国外学者对人口中抑郁/焦虑障碍症状与血清hs-CRP和炎症相关条件之间的关系进行性别分层检查发现,抑郁症和焦虑症与hs-CRP水平升高有关[22]。国内外诸多研究结果与本研究结果一致,提示血清hs-CRP水平可能与抑郁症严重程度相关[23,24]。一项对老年抑郁症患者的研究表明,老年抑郁症患者存在5-HT、NA、DA代谢异常,机体存在炎症反应状态,5-HT、NA、DA浓度、炎症因子水平与患者抑郁严重程度有着密切的联系[25]。同样,徐静等[26]研究表明,CRP与HAMD评分呈正相关,CRP可以为判断抑郁症病情严重程度作参考。
躯体症状在抑郁障碍中很常见,抑郁严重程度和躯体症状严重程度相关[27]。本研究表明,伴有躯体症状的抑郁症患者血清hs-CRP水平比不伴有躯体症状的抑郁症患者高,而伴有躯体症状的抑郁症患者血清hs-CRP水平与HAMD总分及躯体症状、睡眠障碍、胃肠道症状、全身症状因子分均呈正相关。同样,陆玲娜等[28]研究表明,CRP水平与抑郁症症状中的躯体化症状也存在相关性。提示血清hs-CRP水平可以反映抑郁症患者特别是其躯体症状的病情。躯体症状与细胞因子系统也有一定联系,可能是由于炎症的通路产生一些情绪症状,以及疲倦无力、疼痛感增强、自主神经功能紊乱等躯体症状[29]。抑郁症患者中促炎细胞因子的升高和抑制上行感觉的下行5-HT能和DA能通路的功能障碍,可能会导致躯体疼痛等症状[30]。
经过盐酸度洛西汀治疗后,研究组血清hs-CRP水平和HAMD评分均逐步降低,并且两者仍相关,提示盐酸度洛西汀可能是抑郁症患者的血清hs-CRP水平降低的因素,其抑制NA和5-HT的再摄取,从而缓解抑郁症患者的病情,其中包括躯体症状。这与国内外现有研究[31, 32]结果相一致。盐酸度洛西汀对体内呈较高水平hs-CRP的抑郁症患者可能治疗效果更好,但仍需要进一步扩大样本量进行相关验证性研究[33]。而王丹等[14]研究抑郁症患者血清hs-CRP水平在治疗前后的变化发现,炎症反应参与了抑郁症的病理机制,血清hs-CRP的水平高低与抑郁症状的严重程度相一致,hs-CRP可能是发生抑郁障碍的危险因素之一,hs-CRP的下降可能与抑郁症状的减轻有关,度洛西汀对血清hs-CRP水平较高的抑郁症患者可能具有更好的疗效。
综上所述,本研究探讨了血清hs-CRP与伴有躯体症状的抑郁症病情的关系,为后续研究药物治疗对血清hs-CRP的影响做铺垫,可作为试图寻找抑郁症诊断与预后的生物学指标的前期研究之一。本研究提示血清hs-CRP水平与抑郁症患者的躯体症状相关,血清hs-CRP水平可能在一定程度上反映抑郁严重程度,特别是躯体症状的严重程度。而盐酸度洛西汀抗抑郁治疗可以降低抑郁症患者血清hs-CRP水平,改善其躯体症状,从而缓解病情。血清hs-CRP水平在一定意义上可作为疗效评判的生物学指标和理论依据。但本研究也有一些不足,本研究发现度洛西汀抗抑郁治疗可能是降低血清hs-CRP水平的影响因素,但hs-CRP是血管炎症的生物标志物,而血管炎症的治疗有望预防或减轻抑郁症的症状[34]。抗炎治疗对于伴躯体症状抑郁症患者的症状的改善需要未来进一步探讨。此外,对于具体的hs-CRP与抑郁症相关机制及盐酸度洛西汀作用机制,仍需后续的进一步研究。

