基于网络药理学的麻黄汤治疗新型冠状病毒肺炎潜在机制研究
龙慎豪,胡 卫,张 炜
(1.三峡大学,湖北 宜昌 443000;2.宜昌市中医医院,湖北 宜昌 443000)
新型冠状病毒肺炎(Corona virus disease 2019,COVID-19,以下简称“新冠肺炎”)给人民健康及社会稳定均带来了巨大的负面冲击。急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是此次新冠肺炎患者的主要危重并发症之一[1],有研究发现重症患者中年龄较大者有更多的潜在患病风险,从发病至发展为ARDS的时间为8.0天[2]。根据国家卫生健康委发布的新型冠状病毒肺炎诊疗方案(试行第八版)的通知[3],本病以发热、乏力、干咳为主要临床表现;少数患者伴有鼻塞、流涕、咽痛和腹泻等症状;重型患者多在发病1周后出现呼吸困难和(或)低氧血症,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍等。因此,能否针对ARDS形成快速有效治疗,决定着是否能有效截断病程,进而起到降低新冠肺炎患者死亡率的作用。
中医药在此次治疗新冠肺炎方面显示出了确切疗效,不但能改善普通患者临床症状、 缩短病程,还能防止重症、危重症患者的病情恶化[4]。从2020年2月6日起,国家中医药管理局和国家卫生健康委联合发文推荐全国各地使用清肺排毒汤治疗新冠肺炎[5]。从使用效果来看,清肺排毒汤对治疗新冠肺炎具有良好的临床疗效和救治前景,最大程度提高了治愈率、降低了病死率[6]。有研究指出清肺排毒汤的起效关键在于有效地针对了此次疫情属于“寒湿疫”的特性,尤其是本方中用到了麻黄汤来宣散透邪化饮[7]。麻黄汤出自汉代张仲景所著《伤寒杂病论》,由麻黄、桂枝、杏仁、甘草4味中药组成。麻黄汤为治疗外感风寒表实证的主要方剂,具有解表散寒、宣肺平喘、利水消肿等功效。
网络药理学能从生物网络平衡的角度阐释疾病的发生发展过程,从改善或恢复生物网络平衡的整体观角度认识药物与机体的相互作用并指导新药发现。网络药理学通过对网络的分析来阐明中药复方多成分、多靶点的药物协同作用机制,能为系统地理解中药与疾病之间复杂关系提供依据[8]。本研究中,我们采用网络药理学和生物信息学方法探讨麻黄汤作用于COVID-19的潜在机制。
1 方法
1.1 麻黄汤中活性成分收集与筛选
采用数据库TCMSP(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)[9]和TCM-ID(http://www.megabionet.org/tcmid/)[10],分别以4味药的拼音名“mahuang”“guizhi”“xingren”“gancao”为关键词检索得到麻黄汤中含有的化合物成分。通过TCMSP平台过滤器自定义筛选结果,选择活性化合物的筛选条件:口服生物利用度(OB)≥30%、类药性(DL)≥0.18。筛选出麻黄汤中各味中药的活性成分后,分别通过各成分的Pub Chem CId号在数据库Pub Chem(https://pubchem.ncbi.nlm.nih.gov/search/)[11]中搜索得到各自对应的规范SMILES结构。
1.2 活性成分的潜在靶点预测
将各活性成分分子的规范SMILES结构输入到数据库Swiss target prediction (http://www.swisstargetprediction.ch/)[12]中进行反向分子对接来预测靶点,选择物种为“Homo sapiens”,只保留可能性大于0的靶点。最后,预测得到的所有靶点均采用Uniprot(https://www.uniprot.org/)[13]数据库进行基因名称校正。
1.3 ARDS的已知治疗靶点收集与筛选
疾病的已知治疗靶点来自于CTD(http://ctdbase.org/)[14]数据库,输入关键词“ARDS”“acute respiratory distress syndrome”,得到与 ARDS相关的基因靶点,以CTD数据库的推断分数(Inference Score≥30) 作为筛选条件,筛选结果作为疾病的候选靶点。然后再利用Uniprot数据库对所得疾病靶点进行基因名称校正。
1.4 网络构建
在上述预测靶点与疾病的已知治疗靶点相互映射取交集后,将交集靶点投入到蛋白质相互作用分析平台STRING(https://string-db.org/),种属选择“Homo sapiens”,获取靶蛋白之间的相互作用关系,并将筛选条件设置为最高可信度“highest confidence(≥0.7)”,其余参数默认。剔除掉游离于网络的靶点后,剩下的即为网络核心靶点。再采用Cytoscape 3.7.1(http://www.cytoscape.org/)[15]软件来构建药物-靶点-疾病复合网络,对上述数据进行可视化分析。
1.5 候选靶点基因功能和通路富集分析
为了更好地说明上述所得到的网络核心靶点的生物学过程(biological process)及其所涉及的信号通路情况,我们采用CTD(http://ctdbase.org/)数据库对这些靶点进行了GO富集分析及KEGG 富集分析,以错误发现率(FDR)≤0.05为筛选条件,并按照FDR值由小到大顺序排列。
2 结果
2.1 麻黄汤活性成分筛选结果
通过检索TCMAP和TCM-ID数据库共得到976个化合物,其中符合筛选条件OB≥30%、DL≥0.18,且能以其SMILES结构预测靶点的化合物共有91个。在剔除掉重复项后,剩下78个唯一化合物成分,其中18个来自麻黄,7个来自桂枝,17个来自杏仁,49个来自甘草。麻黄汤中活性成分信息见表1。

表 1 麻黄汤中活性化合物
2.2 候选靶点筛选结果
先通过Swiss Target Prediction数据库,利用上述活性成分的SMILES结构进行反向分子对接,剔除掉可能性为零的靶点及重复项后,共得到733个预测靶点。再通过检索CTD数据库,剔除掉重复项后,剩下2 837个疾病已知治疗靶点。其中,复合CTD数据库推断分数(Inference Score≥30)筛选条件的靶点有102个。然后,将预测靶点和疾病已知治疗靶点相互映射后,再将交集部分导入STRING数据库,保留最高可信度“highest confidence(≥0.7)”的部分,得到24个候选靶点。候选靶点的基本信息见表2。

表2 麻黄汤靶点的基本信息
2.3 构建药物-靶点-疾病网络
以麻黄汤、药物、24个潜在靶标及疾病ARDS作为节点,用Excel文件格式分别定义各节点及各连线的属性和关系,通过Cytoscape 3.7.1 软件进行数据编排和图形处理,得到麻黄汤-药物-靶标-疾病(ARDS)网络,见图1。该复合网络共包含30个节点和86条边,三角形节点代表方剂麻黄汤,菱形节点代表药物,圆形节点代表药物所作用的靶点,V形节点则代表疾病。其中,根据化合物所作用靶点的次数由小到大,圆形节点的颜色由浅到深渐变。
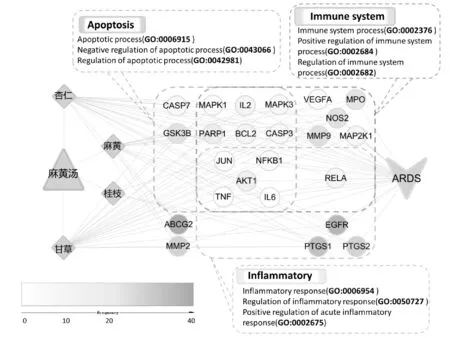
图1 麻黄汤药物-靶点-疾病网络
2.4 候选靶点富集分析结果
通过CTD数据库对24个候选靶点进行GO富集分析(FDR≤0.05),得到GO(biological process)条目809条,其中靶基因主要参与氧化应激反应、细胞对细胞因子刺激的反应、细胞对化合物刺激的反应、细胞因子介导的信号通路、细胞凋亡过程、免疫系统进程、炎症反应等生物学过程,见图2。

图2 麻黄汤作用靶点 GO (biological process)功能分析
此外,根据通路注释分析(FDR≤0.05)结果,共得到信号通路249条。通过分析发现,候选靶点主要富集在免疫系统、TNF信号通路、PI3K-Akt信号通路、MAPK信号通路、NF-kappa B信号通路,与细胞凋亡、流行性感冒、基因转录、炎性小体等有密切联系,见图3。
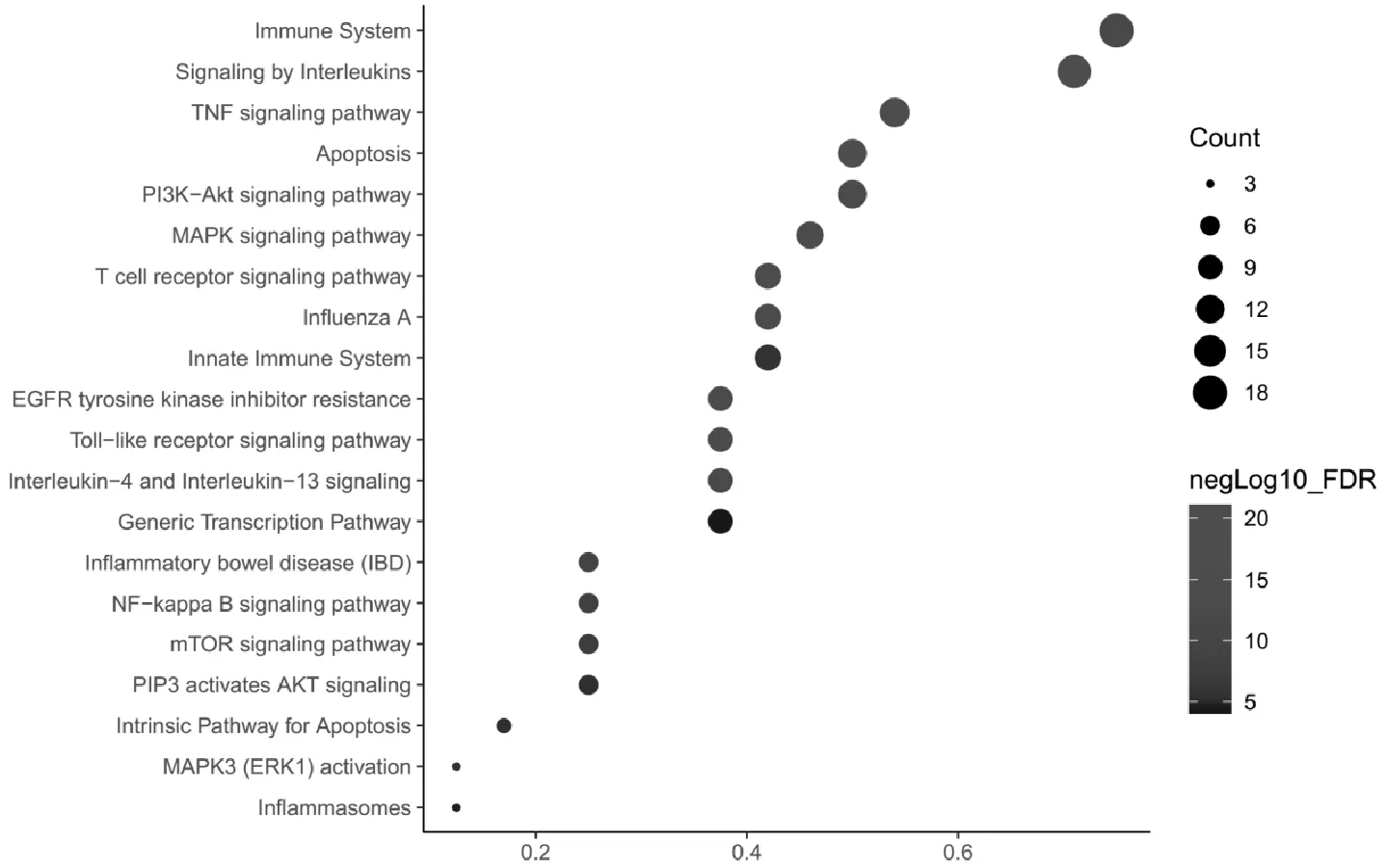
图3 麻黄汤作用靶点信号通路富集分析气泡图
3 讨论
本研究中,我们采用网络药理学和生物信息学方法来探究麻黄汤防治COVID-19的潜在机制。通过对现有数据库的检索和筛选,一共鉴定出了78种符合筛选标准的生物活性成分,其中有一些活性成分为多种中药所共有。例如β-谷甾醇(Beta-sitosterol)同属于麻黄和桂枝;谷甾醇(Sitosterol)同属于桂枝、杏仁和甘草;豆甾醇(Stigmasterol)同属于麻黄和杏仁;山柰酚(Kaempferol)、槲皮素(Quercetin)、柚皮素(Naringetol)同属于麻黄和甘草;甘草黄酮(Glabridin)、丁子香萜(Mairin)、甘草甙(Liquiritin)则同属于杏仁和甘草等。在这78种活性成分中,有一些成分已经被研究报道过对ARDS有治疗作用,例如山柰酚(Kaempferol)被发现能够抑制核转录因子-κB(NF-kappa B)的活化从而降低促炎症反应来实现治疗ARDS的目的[16];此外,甘草黄酮(Glabridin)被证实可以抑制炎症反应,并通过抑制MAPK和ERK信号通路的活化来发挥对ARDS的治疗作用[17];一项研究表明槲皮素(Quercetin)对脂多糖诱导的肺部炎症具有预防作用[18];另一项研究则证实香木叶素(Diosmetin)能在一定程度上限制氧化损伤,以及限制炎症细胞的积累和促炎细胞因子的分泌[19]。基于上述已被研究报道的事实,我们推测麻黄汤是通过其中多种活性成分协同发挥作用来治疗ARDS的。
结合我们所构建的药物-靶点-疾病网络和蛋白质相互作用网络分析发现,麻黄汤中的众多活性成分可能是通过作用于EGFR、PTGS1、MMP2、PTGS2、MMP9、NOS2、AKT1、IL2、TNF和IL6等靶点,整体实现对ARDS的治疗作用。其中,有一些靶点出现的频次比较高,如EGFR为36种活性成分所共有,其频次为36;PTGS1频次为33;MMP2和PTGS2的频次同为28等,详见表1、图1。这种现象表明麻黄汤中的多种活性成分,通过选择性靶向多种蛋白,从而实现对ARDS更全面、更广泛的治疗效果。
一项临床研究表明,COVID-19患者从入院发展至ARDS的最短时间为2天,需要经ICU和吸氧治疗,且患者体内细胞因子风暴与疾病严重程度相关[20]。目前,ARDS的具体发病机制仍然模糊,但越来越多研究倾向于认同是由多种相关靶蛋白,以及这些蛋白参与的多种信号通路来共同主导调节的急性肺损伤的炎症反应过程。ARDS的诱发因素之一为病毒引起的流行性感冒,在感染后期,病毒往往会引起肺组织上皮细胞凋亡和坏死[21-22]。从我们构建的网络预测结果来看,麻黄汤主要是通过靶向IL2、IL6、AKT1、BCL2、GSK3B、MAPK1、CASP3和TNF等蛋白来干预和调节细胞的凋亡过程。有研究表明肺动脉内皮细胞产生细胞因子如IL6、TNF等会在肺部感染期间响应病毒而招募白细胞加重炎症损伤[23]。从网络图中还可以看到,麻黄汤能通过作用于PTGS1、PTGS2、EGFR、AKT1、IL6、RELA等靶点来调控炎症反应,还能通过作用于NOS2、MMP2、MMP9、MPO、IL2、IL6、AKT1、BCL2等来调控免疫系统进程。有研究表明,免疫细胞所分泌的细胞因子如白细胞介素、肿瘤坏死因子、趋化因子、干扰素等均参与到了ARDS的疾病进程。当有外界病原体入侵并作用于免疫细胞时,会促使免疫细胞分泌更多细胞因子,用于招募和激活更多的免疫细胞,促进形成免疫系统的正反馈。然而,当免疫系统被过度激活时,大量细胞因子会蓄积,以细胞因子风暴的形式爆发,并最终损伤机体重要器官的正常细胞,导致多器官功能衰竭[24],这说明炎症反应与免疫系统均与ARDS相关。有报道指出ARDS可加快机体分解代谢,从而消耗过多的能量引起机体营养不良,导致免疫功能出现损伤,而中药能有效提高ARDS的免疫功能[25]。此外,研究表明中药还可以通过调节炎性介质、抗氧化作用、调节基质金属蛋白酶、保护内皮功能等多种方式来治疗ARDS[26]。肺泡上皮和内皮毛细血管膜的炎症损伤是ARDS的一个中心事件,涉及MMP2、MMP9等靶点参与调控基底膜的降解过程[27]。
从通路富集分析结果可知,麻黄汤在发挥过程中主要涉及到的通路有:TNF 信号通路、PI3K-Akt 信号通路、MAPK 信号通路、Toll-like 受体信号通路、NF-kappa B 信号通路等,见图3。研究发现ARDS时可激活PI3K-Akt 信号通路的细胞凋亡信号分子和凋亡相关的蛋白调节肺组织上皮细胞凋亡,从而显著增加肺水肿和肺组织损伤面积[28]。同样,也有研究表明脂多糖能通过MAPK和ERK通路诱导肺成纤维细胞核小鼠肺组织的炎症反应[29,30]。此外,还有报道指出Toll-like 受体是一种可调节病原体识别并激活先天免疫,同时激活并放大多种组织的炎症反应的模式识别抗体,出现肺损伤时Toll-like 受体信号通路中的相关分子,如 NF-κB 可明显激活,从而增加体内外炎性细胞因子水平[31]。基于上述文献研究以及我们对复合网络靶点及通路的分析结果,我们推测麻黄汤主要是通过靶向多个靶点来调节免疫功能、抑制炎症反应和调控内皮细胞凋亡过程等来截断ARDS病程,从而最终达到治疗COVID-19的目的。

