表面增强拉曼光谱法对抗肿瘤药物6-巯基嘌呤的检测研究
秦 苗,王红艳,王 聪,马尚尚,邓文静
宿州学院化学化工学院,安徽宿州,234000
癌症是威胁人类健康的头号杀手。为了更好地治疗癌症患者,需要更精确地使用药物以达到最佳的治疗效果。6-巯基嘌呤(6-MP)是一类嘌呤类抗癌药物,在体内被黄嘌呤核苷酸焦磷酸酶转化为活性硫代次黄嘌呤核苷酸和硫代嗜酸性粒细胞酸,从而阻断DNA和RNA的合成,主要用于治疗急性白血病、慢性粒细胞性白血病、绒毛膜癌、恶性淋巴瘤和多发性骨髓瘤[1]。在临床治疗中,6-MP在用药剂量上如果浓度过低,会降低其抗免疫和抗炎作用,从而不能达到效果;如果浓度过高,会对骨髓、肝脏等器官造成副作用[2]。因此,快速准确地检测6-MP的浓度在临床用药方面具有一定指导作用。
6-MP可以通过质谱法、高效液相色谱法、分光光度法等方法检测[3-4],但这些方法通常需要较长的时间,设备操作也相当复杂,因此有必要开发一种灵敏、简便、快速的检测方法检测6-MP。表面增强拉曼光谱(SERS)自发现以来引起了人们的广泛关注,它具有操作简单、测量速度快等优点,已广泛应用于环境、生物、化学等领域[5-10]。SERS特别适合在水溶液中进行检测,而6-MP常存在于人体体液当中,因此使用SERS技术检测6-MP具有更大的优势。
本研究中,拟使用聚乙烯吡咯烷酮金纳米粒子(PVP-Au NPs)作为SERS基底快速检测抗肿瘤药物6-MP。采用种子生长法合成形貌均一的聚乙烯吡咯烷酮(PVP)-金纳米粒子,使用紫外-可见光谱法(UV-vis)和扫描电子显微镜(SEM)对PVP-Au NPs进行表征。结合拉曼光谱仪以结晶紫(CV)为探针表征PVP-Au NPs作为SERS基底的灵敏度和重现性。使用该SERS基底对6-MP 标准样品进行检测,进一步采用标准加入法实现了6-MP在模拟尿液中的检出。该方法可为6-MP在临床医学上的灵敏性检测提供新的方向。
1 实验部分
1.1 实验试剂
6-巯基嘌呤(6-MP)(化学结构式如图1)购于北京索莱宝科技有限公司。柠檬酸钠(Na3C6H5O7·2H2O)、氯金酸、盐酸羟胺购于上海国药试剂有限公司。结晶紫(CV)购于阿拉丁试剂有限公司。所有化学品均为分析级,在使用之前无需进一步处理,所有实验涉及的溶液均使用 Milli-Q系统制备的蒸馏水(>18.0 MΩcm)配制。
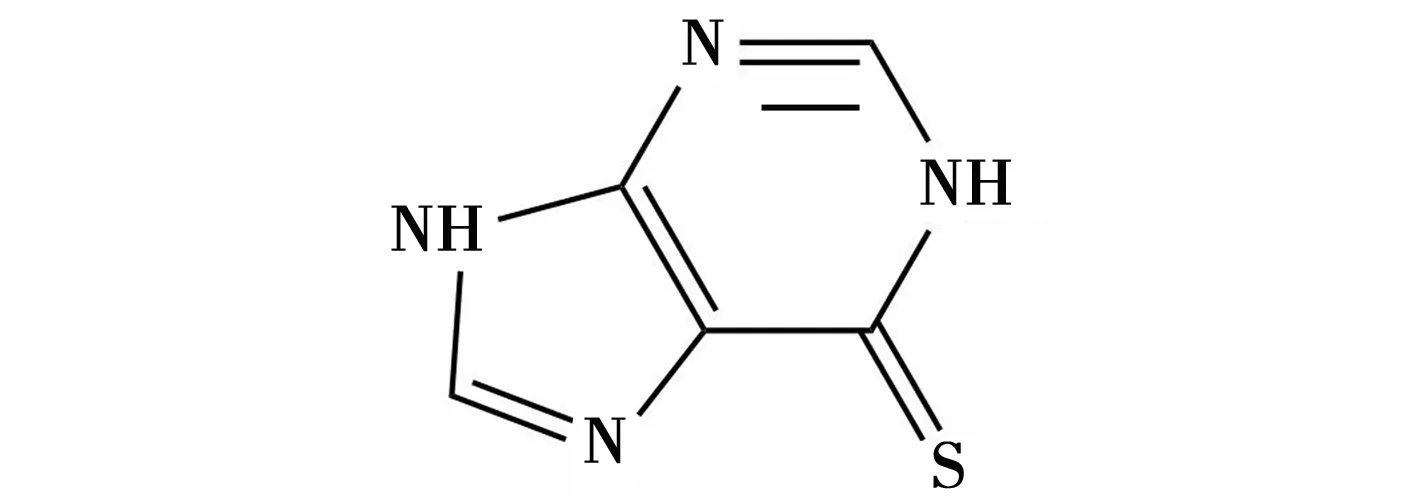
图1 6-巯基嘌呤的化学结构式
1.2 PVP-NPs金纳米颗粒的合成[11-12]
使用柠檬酸钠还原法合成Au NPs,在250 mL三颈烧瓶中加入99 mL超纯水和1 mL HAuCl4溶液(质量分数为1%)溶液,搅拌加热。待溶液沸腾,迅速向其加入4 mL柠檬酸钠(质量分数为1%)溶液,继续加热搅拌到溶液变为酒红色。向100 mL的三口烧瓶中加入上述种子溶液25 mL,然后顺序加入1 mL柠檬酸钠(质量分数1%),1 mL PVP溶液(质量分数1%)和20 mL盐酸羟胺(2.5 mM),室温搅拌。同时以速度1 mL/min使用注射泵滴加20 mL(2.5 mM)氯金酸溶液,待氯金酸溶液滴完后,继续搅拌30 min。即可得到粒径分布在50~60 nm的PVP-Au NPs。
1.3 尿液前处理流程
取出0.5 mL尿液,置于1.5 mL离心管中。称取120 mg氯化钠置于盛有尿液的离心管中溶解,离心10分钟(转速8 000 r/min),取上清液备用。将10 μL 0.1 M 6-MP 溶液加入到90 μL 处理后的尿液中混合均匀,得到尿液中6-MP 浓度为1.0 × 10-2M。按照上述方法,配制得到尿液中 6-MP 溶液浓度分别为1.0 × 10-3M、1.0 × 10-4M和1.0 × 10-5M。
1.4 实验仪器
使用场发射电子显微镜(SEM,FEI Sirion-200)观察PVP-Au NPs的形态结构。在 LabRAM H800共焦拉曼显微镜(Horiba jopin Yvon)上采集拉曼光谱,激光波长785 nm,积分时间1 s。PVP-Au NPs溶胶的紫外-可见吸收光谱使用UV-2550紫外-可见光谱光谱仪(岛津,日本)记录。
2 实验结果与分析
2.1 PVP-Au NPs的表征
PVP稳定的金纳米粒子(PVP-Au NPs)是由种子生长法制备。图2A是Cit-Au NPs通过配体交换制备出PVP-Au NPs的示意图。在生长过程中,PVP分子不完全取代金纳米粒子表面的柠檬酸根[13]。其中柠檬酸跟带负电荷,而PVP是一种呈电中性非离子表面活性剂。对两种金纳米颗粒的Zeta电势进行了检测,如图2B可知,PVP-Au NPs的Zeta电位由-68.2 mV增加到-21.5 mV,金纳米颗粒表面含PVP大大降低了Au NPs的电负性,进一步说明金纳米粒子在生长过程中PVP不完全取代柠檬酸根。图2C中a和b分别是Cit-Au NPs溶胶和PVP-Au NPs溶胶的光学图片,图2D是两种金纳米颗粒溶胶的紫外-可见吸收光谱图,PVP-Au NPs在543 nm处有最大吸收,相比Cit-Au NPs溶胶红移了约22 nm,表明两者的粒径发生了一定改变,为进一步确定颗粒粒径变化进行了SEM实验。
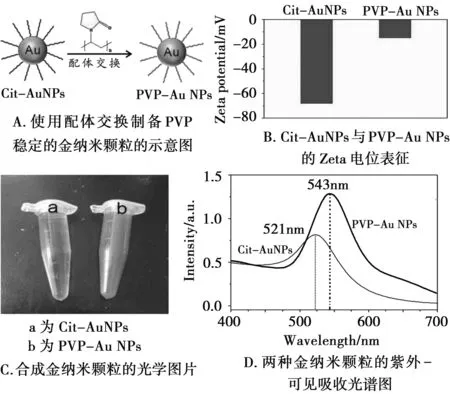
图2 PVP稳定的金纳米粒子制备
PVP-Au NPs通过一种简单的自组装方法,即在溶剂挥发作用下形成一个大面积均匀排列的纳米结构。图3A为PVP-Au NPs阵列的制备过程。其中溶剂挥发自组装由两阶段组成:晶体生长与核的形成。使纳米颗粒有序排列的关键因素是对流粒子通量和具有吸引力的毛细力[14]。与此同时,溶剂的蒸发速率也影响粒子的有序排列,而PVP是一种表面活性物质,能显著降低水的表面张力,从而降低水的蒸发速率[15],有利于形成大面积稳定的单层均匀分布结构。此外,PVP的立体特性造成空间位阻使临近的纳米粒子之间具有硬球的相互作用[16],有助于形成高度均匀的阵列。因此,以上PVP的特性可以通过两步法及加样速率的控制,得到大面积均匀分布的Au NPs(图3B,3C)。通过三次随机统计可知,制备得到的PVP-Au NPs的尺寸集中在40~58 nm,平均粒径为48.8 nm,颗粒间距主要分布在2~4 nm。间隙小于10 nm的相邻纳米颗粒之间会产生耦合场,粒子间隙在2~4 nm时能够产生强烈的表面等离振子共振(SPR),可以达到很大的SERS增强效应[17-18]。

图3 PVP-Au NPs阵列制备过程
2.2 PVP-Au NPs作为SERS基底的灵敏性及重现性的检测
为了评价PVP-Au NPs作为SERS基底的灵敏性,以结晶紫(CV)为探针进行SERS检测。将浓度分别为10-5M、10-6M、10-7M的CV溶液标准样品与2 μL的PVP-Au NPs溶胶按1∶1比例均匀混合,滴在干净的硅片上。样品经自然风干后,用拉曼光谱仪进行检测。由图4可知,CV分子的拉曼指纹峰分别出现在1 619 cm-1、1 372 cm-1和1 171 cm-1处。该SERS基底对CV的检出限为10-7M,表明灵敏性较好,可以用作检测6-MP的SERS基底。
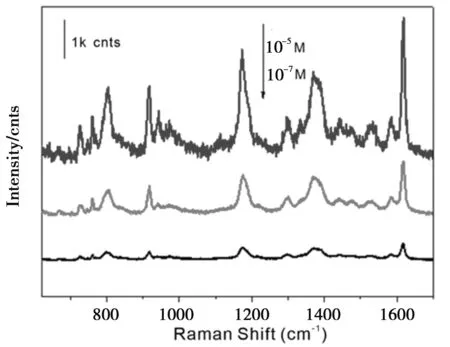
图4 不同浓度CV分子的SERS谱图
图5A为随机采集10-6M CV 30个点的3D SERS谱图,实验结果表明其30个点的SERS峰强及其峰位未发生明显变化,证明基底具有较好的稳定性。图5B为10-6M CV的30个点对应于1 372 cm-1指纹峰的相对标准偏差(RSDs),计算得到RSD为10.33%,小于20%,说明PVP-Au NPs 基底具有较好的重现性。

图5 对10-6 M CV分子的重现性检测谱图
2.3 抗肿瘤药物6-MP标准品的检测
为了确定6-MP拉曼峰归属,采集了6-MP固体粉末的拉曼光谱,如图6所示,拉曼位移436 cm-1归属C6-S伸缩振动,863 cm-1归属C-S-H变形振动,1 001 cm-1归属面内变形振动,1 140 cm-1峰归属CS-N7的伸缩振动,1 283 cm-1归属N1-C6的伸缩振动,1 330 cm-1归属为C4-N9的伸缩振动,1 399 cm-1峰归属N7-C8的伸缩振动,并可与文献对应[10,19]。

图6 6-MP标准品的固体拉曼峰和SERS谱图、PVP-Au NPs的基底峰
2.4 不同pH条件下6-MP的SERS检测
溶液pH对6-MP与PVP-Au NPs的相互作用具有重要影响。6-MP分子能否吸附在金纳米粒子表面与PVP分子电荷分布及电负性息息相关,溶液pH影响6-MP与金纳米颗粒表面的静电作用。实验中配制浓度为5×10-5M的6-MP溶液,调节其pH为2、5、8、10,分别进行SERS检测,由图7所示,当溶液pH为2、5、10时,6-MP的SERS信号很弱,而当pH=8时出现了明显的6-MP的特征峰,这是因为在pH为2、5时,6-MP分子溶解性很差,难以吸附在带负电荷的PVP-Au NPs表面,因此基本检测不出6-MP的SERS信号。而在pH为8时,6-MP分子上的氨基可以发生水解表面带正电荷,与表面带负电荷的PVP-Au NPs发生静电相互作用,6-MP吸附在纳米颗粒表面,因此可以被检测出来。当pH为10时,溶液碱性较大,6-MP分子结构不稳定,影响6-MP的检出。因此接下来的实验溶液pH均为8作为检测条件。

图7 浓度为5×10-5 M的6-MP在不同pH条件下的SERS图谱
2.5 不同浓度6-MP标准溶液的检测
图8是在pH为8时,10-2M-10-6M 6-MP标准溶液的SERS检测,430、856、997、1 136和1 281 cm-1的光谱带为6-MP的SERS指纹峰。6-MP的SERS峰与固体拉曼峰略有几个波数的偏移,这可能是目标物分子在金纳米颗粒表面吸附造成的。由图8可知,随着6-MP浓度不断降低,SERS信号强度不断降低,结果表明6-MP检出限可达10-5M。PVP-Au NPs作为SERS基底可以较为灵敏地检测6-MP。
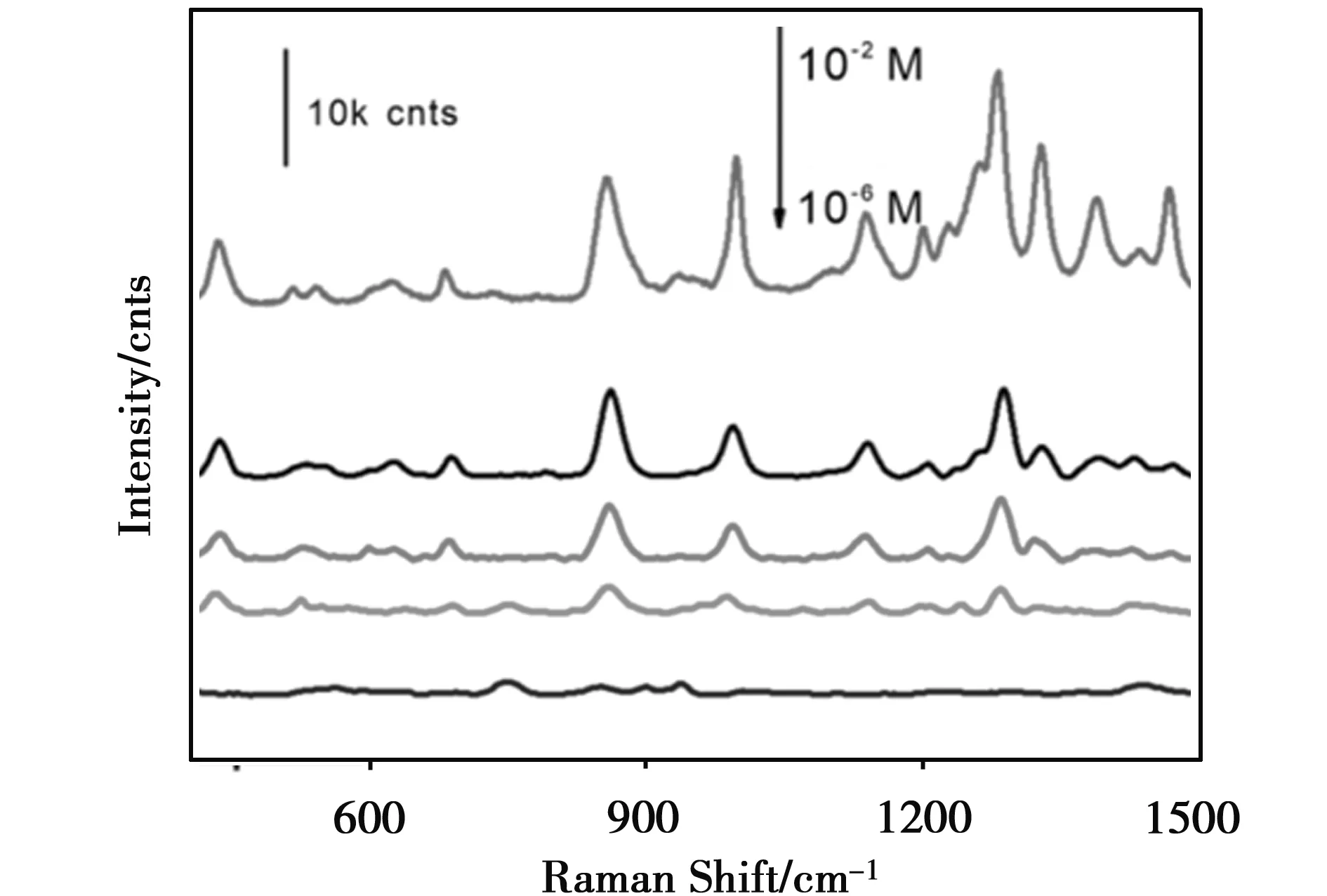
图8 10-2 M-10-6 M浓度的6-MP的SERS图谱
2.6 尿液中6-MP的SERS检测
尿液由于取样方便、包含丰富代谢物信息常作为生物检材用于检测分析。但尿液成分复杂,尿液中除了水之外还包含无机盐、尿素蛋白和葡萄糖等。如图9所示,对未处理的尿液进行直接检测,尿液中主要是尿素的SERS峰,出现在1 002 cm-1处。通过向尿液中加入氯化钠,可以有效沉降尿素等物质,处理后的尿液SERS谱图中干扰信号显著减少。图10是处理后尿液中的6-MP的检测,在855 cm-1处观察到明显的指纹峰,为6-MP的特征峰。由图10的拉曼光谱图可以发现,6-MP在尿液中浓度为10-2M时可以得到很强的SERS峰,随着6-MP浓度的减小,SERS强度也不断减弱。当添加浓度为10-5M时,基本上无法检测到SERS信号,因此在尿液中6-MP的检出限为10-4M。

图9 尿液处理前后的SERS谱图对比
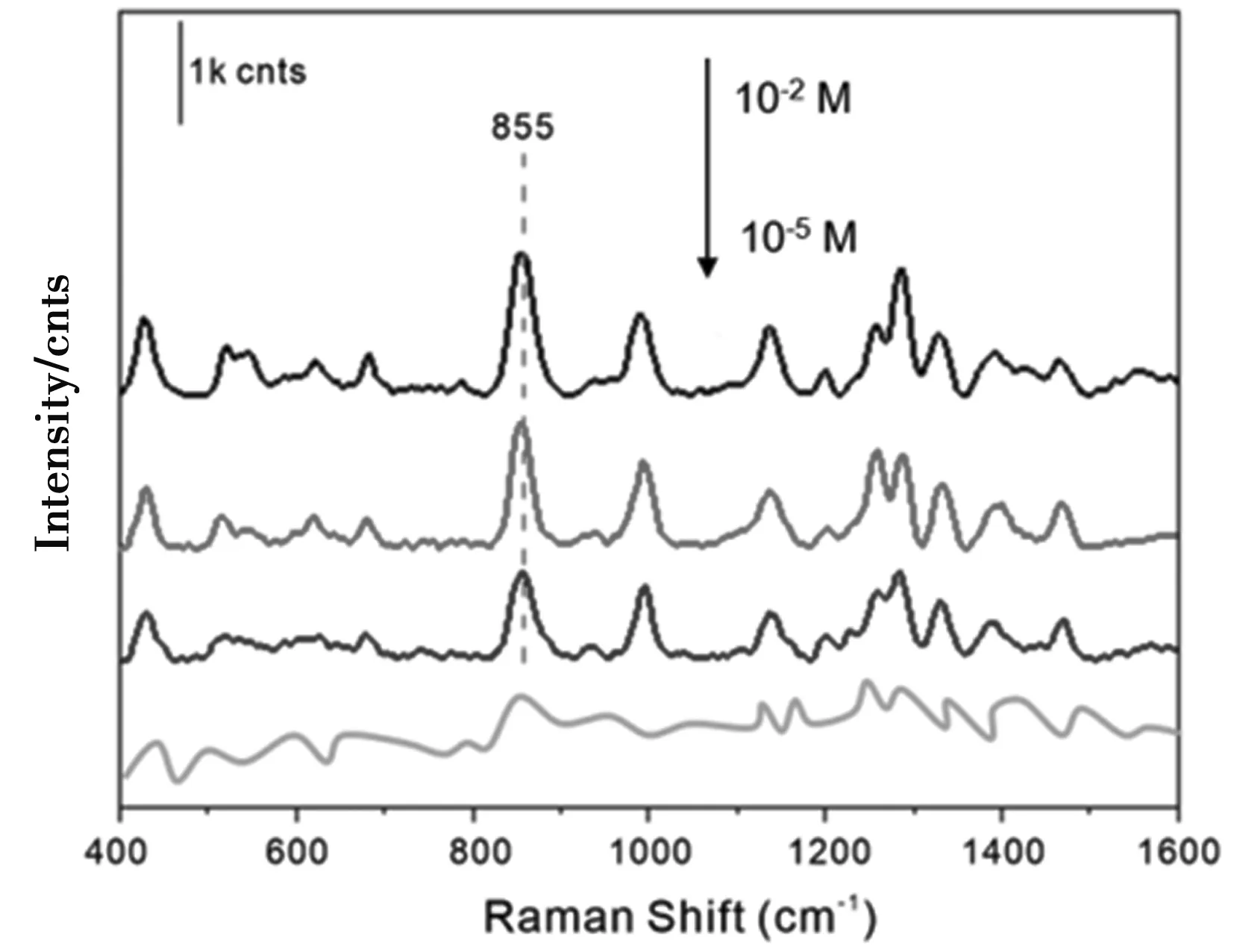
图10 尿液中不同浓度的6-MP的SERS谱图
3 结 语
本研究利用PVP-Au NPs作为SERS基底对抗肿瘤药物6-MP进行检测。首先,用种子生长法合成形貌较为均一的PVP-Au NPs,利用UV-vis光谱和SEM进行了表征。其次,以CV为探针分子检测SERS基底的灵敏性和重现性,其检测限可达10-7M,RSD为10.33%,表明此基底具有较好的检测灵敏性和重现性。最后,使用该SERS基底对抗肿瘤药物6-MP标准样品进行检测,检出限可达10-5M。此外,使用标准添加法对模拟尿液中的6-MP进行检测,实验结果表明在尿液中6-MP的检出限为10-4M。此方法简单,灵敏,为SERS技术在抗肿瘤药物的临床检测方面提供了可能。

