牡丹种子发育过程中生理生化指标变化的研究
刘 咪, 曾子欣, 徐 尧, 张 璇, 李铭洁, 孙 静
(扬州大学园艺与植物保护学院, 江苏 扬州 225009)
牡丹(PaeoniasuffruticasaAndr.)为芍药科芍药属牡丹组落叶灌木,是我国特有的植物资源,其9个野生原种均产于我国[1]。作为中国传统名花,牡丹的花可供观赏,根可作丹皮入药,种子含有较高的不饱和脂肪酸,对人体具有重要的生理功能,是食用油的良好来源[2]。近年来,油用牡丹的栽培与深加工在国内迅速发展,油用牡丹品种凤丹具有出油率高、结籽多、易于管理等优点[3-4]。目前关于油用牡丹种子的研究主要集中在种子含油量、油脂改良、脂肪酸组成等方面[5-7],对种子发育过程中形态结构和生理生化变化的相关研究较少。在牡丹种子发育过程中,可溶性糖作为主要呼吸底物,是种子发育所需营养物质和重要的能量来源,同时也与油料种子脂肪酸合成和油脂累积过程密切相关[8]。内源激素对发育各个阶段都有重要的生理调控作用,多种激素的平衡对胚胎发育及种子萌发有重要影响[9]。同时种子干重、鲜重与种子含水率反映不同时期贮藏物质的积累情况及种子饱满程度[10],是种子发育过程生理生化测定的重要指标。
本研究以凤丹为试验材料,对其种子发育进行研究,分析不同时期种子含水率、糖类和内源激素等含量及种子活力的变化,以期阐明不同发育时期牡丹种子糖类、内源激素含量、含水率等与牡丹种子发育与形态结构变化的关系,为油用牡丹种子适宜采收期的确定、生产利用和籽油开发提供参考。
1 材料与方法
1.1 材 料
牡丹种子收集于江苏省扬州大学牡丹芍药资源圃(32°32′N,119°24′E)。从牡丹花后第10天开始,每隔10 d取样一次,直至120 d,共12个时期。一部分用于测定生理指标及解剖观察,另一部分于-80 ℃超低温冰箱中保存备用。
1.2 方 法
1.2.1牡丹种子鲜重与含水量的检测
将12个时期牡丹种子种荚剥掉,用蒸馏水洗净自然风干。称取10粒种子的重量,称量3次,再计算出单粒种子的重量,作为种子鲜重。然后放在烘箱中烘48 h,称量3次,取平均值作为单粒种子干重。
1.2.2牡丹种子发育不同时期解剖结构观察
将盛花期后30 d、50 d、70 d的新鲜牡丹种子纵切,置于体式显微镜下观察,拍照。配置10%浓度的I2-KI溶液,用于种子中的淀粉染色。同时,准备浓度为2%的TTC(2,3,5-氯化三苯基四氮唑)染液,对种子纵切面进行染色,观察细胞活力,凡被染为红色的活力强,淡红的次之,无色者为没有活力的种子。
采取花后10 d的牡丹种子用刀片纵切两半,分别切取种皮和胚乳1 mm×1 mm大小的方块置于2.5%戊二醛溶液中固定2 h以上以备观察。观察前样品用0.1 mol·L-1的PBS缓冲液冲洗3次,每次15 min,依次经过50%、70%、85%、95%、100%酒精梯度脱水,每次15 min,丙酮和无水乙醇等体积混合液处理15 min,后经CO2临界点干燥,喷金,将其置于扫描电镜(XL-30 ESEM,荷兰Philips公司)下观察其发育状态。
1.2.3牡丹种子中糖类物质的检测
总糖含量测定参照植物总糖含量试剂盒(上海索桥生物科技有限公司)说明书进行;蔗糖、葡萄糖、果糖含量的测定参照试剂盒(上海桥杜生物科技有限公司)说明书进行。
1.2.4牡丹种子中植物激素的检测
取花后30 d、50 d、70 d的牡丹种子,用清水漂洗数次,吸水纸将表面水分吸干,放于液氮中迅速研磨,称取0.1 g粉末于EP管中,加入5 mL 80%甲醇水提液,在4 ℃冰箱里放置一夜。过夜避光浸提后,提取液用高速离心机在低温4 ℃下离心15 min,转速12 000 r·min-1。离心后,将上清液吸入新离心管中,加入200μL提取液,4 ℃下离心15 min,转速12 000 r·min-1,此过程重复一次。依次用10 mL纯乙醇,20 mL超纯水,10 mL 80%甲醇通过装有提取液的C 18萃取小柱,活化柱体。色谱条件:C 18(100×2.1 mm, 3μm)色谱柱,流动相:0.1%甲酸水-乙腈溶液,线性梯度洗脱:0~1 min, 5%乙腈;1~3 min, 5%~60%乙腈;3~6 min, 60%~95%乙腈;6~7 min,95~5%乙腈;7~10 min,5%乙腈,流速300μL·min-1,柱温25 ℃,样品盘温度4 ℃,进样量5μL,分析时间10 min。
各激素检测质谱条件为:电子喷雾离子源(ESI),温度600 ℃;多反应检测模式(MRM);气帘气压25 psi,离子化电压-4 500 V,喷雾气压为55 psi,辅助加热气压为55 psi。
2 结果与分析
2.1 牡丹种子发育不同时期鲜重、干重和含水量的变化
从表1可以看出,随着发育天数的增加,牡丹种子鲜重和干重变化趋势基本一致,均呈先升高后减少的趋势,花后30~50 d,种子鲜重、干重增重较快,这是种子发育初期胚乳逐渐形成阶段,物质积累最快的时期。开花50 d以后,种子增重较缓慢,成熟期(花后100 d)趋于稳定。花后10 d时,种子略小,含水率最大,达91%,随后种子含水率逐渐降低。在100 d时单粒鲜重和干重达到最大,分别为0.57 g和0.31 g,含水率降低到46%。花后110~120 d时,种子鲜重略微降低,含水率有所升高。
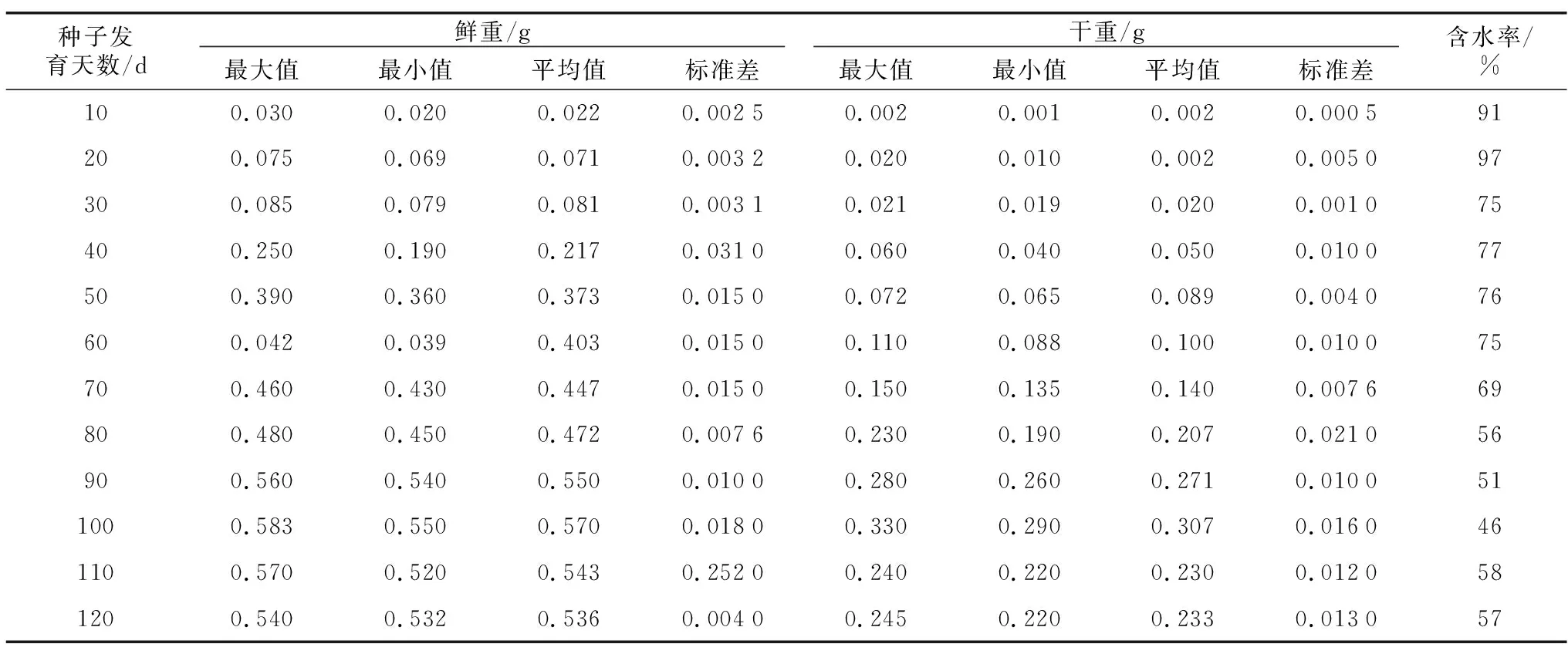
表1 牡丹种子发育不同时期的重量变化
2.2 牡丹种子发育不同时期胚乳的结构观察
从图1可以看出,牡丹种子分为种皮和胚乳两个部分。中央胚乳在种子发育初期存在空腔,有透明液体充满其中,花后30 d经TTC染色试验并未发现种子内活力很强的部分(图1 A)。花后50 d进入胚乳细胞化(图1 B),内部液体逐渐粘稠,细胞结构初现,TTC染色呈红色,表明此时胚乳内细胞活力最为旺盛,与胚乳形成密切相关。花后70 d(图1 C),胚乳形态变得坚硬,细胞活力减弱,胚状结构初现,种皮厚度减少。
I2-KI染色表明,牡丹种子内存在淀粉,主要集中于种皮部位。种子发育30 d(图1 D),种皮较厚,I2-KI染色呈黑色,说明内部存在淀粉。种子发育至50 d时(图1 E),种皮虽然变薄,但是内部仍然有淀粉富集,I2-KI染色中心胚乳呈橘黄色,说明内部具有大量蛋白质合成。花后70 d时(图1 F),种皮被不断充实的胚乳压缩变薄,胚乳中心呈现蓝紫色,说明出现少量淀粉。
2.3 牡丹种子花后第10天种皮的结构观察
牡丹种子发育第10天进行纵切,使用扫描电镜对纵切面进行扫描,发现种皮占全种子的体积较大,此时种皮又分为表皮、栅栏层、贮藏薄壁细胞层。表皮结构具有小突起,栅栏层仅有2层细胞围绕,贮藏细胞层数较多,为种皮积累淀粉提供场所,在花后第10天,种子中心形成空腔结构,内部充满透明液体(图2)。
2.4 牡丹种子发育过程中糖类相关物质变化
检测了牡丹种子发育30 d、50 d、
70 d三个时间点的糖类含量变化(图3),发现总糖的含量在175~220 mg·g-1(鲜重)之间,呈先升高后趋近平稳的状态。蔗糖含量有先下降后升高的趋势,30 d时蔗糖含量在40 mg·g-1(鲜重)左右,50 d时蔗糖含量略有下降,推测与此时胚乳的细胞化相关,到70 d时,蔗糖含量发生了明显升高,达60 mg·g-1(鲜重)左右。葡萄糖的含量呈小幅度上升的趋势,30 d时为82 mg·g-1(鲜重),70 d时升高到100 mg·g-1(鲜重)。果糖的整体含量最低,含量上升缓慢,并不显著。
2.5 牡丹种子激素含量变化
由图4可见,牡丹种子内Zeatin含量在花后30~70 d持续升高,花后70 d时最高,达到158.5μg(鲜重),显著高于IAA、GA3和ABA。GA3含量在种子发育过程中逐渐降低,由花后30 d的20.1μg·g-1(鲜重)降至花后50 d的9.7μg·g-1(鲜重),又降至花后70 d的2.3μg·g-1(鲜重)。IAA含量由花后30 d的3.8μg·g-1(鲜重)升高至花后50 d的5.8μg·g-1(鲜重),在花后50 d达到最高,而后趋于平稳。ABA含量在花后30 d后显著升高,花后50 d时达到最高,含量为0.25μg·g-1(鲜重),随后急剧下降,花后70 d时降至0.1μg·g-1(鲜重),相对于Zeatin、GA3和IAA,ABA含量极低。由此推断,牡丹种子生长发育变化最显著的时期为盛花期后30~50 d。
3 结论与讨论
3.1 牡丹种子活力和含水量与种子发育的关系
试验结果表明,随着牡丹种子不断发育,胚乳细胞活性不断增强,花后50 d活力达到最高,淀粉也在此时显著富集在种皮区域,凹陷处不断充实,有大量蛋白质合成,说明胚乳开始积累贮藏物质,牡丹种子形态和生理发育逐渐完善。之后种皮不断变薄,淀粉逐渐降解,胚乳形态变硬,种子活力不断减弱。研究认为,种子活力受种子成熟时生理状态的影响[11],与贮藏物质合成能力呈正相关,其活力下降时,合成速度也随之下降[12-13],本试验结果与之一致。种子含水量在种子发育过程中总体呈下降趋势,其中在盛花期后20 d及70 d显著下降,而种子鲜重、干重增加迅速,说明此时是牡丹种子营养物质积累的关键时期。种子发育第10天的扫描电镜观察表明,此时种子中间凹陷,存在空腔,空腔内充盈浆液。认为第20天后空腔内开始积累贮藏物质,种子含水量下降,种子成熟后含水量趋于平稳,推测营养物质的积累也在成熟时达到稳定状态。
3.2 种子发育与糖含量的关系
可溶性糖主要包含果糖、蔗糖、葡萄糖等,作为种子发育过程中主要的呼吸底物,是碳水化合物代谢、贮藏、运输的重要物质[14],其含量一般随着种子发育不断上升,但由于自身和环境因素,也会呈下降趋势,种子成熟后所需的糖一般由胚乳和胚贮藏的糖提供[15]。本研究中,牡丹种子发育早期可溶性糖含量先升高而后趋于平稳,与种子鲜重、干重的变化呈现一定的相关性,其中葡萄糖、果糖含量均逐渐升高。种子发育早期细胞分裂分化旺盛,葡萄糖是可溶性糖的主要组成部分,以满足发育早期较高的能量需求,后期随着蔗糖合成酶的高效表达,蔗糖含量不断升高,用于油脂、蛋白质等贮藏物质的合成。本研究中,花后30~70 d的种子中葡萄糖含量显著高于其他可溶性糖。而蔗糖含量在种子发育50 d降低后又显著升高,种子发育初期可溶性糖含量变化不明显,可能是由于种子发育初期各类营养物质的转化同时存在,生理过程较为复杂。
3.3 种子发育与内源激素含量的关系
种子发育过程中,随着种子形态的变化,营养物质的贮藏和积累,种子内源激素含量不断发生变化。分析发现,各内源激素在牡丹种子发育过程中出现峰值及起显著作用的时期不同,说明这些激素在不同阶段通过特定的作用影响种子的发育。Zeatin是细胞分裂素的一种,除了促进细胞的分裂生长外,还具有加速胚乳物质降解的作用[16]。本研究中种子发育50 d后,Zeatin含量显著升高,推测这个阶段胚乳形成,积累在胚乳中的淀粉逐渐降解有关。花后30~50 d,牡丹种子中IAA含量持续上升,发育至胚乳细胞化时期达到峰值,随后趋于平稳,种子IAA含量与种子活力呈显著相关性。由此可见,IAA在牡丹种子发育前期对种子生理活性具有重要影响。刘仲齐等[17]研究发现,IAA具有调集营养物质向种子转移,形成生长中心的作用。本研究结果与之基本一致。ABA作为抑制植物生长的激素可直接参与种子休眠、衰老等过程,也具有促进胚正常发育成熟的功能,可以促进某些贮藏物质的积累[18]。本研究中,牡丹种子ABA含量在花后30~50 d显著增加,胚乳形成后含量不断减少,推测ABA在牡丹种子成熟期作用不大。GA3含量在种子花后30~70 d呈逐渐下降的趋势,在胚乳形成和种子发育成熟过程中GA3作用不明显。
种子发育受含水量、淀粉含量、糖含量、激素种类和含量等多种因素影响,这些因素彼此之间又存在着复杂的相互作用。本试验仅对牡丹种子盛花期后30~70 d发育过程中部分生理生化指标进行了初步测定与探究,关于各指标之间更深入的相互作用以及在种子发育后期的变化还需进一步探究。

