纳米氧化锌对玉米幼苗生长及酶活性的影响
赵威 陈先良 王长进 余海兵 黄伟东
摘 要:利用竹叶优化合成纳米氧化锌,采用紫外可见吸收光谱法确定纳米氧化锌的最佳合成条件、比色法测定纳米氧化锌对玉米幼苗酶活性影响,并通过电镜扫描纳米氧化锌的形状。结果表明,纳米氧化锌最适合成条件为10mL滤液、1mmol/L Zn(CH3COO)2、pH 6、反应温度60℃,合成的纳米氧化锌为近球形或短杆状,分散性良好。纳米氧化锌对玉米幼苗生长的影响表现为低浓度促进生长,高浓度抑制生长;低浓度纳米氧化锌能够为玉米幼苗膜系统提供保护作用;适量添加生物合成的纳米氧化锌能够促进玉米幼苗生长,提高其抗性。
关键词:竹叶;纳米氧化锌;玉米幼苗;酶活性
中图分类号 Q945;TB383 文献标识码 A文章编号 1007-7731(2021)09-0022-05
与常规材料相比,纳米颗粒具有小尺寸、量子尺寸、宏观量子隧道及表面等四大效应[1-2]。作为21世纪的新兴科技,纳米技术的飞速发展使纳米材料逐渐渗透到人类社会的每个角落。纳米氧化锌作为一种重要的金属纳米颗粒,目前已被广泛用于电学、光学、化学、生物、食品等领域[3-6]。目前,納米氧化锌的合成方法主要包括微波辅助等物理途径[7-8]、液相还原等化学途径[9-10]、微生物与植物等生物合成途径3种[11-15]。与物理、化学方法相比,生物合成方法(尤其是利用植物组织为原材料)具有易操作、低能耗、避免有毒试剂使用、低成本等优点,与当前大力倡导的“绿色化学”理念相吻合。
纳米材料对植物生长影响主要表现为正向促进与反向抑制作用,主要取决于纳米材料种类、浓度、植物种类等因素。关于纳米氧化锌对植物的生长影响研究已有报道,但关于玉米生长的研究却鲜有报道[16-17]。为此,笔者研究测定生物合成的纳米氧化锌在根数、根(茎叶)长、根(茎叶)干重、酶活性等方面对玉米幼苗生长的影响,以期为玉米生长调节与保护提供参考。
1 材料与方法
1.1 试验材料与试剂 竹叶采集于安徽科技学院东校区;玉米种子(登海618)购于山东登海种业股份有限公司;Zn(CH3COO)2、HCl、NaOH、Tris、甘油、EDTA、ASA、DTT、GSH、盐酸、甲硫氨酸、氮蓝四唑、核黄素、愈创木酚、H2O2、Na2HPO4、NaH2PO4购于国药集团化学试剂有限公司,均为分析纯。
1.2 主要仪器 HH-8恒温数显水浴锅(上海汗诺仪器有限公司);PHS-3C pH计(上海诺萱科学仪器有限公司);电子分析天平(上海方瑞仪器有限公司);TU-1950紫外可见分光光度计(北京普析通用仪器有限责任公司);S-4800 SEM(日立高新技术公司);高速冷冻离心机(上海卢湘仪离心机仪器有限公司);光照培养箱(上海皓庄仪器有限公司)。
1.3 试验方法
1.3.1 植物滤液制备 竹叶洗净晾干,-20℃保存备用。称取20g竹叶,加入100mL蒸馏水,95℃水浴加热30min。植物提取液经滤纸过滤2次,4℃保存备用。
1.3.2 纳米氧化锌合成 按照体积比为1∶9加入上述滤液与蒸馏水,然后添加一定浓度的Zn(CH3COO)2,控温反应15min,观察溶液颜色变化。通过调整滤液体积、
Zn(CH3COO)2浓度、pH及反应温度对其合成过程加以优化。
1.3.3 玉米幼苗培养 选取籽粒饱满、大小均匀的登海618玉米种子置于以50、100、200、400、800?g/mL纳米氧化锌作为培养液的发芽盒中,以蒸馏水处理作为空白对照,每盒放置100粒玉米种子,随机排列,重复3次。培养箱温度25℃,相对湿度70%,每天光照12h。生长7d后,从经过0、50、100、200、400、800?g/mL纳米氧化锌处理的玉米发芽盒中分别取样并测定各种指标。
1.3.4 生物指标测定 玉米幼苗根长、茎叶长和根数采用测量法;玉米幼苗根鲜重、根干重、茎叶鲜重和茎叶干重采用称重法。每个处理选取10株幼苗测其根长、茎叶长、根数、根鲜重、根干重、茎叶鲜重和茎叶干重。
1.3.5 玉米幼苗酶活性测定 称取0.5g植物样品,置于预冷研钵中,加入5.0mL预冷提取缓冲液,在冰浴条件下研磨成匀浆。将匀浆液过滤,并用5mL提取缓冲液冲洗研钵和滤纸,滤液于4℃、4000r/min离心10min,收集上清液,用蒸馏水定容至10mL,低温保存备用。超氧化物歧化酶(Superoxide dismutase,SOD)测定采用氮蓝四唑(NBT)光还原法;过氧化物酶(Peroxidase,POD)测定采用愈创木酚比色法;过氧化氢酶(Catalase)测定采用紫外吸收法[18-19]。丙二醛(Malondialdehyde,MDA)的测定采用硫代巴比妥酸(Thiobarbituric Acid,TBA)法[18-19]。
1.4 数据处理 数据统计分析采用DPS数据处理系统软件,用ANOVA(Analysis of variance,LSD检验法)进行方差分析。
2 结果与分析
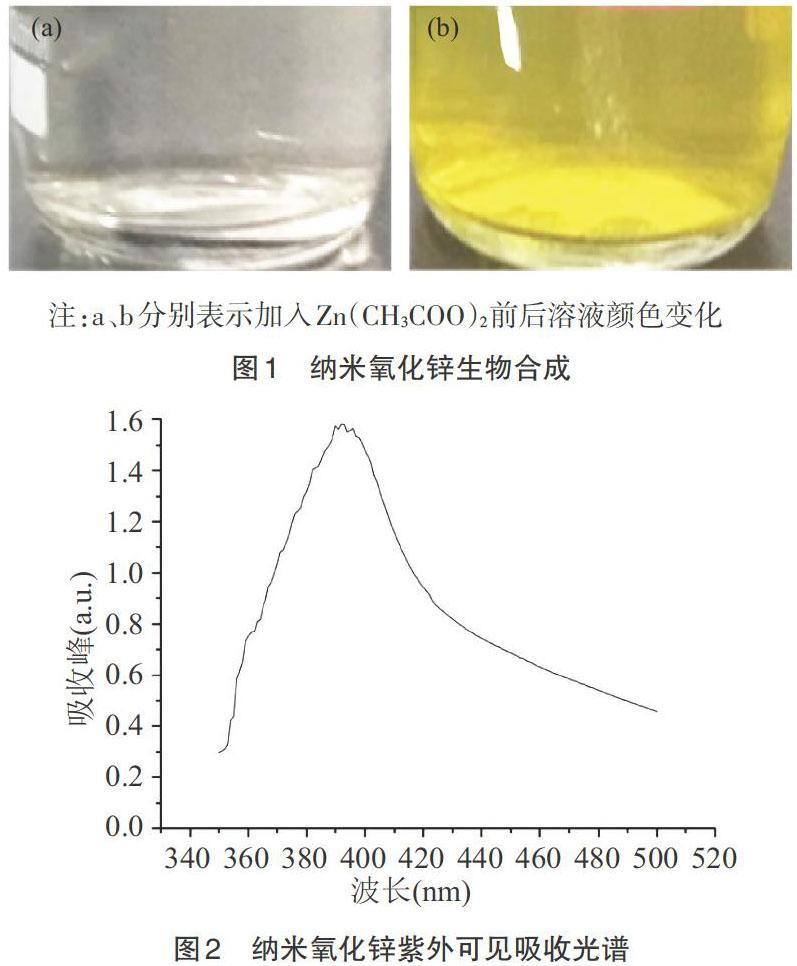
2.1 纳米氧化锌生物合成最适合的条件 稀释后的滤液加入Zn(CH3COO)2后,溶液由浅绿色变为黄色,溶液颜色的改变标志着纳米氧化锌的形成(图1)。此外,紫外可见吸收光谱结果显示其最大吸收峰位于393nm,对应于纳米氧化锌的表面等离子体共振(图2)。
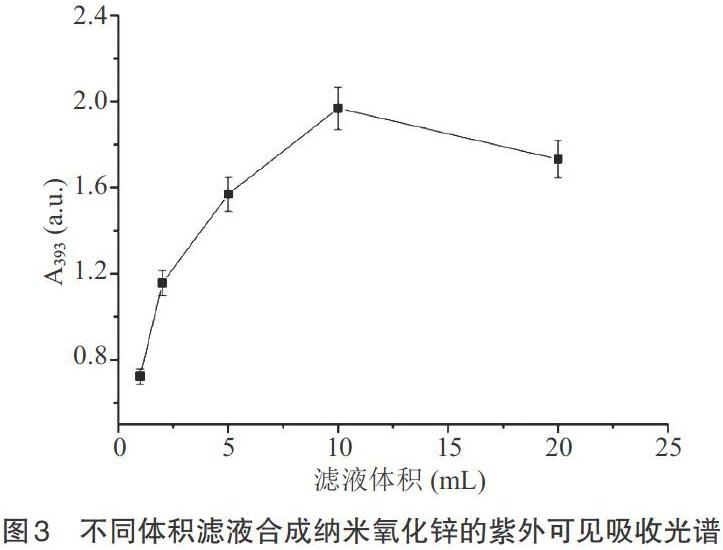
2.1.1 滤液体积 不同体积(1~20mL)的竹叶滤液均能合成纳米氧化锌。紫外可见吸收光谱结果表明,溶液最大吸收峰(A393)随滤液体积增加呈先增大后减小趋势,且当滤液体积为10mL时达到最大值(图3)。因此,确定最佳滤液体积为10mL。
2.1.2 Zn(CH3COO)2浓度 随着Zn(CH3COO)2浓度的增加,溶液对应的最大吸收峰(A393)有升有降,且在1mmol/L时达到最大值(图4)。因此,确定最佳Zn(CH3COO)2浓度为1mmol/L。
2.1.3 pH值 溶液酸碱性对纳米氧化锌的合成影响较大,随着溶液pH值增大,其最大吸收峰(A393)急剧减小,表明酸性条件有利于纳米氧化锌的合成(图5)。因此,确定最佳pH值为6。
2.1.4 反应温度 由图6可知,温度对纳米氧化锌形成的影响非常显著。紫外可见吸收光谱结果显示,溶液最大吸收峰(A393)随着温度升高而迅速降低,且当反应温度为60℃时,溶液吸收峰达到最大值。因此,确定最佳反应温度为60℃。
2.1.5 SEM与EDS分析 纳米氧化锌预先经超声充分分散,移液器吸取适当体积滴加在硅片上,喷金处理后置于扫描电子显微镜中检测。由图7可知,不同放大倍数获取的纳米氧化锌SEM图像为近球形或短杆状,存在少许聚集颗粒。而EDS显示纳米氧化锌在1keV和9keV附近具有明显的Zn、O元素吸收峰,其余元素如Si、Fe、K等可能归因于提取液中的成分。
2.2 不同浓度纳米氧化锌对玉米幼苗生物性状的影响 由图8可知,随着纳米氧化锌浓度的增加,玉米幼苗根数增加,但5个纳米氧化锌浓度间无显著性差异,其中800?g/mL纳米氧化锌处理的玉米幼苗根数最多(7根),明显大于对照;50、100、200、400?g/mL纳米氧化锌处理的玉米幼苗根長与对照无显著性差异,而100、400、800?g/mL纳米氧化锌的处理的玉米幼苗根长与对照有显著性差异,其中100?g/mL纳米氧化锌处理玉米幼苗根长最长,说明纳米氧化锌对于幼苗根长具有促进作用,但与其浓度无关;5个处理间玉米幼苗的茎叶长无显著性差异,但与对照均存在显著性差异,其中50?g/mL纳米氧化锌处理玉米幼苗茎叶长最大,说明纳米氧化锌浓度<200?g/mL时对幼苗茎叶生长无影响,但>200?g/mL时则明显抑制玉米幼苗茎叶的生长。
由图9可知,当纳米氧化锌浓度为200?g/mL时,玉米幼苗根鲜重开始低于对照,纳米氧化锌浓度为800?g/mL时幼苗根鲜重最低(4.41g),较对照减少了22.91%;5个处理玉米幼苗根干重显著小于对照,且5个处理之间也存在显著性差异,其中浓度为800?g/mL时幼苗根干重最低(1.87g),较对照减少了33.92%。由此可见,纳米氧化锌对玉米幼苗根生长具有抑制作用,且随着纳米氧化锌浓度的增加,抑制作用越强。
由图9可知,经纳米氧化锌处理后,玉米幼苗茎叶的鲜重和干重均高于对照,并且当纳米氧化锌浓度为50?g/mL时,玉米幼苗茎叶的鲜重和干重最大,较对照分别增加35.39%和25.78%。由此可见,纳米氧化锌对玉米幼苗茎叶的生长具有促进作用,并且当纳米氧化锌溶液浓度为50?g/mL时对幼苗茎叶生长的促进作用最大。
2.3 不同浓度纳米氧化锌对玉米幼苗抗酶活性与丙二醛含量的影响
2.3.1 幼苗根部 由图10可知,每个处理间玉米幼苗根部的SOD存在显著性差异,当纳米氧化锌浓度为800?g/mL时幼苗根部SOD活性最大,当纳米氧化锌浓度为50?g/mL时幼苗根部SOD活性最小,且与对照无显著性差异。总体而言,幼苗根部SOD活性随纳米氧化锌浓度增大而增大。POD和CAT能够清除过量的H2O2,防止膜脂质过氧化作用。由图10可知,玉米幼苗根部POD活性随着纳米氧化锌浓度的增加呈先增加后减小的趋势,当纳米氧化锌浓度为200?g/mL时POD活性达最大值,且显著大于对照。由图10可知,玉米幼苗根部CAT活性随着纳米氧化锌浓度的增大而减小,纳米氧化锌浓度为50?g/mL时幼苗根部CAT活性最大,纳米氧化锌浓度为800?g/mL时幼苗根部CAT活性较对照明显减小,说明当纳米氧化锌浓度为800?g/mL时纳米氧化锌对玉米幼苗的CAT起抑制作用。由图10可知,幼苗根部MDA值随纳米氧化锌浓度的增加呈先增加后下降的趋势,当纳米氧化锌浓度为400?g/mL时幼苗根部MDA值最大,且与对照无显著性差异;当纳米氧化锌浓度为50?g/mL时幼苗根部MDA值最小,且明显小于对照,说明当纳米氧化锌浓度达到400?g/mL时会损害玉米根的细胞膜系统,当纳米氧化锌浓度为50?g/mL时对玉米幼苗根的细胞膜系统具有保护作用。
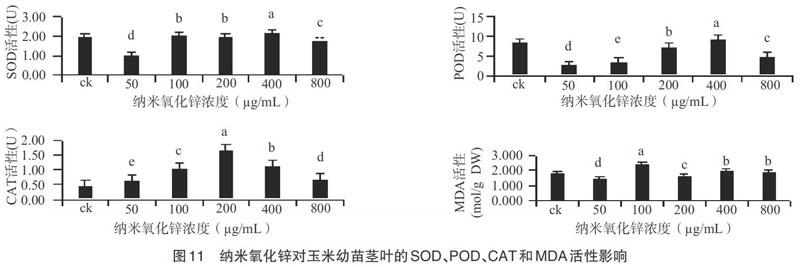
2.3.2 幼苗茎叶 SOD能够清除超氧自由基(O2-),与CAT、POD等酶协同作用来防御活性氧或其他过氧化物自由基对细胞膜系统的伤害,从而减少自由基对有机体的毒害。由图11可知,经过不同浓度纳米氧化锌处理后,玉米幼苗茎叶的抗氧化酶表现出不同的变化趋势。幼苗茎叶的SOD和POD活性随着纳米氧化锌浓度的增加呈先增加后减小的趋势,在400?g/mL纳米氧化锌处理下的幼苗茎叶SOD和POD活性最高,且显著高于对照,其他浓度处理下的幼苗茎叶SOD和POD活性小于对照;CAT的活性随着纳米氧化锌浓度的增加也呈先增加后减小的趋势,当纳米氧化锌浓度为200?g/mL时CAT活性最大,且明显大于对照,经过纳米氧化锌处理后的幼苗茎叶CAT活性均大于对照;玉米幼苗茎叶的MDA含量随纳米氧化锌浓度的增加呈先增大后减小趋势,在200?g/mL纳米氧化锌处理下的MDA含量最大,且显著大于对照,其他4个处理MDA含量均小于对照,其中50?g/mL纳米氧化锌处理下的MDA含量最小。
3 结论与讨论
本研究首次利用竹叶合成纳米氧化锌,证实竹叶提取液可以充当新型反应物用于制备纳米氧化锌。以植物组织为原材料的生物合成方法克服了传统的物理、化学合成途径的弊端。通过调整滤液、Zn(CH3COO)2浓度、pH值以及反应温度,探索出基于竹叶制备纳米氧化锌的最优条件。
纳米氧化锌对幼苗的根数、根长具有促进作用,800?g/mL纳米氧化锌处理下的幼苗根数最多,而50?g/mL纳米氧化锌处理下幼苗根长达到最大。但纳米氧化锌对玉米幼苗地上部分影响不大,甚至当纳米氧化锌浓度大于200?g/mL时,纳米氧化锌对玉米幼苗地上部分生长还存在抑制作用。Xiang等[16]报道的纳米氧化锌影响大白菜及Singh等[17]报道的纳米氧化锌影响菠菜也得出类似结论。SOD与CAT、POD等酶协同作用来防御活性氧或其他过氧化物自由基对细胞膜系统的伤害,从而减少自由基对有机体的毒害。本研究中一定浓度的纳米氧化锌对玉米幼苗SOD、POD、MAT的活性具有促进作用,但纳米氧化锌浓度过大会严重降低SOD、POD、MAT的活性,其中200?g/mL是纳米氧化锌最佳浓度,该浓度下幼苗茎叶SOD、POD、MAT的活性均较高,且200?g/mL纳米氧化锌处理下幼苗根茎叶中MDA含量相对较低,说明在200?g/mL纳米氧化锌处理后玉米幼苗的抗氧化性最强。
此外,竹叶提取液中一些活性物质具备一定的消炎抗菌作用,以其为原材料合成纳米颗粒在抑制病原细菌、病原真菌等方面具有一定应用潜力。
参考文献
[1]徐志军,初瑞清.纳米材料與纳米技术[M].北京:化学工业出版社,2010.
[2]徐云龙,赵崇军,钱秀珍.纳米材料学概论[M].上海:华东理工大学出版社,2008.
[3]Espitia P J P, Soares N D F F, Coimbra J S D R, et al. Zinc oxide nanoparticles:synthesis, antimicrobial activity and food packaging applications[J].Food Bioprocess Technol, 2012, 5(5):1447-1464.
[4]Kouhi S M M, Lahouti M, Ganjeali A, et al. Comparative phytotoxicity of ZnO nanoparticles, ZnO microparticles, and Zn2+ on rapeseed(Brassica napus L.):Investigating a wide range of concentrations[J].Toxicol Environ Chem Rev, 2014, 96(6):861-868.
[5]Narendhran S, Rajiv P, Sivaraj R.Toxicity of ZnO nanoparticles on germinating Sesamum indicum and their antibacterial activity[J].Bull Mater Sci, 2016, 39(2):415-421.
[6]Abdolmaleki A, Mallakpour S, Borandeh S.Effect of silane-modified ZnO on morphology and properties of bionanocomposites based on poly(ester-amide) containing tyrosine linkages[J]. Polym Bull, 2012, 69(1):15-28.
[7]Mitra S, Patra P, Pradhan S, et al.Microwave synthesis of ZnO@mSiO2 for detailed antifungal mode of action study:Understanding the insights into oxidative stress [J]. J Colloid Interface Sci, 2015, 444(4):97-108.
[8]Sherly E D, Vijaya J J, Selvam N C S, et al.Microwave assisted combustion synthesis of coupled ZnO–ZrO2 nanoparticles and their role in the photocatalytic degradation of 2, 4-dichlorophenol[J]. Ceram Internat, 2014, 40(4):5681-5691.
[9]Holmes J D, Lyons D M, Ziegler K J.Supercritical fluid synthesis of metal and semiconductor nanomaterials[J]. Chem Eur J, 2003, 9(10):2145-2151.
[10]Vanathi P, Rajiv P, Narendhran S, et al.Biosynthesis and characterization of phyto mediated zinc oxide nanoparticles:A green chemistry approach[J].Mater Lett, 2014, 134(134):13-15.
[11]Sangeetha G, Rajeshwari S, Venckatesh R.Green synthesis of zinc oxide nanoparticles by aloe barbadensis miller leaf extract:Structure and optical properties[J]. Mater Res Bull, 2011, 46(12):2560-2566.
[12]Elumalai K, Velmurugan S.Green synthesis, characterization and antimicrobial activities of zinc oxide nanoparticles from the leaf extract of Azadirachta indica(L.) [J].Appl Surface Sci, 2015, 345(6):329-336.
[13]Jafarirad S, Mehrabi M, Divband B, et al.Biofabrication of zinc oxide nanoparticles using fruit extract of Rosa canina and their toxic potential against bacteria:A mechanistic approach[J].Mater Sci Eng C, 2016, 59(6):296-302.
[14]Fu L, Fu Z.Plectranthus amboinicus leaf extract-assisted biosynthesis of ZnO nanoparticles and their photocatalytic activity[J].Ceram Internat, 2015, 41(2):2492-2496.
[15]Thema F T, Manikandan E, Dhlamini M S, et al.Green synthesis of ZnO nanoparticles via Agathosma betulina natural extract[J].Mater Lett, 2015, 161(2):124-127.
[16]Xiang L, Zhao H M, Li Y W, et al.Effects of the size and morphology of zinc oxide nanoparticles on the germination of Chinese cabbage seeds[J].Environ Sci Poll Res, 2015, 22(14):10452-10462.
[17]Singh D, Kumar A.Impact of irrigation using water containing CuO and ZnO nanoparticles on spinach oleracea grown in soil media[J].Bull Environ Contam Toxicol, 2016, 97(4):548-553.
[18]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[19]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
(责编:徐世红)

