不同施肥模式对土壤氮循环功能微生物的影响
郭俊杰,朱 晨,刘文波,王建中,凌 宁,郭世伟*
(1 南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化研究重点实验室,江苏南京 210095;2 溧阳市南渡镇农业综合服务站,江苏常州 213371)
土壤氮循环是农业生态系统的关键组成部分,主要包括氨化、硝化、反硝化和固氮等过程[1-2]。从本质上讲,氮循环是由植物、真菌、细菌和古菌等共同催化的氮化合物氧化还原反应网络[3],其中微生物是主要的驱动者[4]。研究表明,微生物对其定殖环境的变化非常敏感[5]。作为农业生态系统中主要的人为干扰因素,施肥能够通过改变土壤微环境,塑造土壤微生物群落,进而影响土壤氮循环过程[6-7]。基于氮素生物地球化学所涉及微生物功能基因的定量分析已被证明能够有效提供关于行使氮转化功能的微生物群落动态及其生态学信息,有助于将功能微生物类群与土壤性状以及实际氮转化生态过程直接联系,以提高对土壤氮循环关键微生物过程及机制的理解[8]。不同施肥模式对氮循环各功能基因具有显著不同的影响[6-7]。但是,大多数研究主要集中在涉及特定氮转化过程的一种或几种功能基因[6-8],关于施肥模式对整个土壤氮循环相关微生物群落的影响仍缺乏足够的认知。
在参与氮循环的微生物中,氨氧化微生物和反硝化微生物通常作为微生物生态学研究的模式微生物,以深入理解微生物群落在农业生态系统功能调控中的重要作用[9-10]。Petersen等[11]研究发现,氨氧化微生物和反硝化微生物的功能基因丰度是预测土壤硝化和反硝化潜在速率最重要的变量。相比于由多种不同的细菌、古菌和真菌所介导的反硝化过程,氨氧化过程仅由少数系统发育聚集的氨氧化古菌(AOA)和氨氧化细菌 (AOB) 完成,因而更适用于探究功能微生物类群与生态功能之间的联系[8]。AOA和AOB在大多数土壤中共存,且通常AOA的丰度比AOB更丰富,因此AOA被认为是土壤氨氧化过程的主导微生物[12]。然而,一些研究却提出了相反的结论,认为氨氧化活性的变化仅与AOB群落的丰度和组成有关,而与AOA的群落无关[13-14]。目前,AOA和AOB之间的生态位分异和功能互补已有较为明确的结论[15-16],但是关于不同施肥模式下AOA与AOB对土壤硝化作用的相对贡献仍有待于进一步研究。
本研究通过采集短期不同施肥模式田间试验的土壤样品,利用荧光定量PCR (q-PCR) 技术定量分析参与土壤氮循环过程的各类功能微生物基因丰度,探究土壤氮循环功能微生物对不同施肥模式的响应及其关键影响因素。同时,以氨氧化微生物为例,评估功能微生物类群与土壤生态功能间的内在联系。本研究旨在明确施肥模式对土壤氮循环功能微生物类群及其氮转化过程的影响,为制定更好的氮素管理策略提供理论依据。
1 材料与方法
1.1 田间试验地点与土样采集
田间试验始于2011年6月,地点位于中国江苏省常州市溧阳市南渡镇 (31°27′N,119°19′E),为常规稻麦轮作生态系统。该地区气候类型为北亚热带季风气候,年平均气温与降雨量分别为17.5℃和1149.7 mm。土壤类型为白土型水稻土。
稻季试验设置如下处理:1) 单施化肥 (NPK),施肥量为N 351.75 kg/hm2、P2O575 kg/hm2和K2O 84 kg/hm2;2) 化肥+畜禽有机肥 (NPKM),施肥量为N 282.75 kg/hm2、P2O575 kg/hm2、K2O 84 k g/hm2和有机肥 (鲜基) 1500 kg/hm2;3) 化肥+秸秆还田(NPKS),施肥量为N 351.75 kg/hm2、P2O575 kg/hm2、K2O 84 kg/hm2和小麦秸秆 (干基) 3000 kg/hm2。其中,NPKM处理是在NPK处理基础上减施20%化肥氮后增施有机肥。供试化肥种类为两种复合肥 (N–P2O5–K2O 分别为16–16–16 以及20–12–16)和尿素,有机肥为猪粪有机肥。2014年10月底,水稻收获后采集土壤样品,同时采集相邻江苏省耕地质量监测点不施肥处理的土壤样品作为对照 (CK)。在每个处理小区中,使用土钻采集10个位点0—20 cm土层土壤样品,混合后,过 2 mm筛除去杂质,之后分为三部分:一部分鲜土储存在–80℃冰箱,用于土壤DNA提取;一部分储存于4℃ 冰箱中,用于土壤铵态氮 (NH4+)和硝态氮 (NO3–)含量以及硝化潜势的测定;剩余部分风干后用于土壤pH、土壤有机碳 (SOC)和全氮含量分析。
1.2 土壤理化性质分析
将0.01 mol/L CaCl2溶液与鲜土按照液土比为10∶1的比例混合后振荡30 min,过滤后使用连续流动分析仪 (Autoanalyser 3,Bran Luebbe,Norderstedt,Germany) 测定土壤中铵态氮 (NH4+)和硝态氮 (NO3−)含量。使用 Vario MACRO cube 元素分析仪(ElementarAnalysensysteme GmbH,Hanau,Germany)测定风干土壤 (过 0.149 mm 筛) 的有机碳 (SOC)和全氮含量。将过 1 mm 筛的风干土壤与煮沸后冷却的无 CO2去离子水按 1∶2.5 (质量∶体积) 比例混合,振荡 30 min 并静置 30 min,使用 pH 计 (PE-10,Sartorious,Germany) 测定土壤悬浊液的pH。
1.3 土壤DNA提取及实时荧光定量PCR
称取 0.25 g 鲜土,使用 MoBioPowerSoilTMDNA提取试剂盒提取DNA。使用NanoDrop分光光度计 (NanoDrop Technologies,Wilmington,DE) 检测所提取 DNA (最终体积,100 μL) 的质量和浓度。使用 ABI 7500荧光定量 PCR仪 (Applied Biosystems,America)和SYBR®Premix Ex TaqTM试剂盒 (Takara) 进行定量 PCR (qPCR),分析氨化(gdh)、硝化 (AOA-amoA、AOB-amoA)、反硝化(narG、nirS、nirK、norB、nosZ)、固氮 (nifH)、硝酸盐异化还原 (napA) 等氮循环过程相关功能微生物基因的丰度。qPCR 反应体系为25 μL,包含 1 μL DNA 模板,12.5 μL SYBR® Premix Ex TaqTM,0.5 μL 正、反向引物,0.5 μL ROX Reference Dye II(50 ×) 以及 10 μL ddH2O。氮循环功能基因引物序列详见表1。
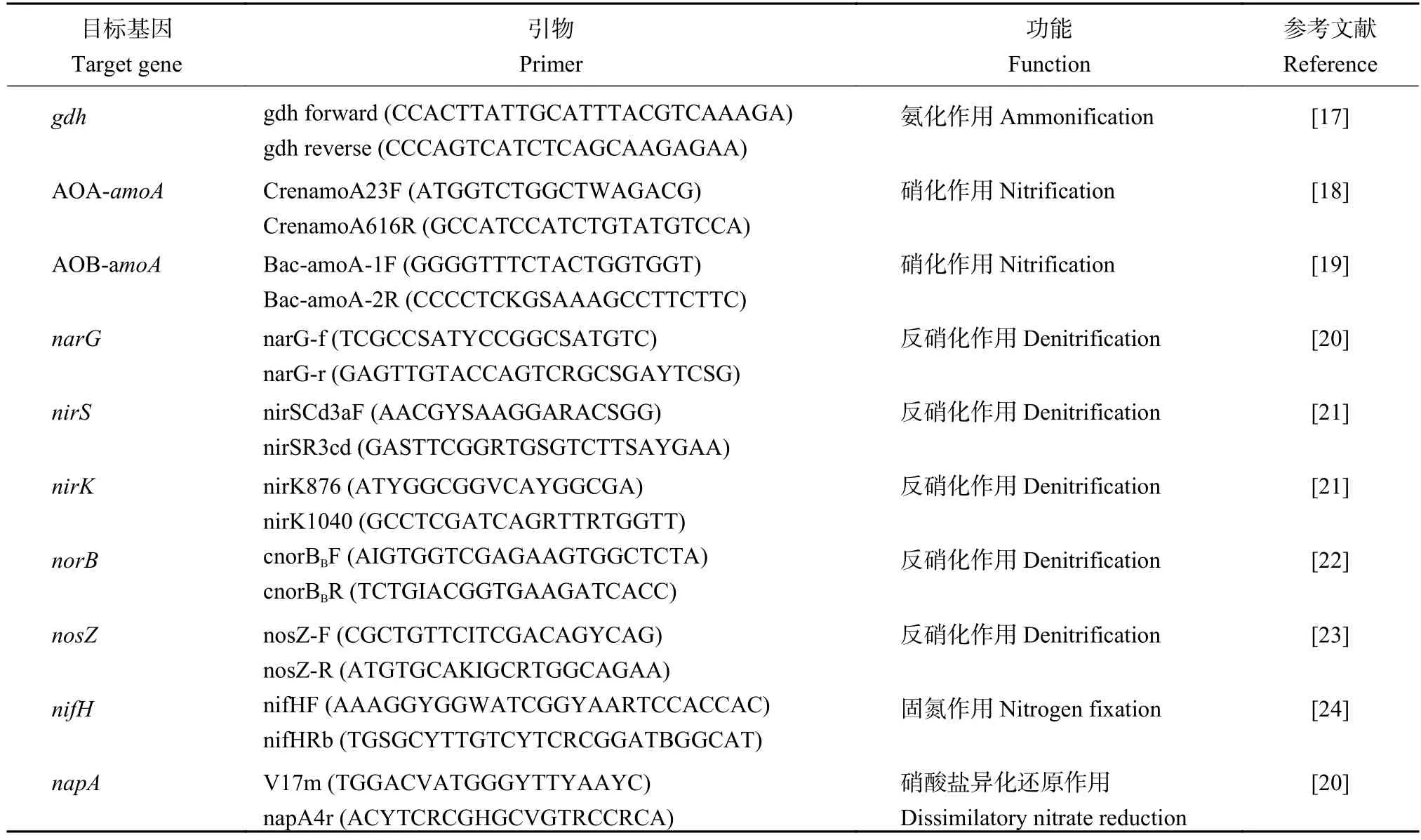
表 1 氮循环功能基因引物序列Table 1 The primer sets for amplification of functional genes involved in nitrogen cycle
1.4 硝化潜势测定
按照Taylor等[25]和Ouyang等[14]的方法,通过测定添加与不添加 1-辛炔 (4 μmol/L Caq) 情况下的土壤硝化潜势,确定AOA与AOB对硝化潜势的相对贡献。简而言之,将4.5 g鲜土置于150 mL盖有黑色瓶盖和灰色橡胶塞的玻璃瓶中,加入30 mL 30 mmol/L TES(2-[[三 (羟甲基) 甲基]氨基]乙磺酸) 缓冲液(含 1.0 mmol/L NH4+,pH 7.2),将瓶子在 30℃ 下以200 r/min振荡2 h以均匀混合。之后,将瓶子分为两组,其中一组立即加入1-辛炔气体 (4 μmol/L Caq),另外一组不添加1-辛炔作为对照。在振荡后2与24 h分别采集5 mL土壤悬浊液。土壤悬浊液离心8 min (8000 r/min),再用滤纸过滤至 10 mL 离心管。用连续流动分析仪 (AA3) 测定滤液中亚硝态氮(NO2−)和硝态氮 (NO3−) 的浓度。硝化潜势通过(NO2−+NO3−) 浓度与时间的线性关系斜率表示。1-辛炔能够使AOB的氨单加氧酶不可逆转地失活,但对AOA无显著的抑制作用[25]。因此,在1-辛炔存在下硝化潜势为AOA (对1-辛炔拮抗) 介导的硝化潜势。AOA的硝化潜势与无1-辛炔存在下测定的总硝化潜势之间的差值为AOB (对1-辛炔敏感) 所介导的硝化潜势。
1.5 统计分析
单因素方差分析 (ANOVA) 用于检验施肥模式对氮循环功能基因丰度、硝化潜势等的影响,并采用Fisher最小显著性差异法 (LSD) 进行多重比较 (α=0.05,SPSS 16.0 for Windows,IBM Corp.,Armonk,NY,USA)。基于欧式距离矩阵,采用主成分分析(PCA)和单因素多元方差分析 (PERMANOVA)、置换多元分散分析 (PERMDISP) 比较样品之间整体氮循环功能基因丰度的差异 (R 3.2.2, ape和vegan package)。使用相似度百分比分析 (SIMPER) 评估单一氮循环功能基因对施肥与对照处理之间功能微生物变异的相对贡献[6](R 3.2.2,vegan package)。采用回归分析评估总硝化潜势和amoA基因丰度之间的关系、AOA或AOB所介导的硝化潜势与其相应的AOA-amoA或AOB-amoA基因丰度之间的关系 (R 3.2.2,stats package)。通过前向选择,筛选纳入冗余分析 (RDA) 的土壤理化参数。使用RDA阐明土壤理化性质与氮循环功能基因丰度之间的关系,并使用蒙特卡罗置换 (Monte Carlo permutations) 检验其显著性。使用逐步回归分析土壤理化性质与单一氮循环功能基因丰度以及硝化潜势的关系 (R 3.2.2,MASS package)。
2 结果与分析
2.1 不同施肥模式对氮循环功能基因丰度的影响
主成分分析 (PCA) 表明,不同施肥模式下土壤中氮循环功能基因丰度整体发生了显著改变(PERMANOVAF=19.517,P=0.001;PERMDISPF=0.1682,P=0.915,图 1)。PCA 1 轴与 2 轴分别解释75.92%和8.68%的整体氮循环功能基因的变化。如图1所示,各施肥模式可分为3组:CK处理的土壤与其他施肥处理下的土壤相比差异较大,作为一组;NPK与NPKS处理的土壤氮循环功能基因分布相似,作为一组;NPKM处理的土壤作为一组。
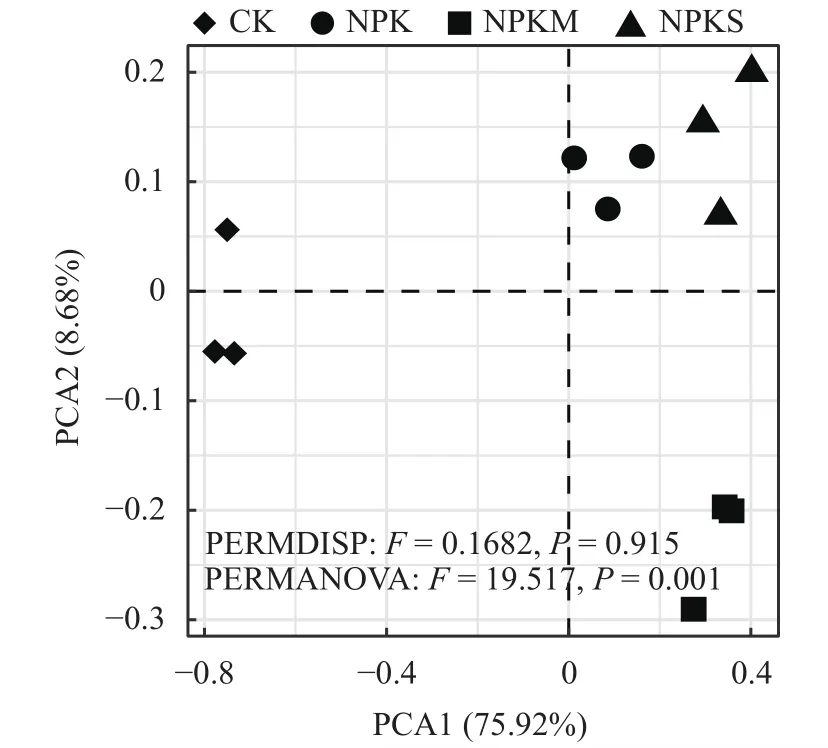
图 1 氮循环功能基因的主成分分析Fig.1 PCA plot of microbial functional genes involved in nitrogen cycle
图2显示,施肥处理对AOA-amoA、nirS、napA3个氮循环功能基因丰度无显著影响,但是对其余7个功能基因丰度均有不同程度的影响。与CK相比,NPK处理显著提高了土壤AOB-amoA(21.3倍)、narG(3.3 倍)、nosZ(1.1 倍)、nifH(0.9 倍) 的基因丰度,但对gdh、nirK、norB基因的丰度没有显著影响;NPKS处理则提高了土壤AOB-amoA(26.1倍)、narG(4.6 倍)、nirK(2.8 倍)、nosZ(4.5 倍)和nifH(3.3倍) 基因的丰度;NPKM处理显著提高了除AOA-amoA、nirS、napA基因外的氮循环功能基因的丰度,特别是AOB-amoA,比CK处理高33.5倍 (图2)。
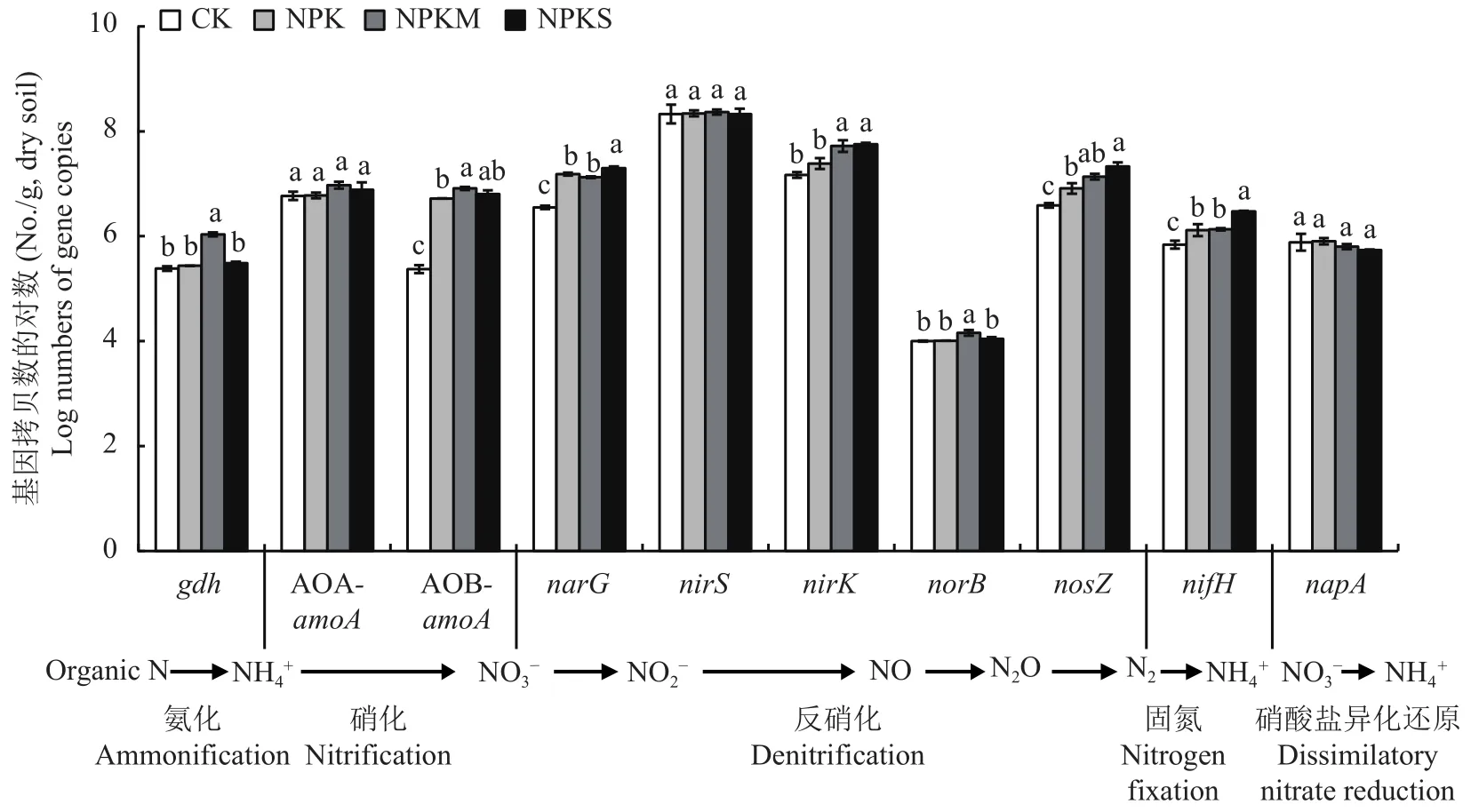
图 2 不同施肥模式下氮循环功能基因丰度Fig.2 Abundance of functional genes involved in nitrogen cycling under different fertilization regimes
通过SIMPER计算每个功能基因对施肥土壤与对照土壤间氮循环功能微生物群落差异的相对贡献,以明确导致施肥处理与对照处理间氮循环功能微生物差异的主要基因 (表2)。3个施肥处理中,AOB-amoA基因丰度的变化对氮循环功能基因整体丰度变异的权重最大,占28.56%~38.92%,其次为narG,贡献率在11.50%~18.42%,而norB基因的贡献最低,仅为0.39%~3.14%。
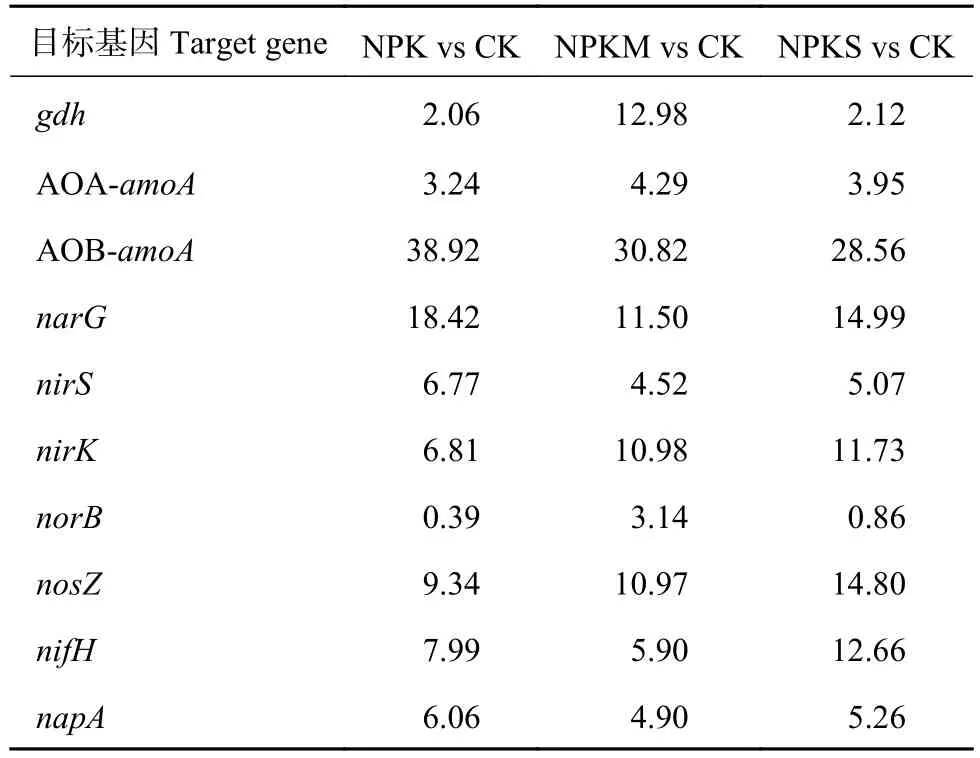
表 2 各功能基因对不同施肥处理与对照间整体氮循环功能基因丰度变异的贡献 (%)Table 2 Contribution of each target gene to total variations of nitrogen cycling gene abundance between fertilization and CK using SIMPER analysis
2.2 不同施肥模式对硝化潜势的影响
不同施肥处理间土壤硝化潜势差异显著 (图3),以NPKM处理土壤的硝化潜势最高,为15.07 mg/(kg·d),以CK处理的土壤硝化潜势最低,仅为5.25 mg/(kg·d)。与 CK 处理的土壤相比,NPK、NPKM和NPKS处理的土壤硝化潜势分别提高了149.09%、187.16%和186.10%。
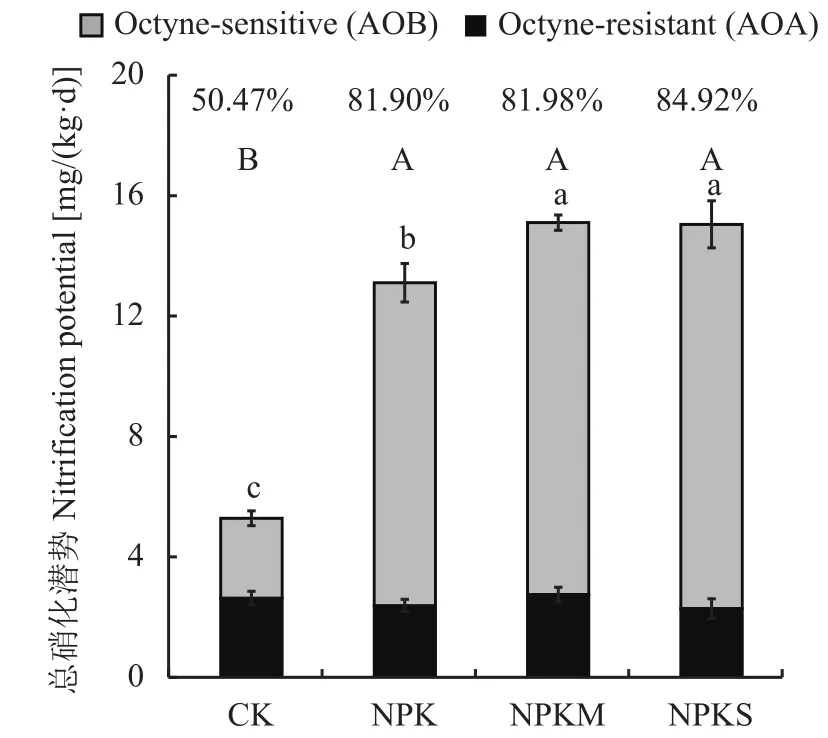
图 3 不同施肥模式下土壤的硝化潜势 (1-辛炔抑制法)Fig.3 Nitrification potential with and without 1-octyne under different fertilization regimes
施肥模式对AOB介导的土壤硝化潜势影响显著(F=78.11,P<0.05),而对 AOA 介导的土壤硝化潜势无显著影响 (F=0.735,P=0.56)。CK 处理的土壤硝化潜势为2.65 mg/(kg·d)。与CK处理的土壤相比,施用肥料显著提高了AOB介导的土壤硝化潜势,增幅为10.72~12.76 mg/(kg·d)。AOB 介导的硝化潜势约占土壤总硝化潜势的50.47%~84.92%,对土壤硝化潜势的贡献高于AOA。
图4 回归分析表明,土壤总硝化潜势随着土壤中AOB-amoA基因拷贝数的增加呈线性增长趋势(R2=0.957,P<0.001),但是与 AOA-amoA基因拷贝数相关性不显著。分析AOA与AOB各自介导的土壤硝化潜势与其相应amoA基因拷贝数之间的关系发现,其各自介导的土壤硝化潜势均随着amoA基因拷贝数的增加呈现增长趋势 (AOA:R2=0.406,P=0.026;AOB:R2=0.960,P<0.001)。
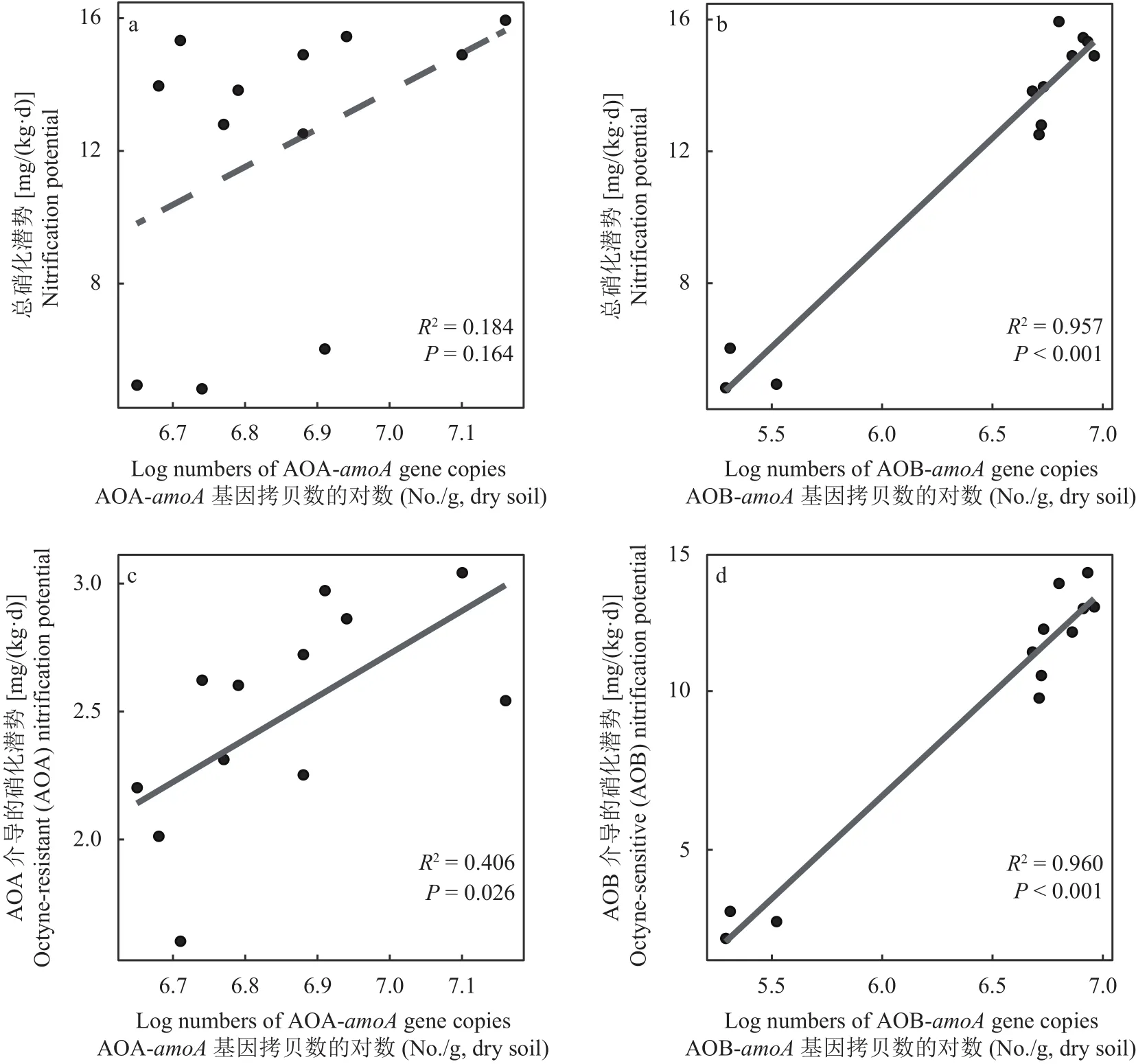
图 4 硝化潜势与AOA-amoA及AOB-amoA基因拷贝数之间的关系Fig.4 Linear relationships between soil nitrification potential and the copy numbers of AOA-amoA or AOB-amoA gene
2.3 影响氮循环功能基因及硝化潜势的土壤理化因素
通过前向选择,筛选出pH、SOC和NO3−含量 3个主要理化因素。冗余分析 (RDA) 表明,理化性质解释了氮循环功能基因丰度总变异的87.96%,其中前两轴解释变异的83.08% (图5)。第一组分 (RDA1)将CK处理的土壤与其他土壤分开,并解释了74.98%的变异。第二组分 (RDA2) 将NPKM处理的土壤与NPK、NPKS处理的土壤分开,并解释了8.10%的变异。根据蒙特卡罗置换测验,pH、SOC和NO3−含量显著影响了氮循环功能基因丰度的变化。逐步多元回归分析同样表明,SOC含量是决定土壤中绝大多数氮循环功能基因丰度的主要因素 (表3)。此外,pH和SOC含量是影响土壤硝化潜势的重要理化因素。
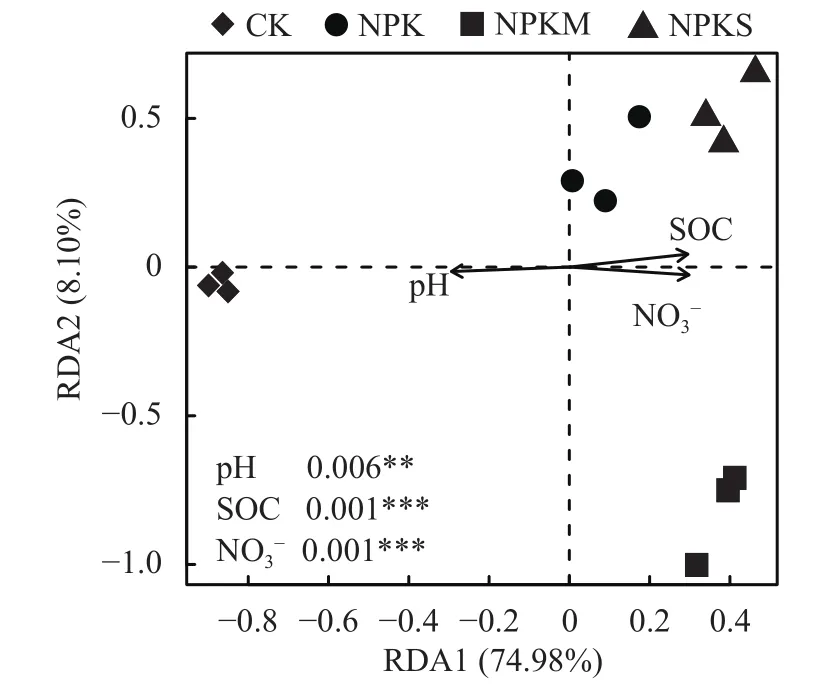
图 5 不同施肥模式下氮循环功能基因丰度与土壤理化性质的冗余分析Fig.5 Redundancy analysis (RDA) ordination plots depicting the relationships between abundance of the functional genes involved in nitrogen cycle and selected soil properties under different fertilization regimes
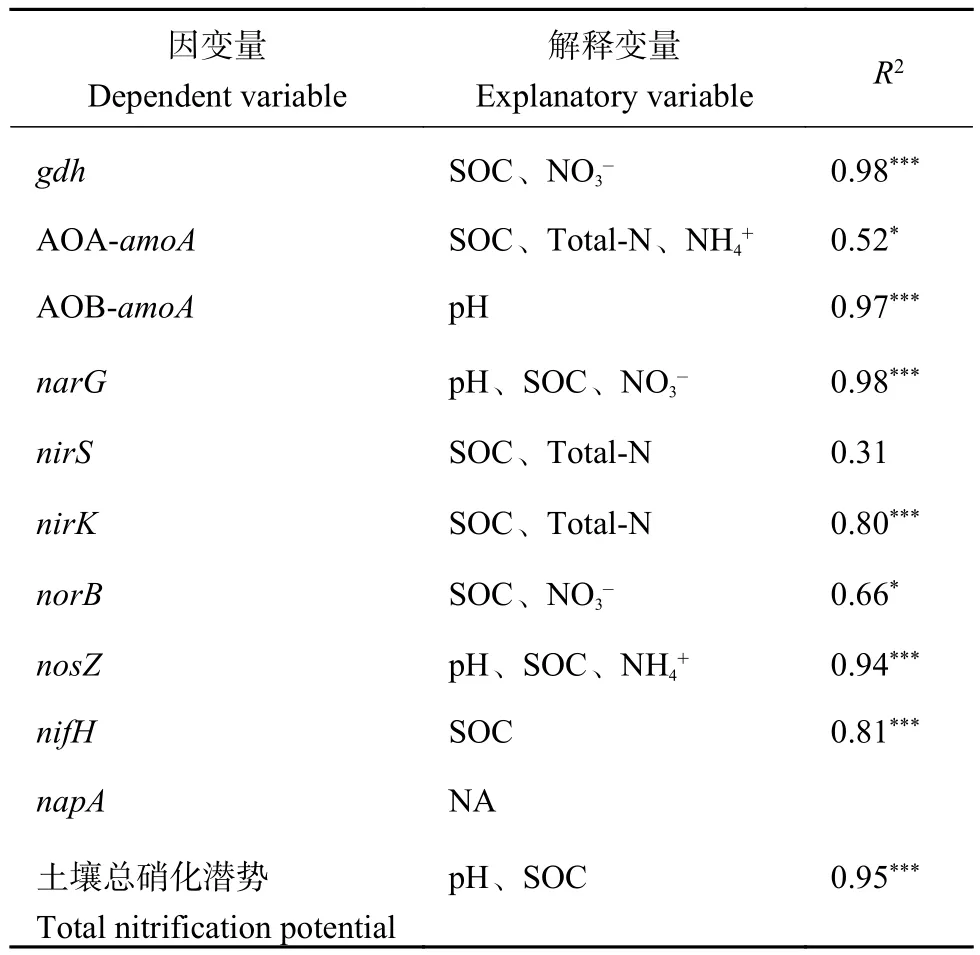
表 3 与氮循环功能基因拷贝数以及总硝化潜势显著相关的土壤理化性质 (经逐步回归分析筛选)Table 3 The soil properties correlated with functional gene copy numbers involved in nitrogen cycle and total nitrification potential (screened by stepwise regression analysis)
3 讨论
3.1 施肥模式对氮循环功能微生物基因丰度的影响
一般而言,化肥的施用对不同氮循环相关微生物的丰度具有显著影响,但其变化趋势却并不一致[6-7,26-27]。相比之下,有机类肥料 (包括畜禽有机肥、秸秆等) 的施用通常对固氮[28]、硝化[29]和反硝化[30]微生物的丰度表现出具有类群特异性的提升作用。资源有效性影响着土壤微生物的生存与发展,例如固氮微生物通常受到碳与磷供应的限制[31],而氨氧化微生物的生长与底物铵盐的有效性紧密相关[14]。与化肥短期而快速的养分释放特性不同,有机类肥料能够为土壤微生物提供充足且持续的碳源与养分,支持土壤微生物种群的整体生长,从而导致氮循环相关微生物种群也可能随之增长[7]。在本研究中,RDA与逐步多元回归分析均表明了SOC含量是影响氮循环功能微生物群落丰度最重要的因素。除了SOC含量,pH与NO3−含量也显著影响着氮循环功能基因丰度。前人的研究表明,土壤pH除了影响整体微生物群落组成[32-33],对氮循环功能基因的丰度和多样性也具有强烈的调控作用[8,34]。与秸秆还田相比,畜禽有机肥对氮循环相关微生物的促进效果更强。导致这一现象的原因可能是畜禽有机肥与秸秆相比更能提供均衡和稳定的营养供应[35],可以维持更多样化的土壤微生物群落[36]。此外,畜禽有机肥与秸秆本身的性质差异,如木质素与纤维素含量、碳氮比等,会影响有机物质的矿化,也是导致土壤氮循环微生物响应不同的可能原因[35]。需要注意的是,由于功能基因丰度与氮循环生态过程的可能联系[7],施用肥料尤其是有机类肥料所引起的硝化、反硝化相关功能基因丰度的提高,可能会导致氮素损失、氮肥利用率下降等潜在风险的发生。与Sun等[6]的研究结果相似,在本研究中,AOB-amoA基因是施肥影响下氮循环功能微生物群落丰度变异最重要的基因。这一结果表明氨氧化细菌对施肥的敏感性高于其他氮循环相关微生物类群。其主要原因可能是所施用的肥料中,复合肥中所含的铵态氮以及尿素通过水解形成的氨会直接影响土壤氨氧化细菌的生长[6]。此外,硝化作用的代谢产物硝酸盐是反硝化作用中硝酸盐还原过程的底物,因此硝酸盐还原酶编码基因narG对氮循环群落丰度变异的贡献也较高。
3.2 土壤氨氧化微生物与土壤硝化活性的联系
AOA与AOB所介导的氨氧化是土壤硝化过程的初始与限速步骤,因此也被认为是影响肥料有效性的关键过程。在本研究中,与AOB相比,AOA具有更高的丰度 (约为AOB的1.2~25倍),且施肥导致AOA与AOB的丰度比值显著降低。这是由于无论是单施化肥还是增施有机类肥料,AOA-amoA基因丰度均不受影响。不同于AOA,与不施肥土壤相比,施肥导致土壤中AOB-amoA基因丰度显著增加。这一结果与Ouyang等[14]的研究结果相似。然而,其他研究者却发现随着粪肥或堆肥的施用,AOA丰度增加[29,37]。这可能是由于这些研究中粪肥或堆肥施用时间长,且具有较高施用量,能够提供大量由有机态氮矿化而成的氨/铵态氮,有利于AOA的生长[14]。此外,与AOA相比,AOB具备更大的细胞尺寸[15],且两者的氨氧化途径不同,这些也可能会影响它们对铵态氮的生理响应[7]。
在所有施肥的土壤中,AOB对总硝化潜势的贡献约为81.90%~84.92%。即使在不施肥土壤中,AOB对总硝化潜势的贡献也超过50%。Ouyang等[14]通过4年的田间试验发现,相比于AOA,AOB对农业土壤中的氮源更敏感,在土壤硝化过程中起主导作用。Xia等[38]则通过稳定性同位素探针技术发现,AOB主导了农业土壤中约76%的硝化作用。此外,本研究结果显示,AOA对总土壤硝化潜势仍具有15.08%至49.53%的贡献,表明AOA同样是土壤氨氧化过程的参与者[14,39]。虽然土壤总硝化潜势仅与AOB-amoA基因丰度呈显著正相关,但是AOA、AOB的功能基因丰度与AOA、AOB各自介导的硝化潜势也呈现显著的正相关,这再次说明在农业土壤中,AOA和AOB都是土壤硝化作用的重要贡献者。但是,AOB对氮肥的响应比AOA更敏感。因此,在调控农田土壤硝化作用以减少氮素损失、提高氮素利用率时,应该主要集中在调节AOB丰度上,特别是在施用铵态氮肥或酰胺态氮肥的土壤中。通过物理化学手段 (如施用硝化抑制剂) 或者植物分子育种途径 (如培育根际强硝化抑制的作物),可能是调控农田土壤AOB微生物群落生长的有效管理措施。
4 结论
化肥与有机类肥料配合施用可不同程度地提高氮循环功能基因的丰度。土壤pH、有机碳和NO3−含量是影响氮循环微生物群落丰度的关键因素。AOB-amoA基因对施肥模式最为敏感,其丰度的变化影响着土壤整体氮循环群落丰度变化。AOB主导着农田土壤的硝化作用,AOB-amoA基因丰度的高低可在一定程度上反映土壤硝化作用的强弱。

