富硒乳酸菌的筛选和体外活性的研究
韦梦婷,王 英,单成俊,刘小莉,夏秀东,董明盛,周剑忠,
(1.南京农业大学食品科技学院,江苏南京 210095;2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
硒元素是人体必需的微量元素[1],具有抗癌、抗氧化、增强人体免疫力等重要的生理功能及广泛的药理作用[2]。硒元素不能在体内自行合成,人体摄入硒的途径主要来源于膳食[3]。
硒元素在自然界的存在形式有有机态和无机态,相较于常见的无机硒毒性大且机体不易吸收,有机硒或零价态的单质硒往往具有较高的吸收利用率[4-5]。有研究表明,利用生物转化法将无机硒转化为有机硒是一条安全有效的途径[6],且转化为有机硒后,无机硒不仅毒性降低而且在激发免疫反应上效果更显著,因此摄入有机硒被认为是更安全的补充硒元素的方法[7-8]。
有机硒在地球上的分布极不均衡,人工合成有机硒难度高、消耗大,故很多研究者把目标转向微生物的富集作用。微生物繁殖快、易操作、转化作用强等特点适于有机硒的合成。乳酸菌是一种人体常见益生菌,在食品工业中应用广泛,将其用于无机硒转化,可在一定程度上保障富硒产品的安全性[9]。本文以15 株乳酸菌为材料,通过检测对硒的耐受性和转化能力筛选富硒菌,通过检测菌体自由基清除率、还原力和菌体胆盐及人工胃酸耐受力,确定富硒菌的体外生物活性大小,最终筛选出转化活性高的乳酸菌,以期为富硒产品的开发提供原料和依据。
1 材料与方法
1.1 材料与仪器
15 株乳酸菌 由江苏省农业科学院农产品加工研究所食品生物工程研究室自主分离得到,其中,菌株JX5、JX8、JX11 和JX14 分离自江西Kefir,菌株M9-4、6-9 和K15 分离自新疆酸马奶,菌株SR3-8、SR1-6 分离自侗族酸肉,菌株AL2、B1-G2、XL3、AG2、G 和S 分离自新疆传统发酵酸牛奶;细菌DNA 提取试剂盒 上海生工生物工程有限公司;MRS培养基、牛胆盐 分析纯,北京奥博星生物技术有限公司;亚硒酸钠 分析纯,天津市化学试剂研究所;3,3’-二氨基联苯胺(DAB)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-联氮-双-3 乙基苯并噻唑啉(ABTS)分析纯,上海麦克林生化试剂有限公司。
JY300C 电泳仪 北京君意东方电泳设备有限公司;UV-1600PC 紫外分光光度计 上海美普达仪器有限公司;SW-CJ-1C 型双人单面净化工作台 苏州净化设备有限公司;124S-CW 分析天平 赛多利斯科学仪器(北京)有限公司;TOMYSX500 自动灭菌锅 日本Tomy Digital Biology 公司;FE28 pH 计梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 菌种的分离鉴定 通过对15 株菌平板划线法分离、接种到MRS 液体培养基中扩大培养、革兰氏染色、过氧化氢酶检测和镜检,初步鉴定为乳酸菌,为验证结果接下来进行菌种的16S 鉴定。
将分离得到的15 株菌收集菌体冻干,经液氮研磨后用细菌基因组DNA 试剂盒提取DNA,选用细菌通用引物27 F 和1492 R 对菌株的16S rDNA 片段进行扩增。PCR 反应体系(50 μL):上、下游引物1 μL(20 μmol/L);模板DNA 1 μL;Premix Taq 25 μL;超纯水22 μL。PCR 扩增过程:95 ℃预变性5 min,95 ℃后持续变性30 s、55 ℃退火30 s、72 ℃ 2 min进行35 次循环,最后72 ℃延伸10 min,4 ℃保温。PCR 产物经1.5%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司测序。将测序结果进行BLAST 比对,将所得序列与NCBI 的Genbank数据库中已知序列进行比对,确定菌种类型[10]。
1.2.2 菌种的活化 将甘油管保存的菌种在无菌条件下接种到MRS 培养基中,37 ℃,24 h,活化2~3代后即可作为菌液使用。
1.2.3 富硒乳酸菌的筛选 将活化好的15 株乳酸菌菌液以3%的接种量接种到硒添加量(以亚硒酸钠含量计)为20 μg/mL MRS 培养基中,37 ℃培养至对数后期,测定菌液的OD600,3 次平行试验,去除OD 值显著降低的菌株。
1.2.4 生长曲线的测定 将初筛得到的富硒乳酸菌,3%的接种量接种到MRS 培养基中,培养24 h,每隔2 h 取一次样,测定菌液的OD600,3 次平行试验。以时间为横坐标,OD600为纵坐标绘制生长曲线,以确定加硒时间和培养时间。
1.2.5 适宜硒质量浓度的确定 分别配制含亚硒酸钠质量浓度为40、60、80、100、120 μg/mL 的MRS液体培养基,以3%的添加量接种富硒菌,37 ℃,培养至稳定期,观察菌体颜色变化,确定最适加硒质量浓度[11]。
1.2.6 硒含量测定 采用3,3'-二氨基联苯胺(DAB)分光光度法检测硒含量。由于在酸性条件下,硒与DAB 反应生成黄色苤硒脑络合物,苤硒脑络合物在中性溶液中可被甲苯或二甲苯等有机溶剂较好地提取,在420 nm 时有最大吸光度[12-13]。
硒含量标准曲线的测定参考文献[13],准确吸取10 μg/mL 的硒标准溶液0、2、4、6、8、10 mL 分别加到100 mL 的烧杯中,加水至35 mL,再加入5 g/100 mL EDTA-2Na 溶液1 mL,摇匀,并用1:1的盐酸调节pH 至2~3,各加0.5% DAB 溶液4 mL,摇匀,置于暗处30 min,再用5% NaOH 调节pH 至中性,加入到分液漏斗中,加入10 mL 甲苯振摇2 min,静置分层,去水层,收集甲苯层于比色皿中,于420 nm 波长处测吸光度,绘制标准曲线。
将样品离心取上清液10 mL,以下步骤按照标准曲线的制作方法,根据标曲计算出上清液硒含量,为残留无机硒量,根据式1 计算富硒率[14]。
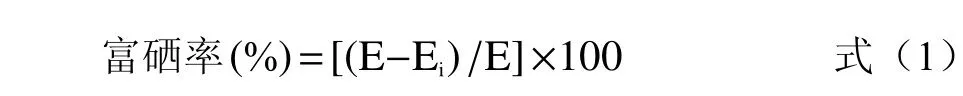
式中:E 为加入硒总量(μg);Ei为残留无机硒量(μg)。
1.2.7 富硒乳酸菌自由基清除率的检测 将富硒菌在适宜硒质量浓度下培养至对数后期,再以3%的接种量接种到不含硒的新鲜MRS 培养基中生长至稳定期(OD600值为2.10±0.02)。将菌液离心取上清,检测上清液的生物活性,未加硒组做相同处理。
1.2.7.1 DPPH 自由基清除率的检测 检测方法参考文献[15],略作修改。将上清液用无菌水稀释30 倍,取2 mL,加入2 mL 用无水乙醇溶解的0.2 mmol/L DPPH 溶液,摇匀,避光反应30 min,6000 r/min 离心10 min,取上清液测量波长517 nm 下的吸光值,DPPH 自由基清除率计算方法见下式。
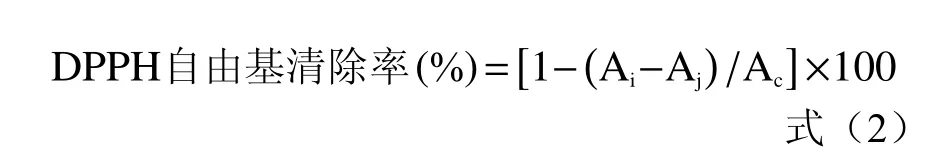
式中:Ai为离心的样液的OD 值;Aj为无水乙醇和样液等体积混合的OD 值;Ac为无水乙醇和等体积DPPH 混合的OD 值。
1.2.7.2 ABTS 自由基清除率的检测 检测方法参考文献[16],略作修改。将7 mmol/L ABTS 溶液与2.45 mmol/L 过硫酸钾混匀,于4 ℃放置12~16 h以制备ABTS+·溶液。用无水乙醇将ABTS+·溶液稀释直至其波长在734 nm 处的吸光度为0.70±0.02。将发酵上清液用无菌水稀释20 倍;取2 mL,加入2 mL ABTS+·溶液,摇匀后于室温下放置10 min,测量波长734 nm 处的吸光值,计算样品的自由基清除率[17]。
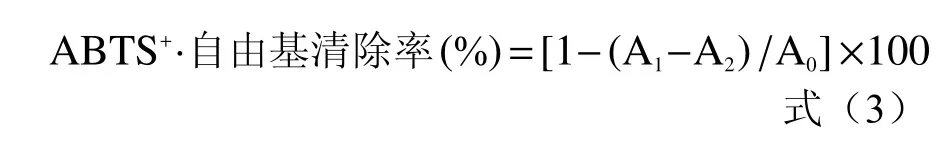
式中:A1为离心的样液的OD 值;A2为无水乙醇和样品的等体积混合液的OD 值;A0为无水乙醇和等体积ABTS+·溶液混合的OD 值。
1.2.8 富硒乳酸菌还原力的检测 检测方法参考文献[18],略作修改。将发酵上清液用无菌水稀释5 倍,取1 mL 加入pH 6.6 的PBS 缓冲液1 mL 和1%的铁氰化钾1 mL,50 ℃水浴20 min,急速冷却,再加入1 mL 的三氯乙酸,5000 r/min 离心5 min,取样液1 mL,加入1 mL 蒸馏水和1 mL 0.1%的三氯化铁溶液,混匀,静置反应10 min 后,测OD700,H2O 为空白。OD 值的大小与菌体的还原能力成正比。
1.2.9 富硒乳酸菌的胆盐耐受性检测 在MRS 培养基中加入0.0%、0.1%、0.2%、0.3%和0.4%的牛胆盐,将富硒菌以3%的添加量接种,37 ℃,24 h,测定菌液的OD600,对照组做相同处理。
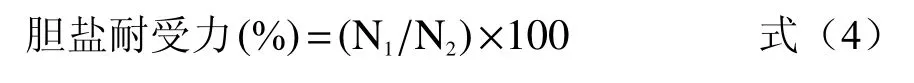
式中:N1为含胆盐的培养基OD 值;N2为不含胆盐的培养基OD 值。
1.2.10 富硒乳酸菌的人工胃液耐受性检测 人工胃液的配制[19]:0.20% NaCl,0.35%胃蛋白酶,用1 mol/L的HCl 调整pH 至2.0,灭菌后备用。
以3%的接种量,在无菌条件下吸取不加硒的MRS 培养基中培养至对数后期的乳酸菌菌液和在最适富硒浓度下培养至对数后期的菌液,8000 r/min,离心5 min,收集菌体,用无菌生理盐水洗涤菌体1 次,加入预先配制好的人工胃液4.5 mL,立即充分摇匀,于37 ℃培养箱中培养,分别在0 和2 h 取适量菌液,采用MRS 稀释涂布平板法,于37 ℃培养箱中培养48 h,计得活菌数,计算各菌株富硒前后在人工胃液中处理2 h 之后的存活率。
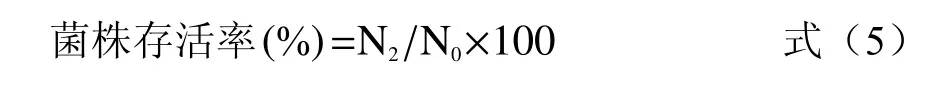
式中:N0:0 h 的活菌数(CFU/mL);N2:2 h 的活菌数。
1.3 数据处理
实验中的数据均为3 次重复,用SAS V8 分析显著性差异,Origin 8.5 绘制图表。
2 实验结果与分析
2.1 菌株的16S 鉴定结果
将分离得到的15 株菌的测序结果通过BLAST在GenBank 上核酸序列数据库中比对同源性,同源率98%以上的为有效结果。15 株菌均属于乳酸菌,鉴定结果见表1。
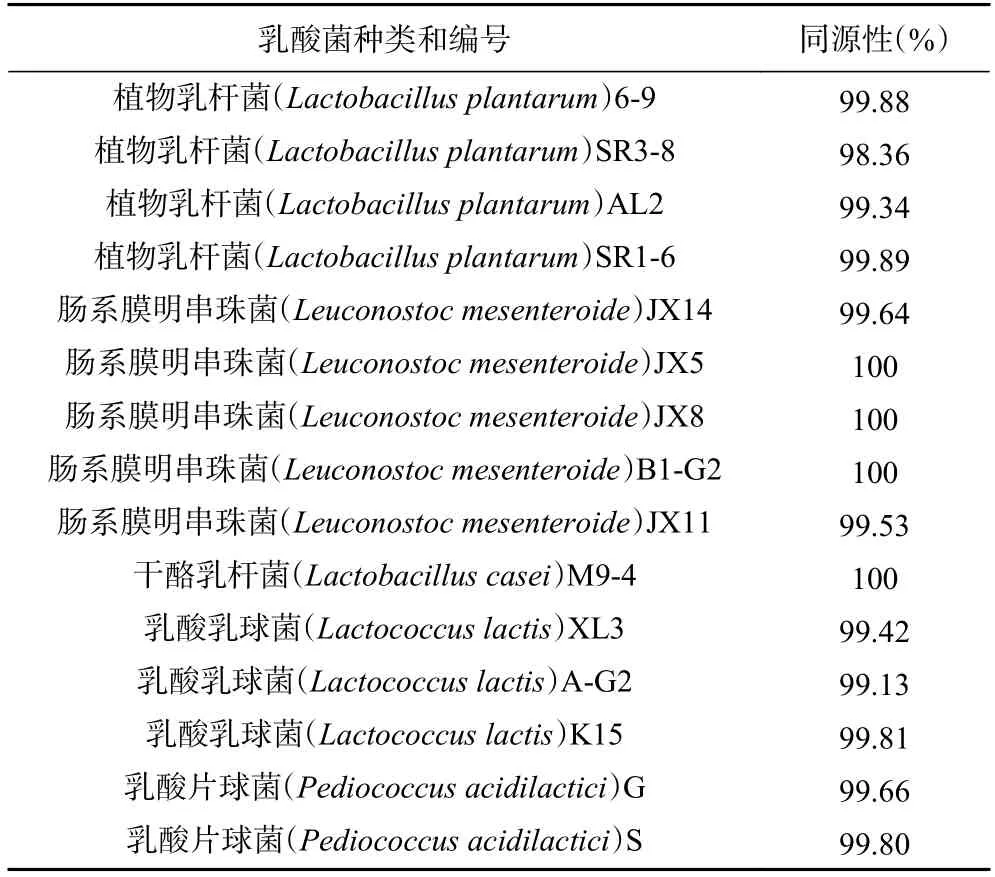
表1 菌株16s rDNA 系统发育分析Table 1 Phylogenetic analysis of 16s rDNA of strains
2.2 富硒乳酸菌的筛选
15 株乳酸菌在亚硒酸钠添加量为20 μg/mL 的MRS 液体培养基中菌体密度的变化情况见图1。由图可知,相较于未加硒的对照组,富硒组中菌株AG2、S 和JX11 的菌体OD 值显著降低(P<0.05),菌株SR3-8、B1-G2 和G 的OD 值极显著降低(P<0.01),其余9 菌株未见明显变化,与杨靖鹏等[16]的乳酸菌耐硒实验中有5 株菌在10 μg/mL 的亚硒酸钠质量浓度培养基中完全不生长相比,本实验所使用的菌株对低浓度的亚硒酸钠具有较高的耐性,可继续进行富硒试验。筛选得出富硒菌有JX5、JX14、6-9、K15、AL2、JX8、XL3、M9-4、和SR1-6。
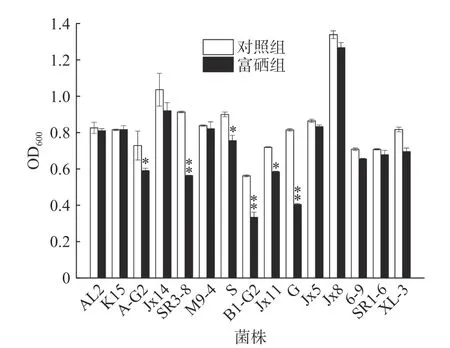
图1 富硒乳酸菌的筛选Fig.1 Screening of Se-tolerant LAB
2.3 加硒时间和培养时间的确定
生长曲线可以确定适宜的加硒时间和培养时间[20],9 株富硒乳酸菌培养24 h 对应的OD 值见图2。可以看出,各菌株生长速度略有不同,延滞期在2 h 内,2 h 之后进入对数期,除了菌株SR1-6 对数期持续时间较长,在第20 h 时进入稳定期之外,其余菌株均在16 h 到达稳定期。由于菌株对数期繁殖速率最快,富硒能力强,有机硒及单质硒转化率高,所以在这个时期加入硒源有利于硒的富集,而加硒时间越早,对菌体的生长代谢抑制作用越强,不利于硒的转化[21,11],因此把加硒时间定为对数前期。Suhajda等[14]研究酵母菌富硒时也曾发现,对数前期添加无机硒所得酵母的含硒量最高,并随着细胞增殖,富硒能力增强,随稳定期接近而减弱。考虑到实际生产中发酵效率,确定菌株JX5、JX14、6-9、K15、AL2、JX8、XL3、M9-4 和SR1-6 的加硒时间均为第2 h,JX5、JX14、6-9、K15、AL2、JX8、XL3、M9-4 的培养时间为16 h,SR1-6 的培养时间为20 h。
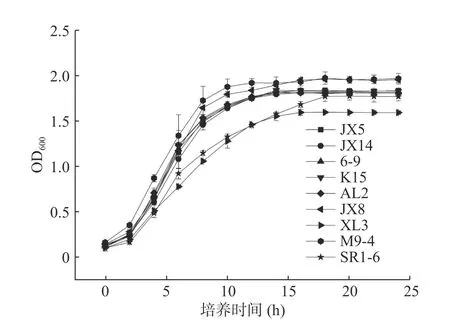
图2 富硒乳酸菌的生长曲线Fig.2 Growth curve of Se-resistant LAB
2.4 培养基中亚硒酸钠质量浓度对乳酸菌转化硒的影响
培养基中添加不同含量亚硒酸钠的富硒乳酸菌的生长情况见表2。由表可知,在亚硒酸钠浓度在40 μg/mL 以上时,菌体均有不同程度的变红,且变红的程度随着亚硒酸钠的浓度增加而加深。研究表明,乳酸菌自身具有解毒作用,可将富集的硒一部分转化为有机硒,而另一部分则可以被还原成零价态的单质硒,单质硒在溶液中呈红色[12,22]。孙会轻等[23]对古尼虫草的富硒作用研究发现,当硒浓度大于7 μg/mL时,古尼虫草对硒的富集由生理性转为病理性富集,且生物量和富硒率均极显著下降。刘韫涛等[24]经过试验证明,当硒浓度大于200 μg/mL 时,食用真菌对硒的富集就转变成病理性富硒,说明无机硒对真菌的生长产生了毒性。实验中,菌体变红则说明有单质硒转化出来,同时伴随有机硒的转化,且红色越深单质硒含量越高,相应转化出有机硒的含量就越少,因此需要在硒添加量和转化量之间有所平衡,即选择菌体显示微红色时为最适加硒浓度,此时的加硒量适中且单质硒转化量少,有机硒的转化量大,对菌体的伤害小。实验中所有菌株的最适亚硒酸钠浓度均定为40 μg/mL。
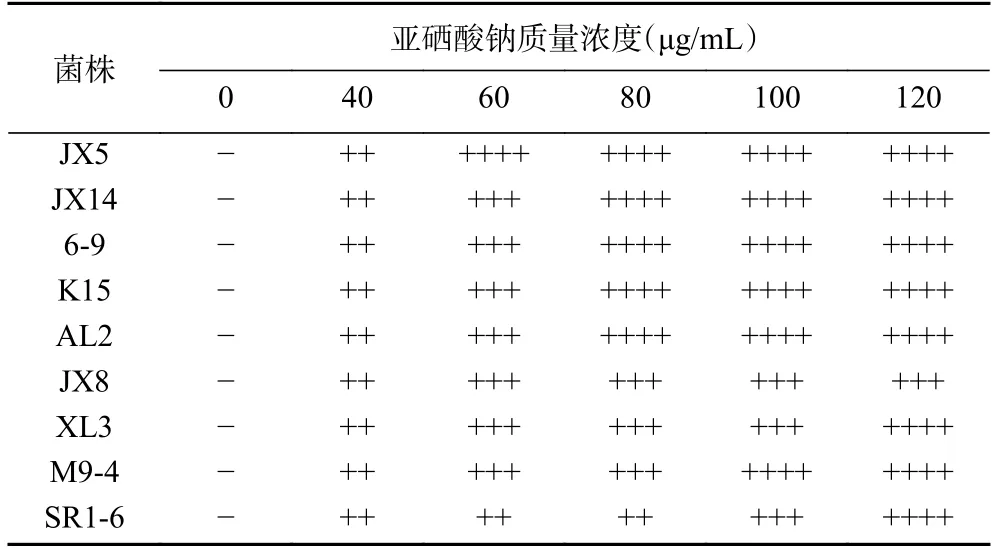
表2 培养基中亚硒酸钠质量浓度对菌体颜色变化的影响Table 2 Color changes of strains under different concentrations of sodium selenite culture
2.5 乳酸菌富硒率的研究
根据标准曲线的制作得出线性回归方程Y=0.0302X-0.0108,决定系数R2=0.9889。
培养基硒含量为40 μg/mL 时,9 株富硒菌培养至稳定期对应的培养基上清液中无机硒含量以及菌体富硒率如表3 所示。由表得知,菌株的富硒率各有不同,最高的是菌株JX5,达到81.80%,其次为AL2 和K15,富硒率为80.81%和80.23%,菌株JX14、6-9 和JX8 在70.00%~80.00%范围内,XL3、M9-4在50.00%~60.00%范围内,SR1-6 最低,为14.92%。6 株菌的富硒率都在70%以上,与朱和东等[25]研究的一株布氏乳杆菌的富硒率在56.52%相比,本文所使用的菌株具有较高的富硒能力。实验中测定的菌株富硒率是往培养基中添加的硒含量(总硒量)减去上清液中残留的无机硒含量所占总硒量的比值,实际上菌体在离心时并未将细胞膜上吸附的硒全部洗脱,还有少量残留,因此上清液中测得的无机硒含量比实际含量要低,即实验结果中的富硒率比实际富硒率高,实验得出的结果仅能极大限度地代表菌体实际富硒率。
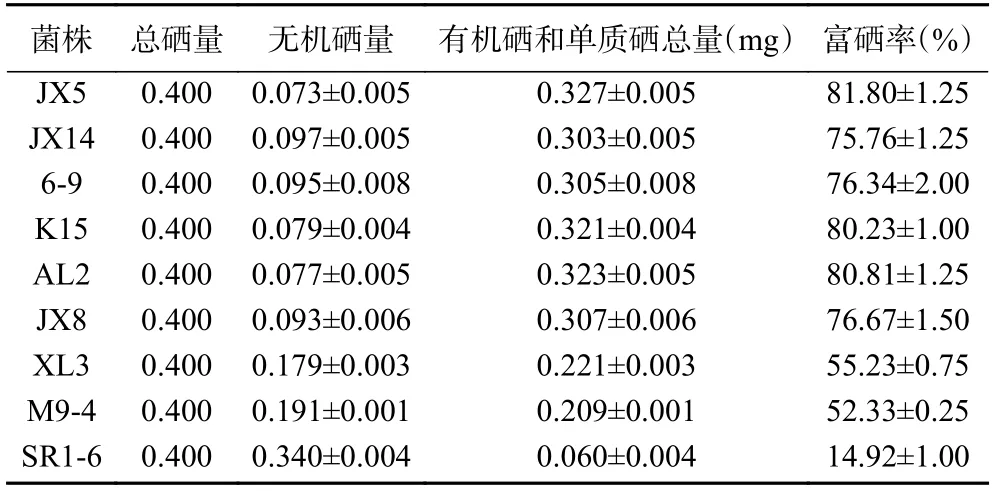
表3 不同菌株的富硒率Table 3 Se enrichment rates of different strains
2.6 富硒乳酸菌体外活性的研究
研究表明,乳酸菌所产生的活性物质的含量不仅在不同菌株间有差异,在不同部位也有较大差异,清除自由基以及具有还原力的物质主要释放到细胞外,在上清液中含量较高[26-27]。因此本实验选择两种较常见的DPPH、ABTS 自由基,检测对照组和富硒组乳酸菌发酵上清液清除自由基能力和还原能力,旨在检验富硒乳酸菌是否真正具有将无机硒转化为有机硒的能力。
2.6.1 富硒乳酸菌培养基上清液自由基清除率研究
2.6.1.1 富硒乳酸菌培养基上清液DPPH 自由基清除率 稀释30 倍的培养基上清液对DPPH 自由基的清除率实验结果见图3。由图可知,9 株菌中有5 株对DPPH 自由基清除率有显著的升高(P<0.05),其中菌株JX14、6-9、K15 和AL2 在富硒之后的清除率达到89%左右,JX5 为86.12%,比对照组提高了13.78%,在所有菌株中富硒之后清除率提升最大。清除率升高的原因可能是无机硒被乳酸菌转化为有机硒,与蛋白质或多糖结合成硒蛋白和硒多糖释放到胞外,Mao 等[28]研究了富硒蘑菇中硒蛋白和硒多糖的体外抗氧化活性,结果表明硒蛋白有良好的抗氧化能力,从而使得乳酸菌在富硒之后的DPPH 自由基清除率有所升高。
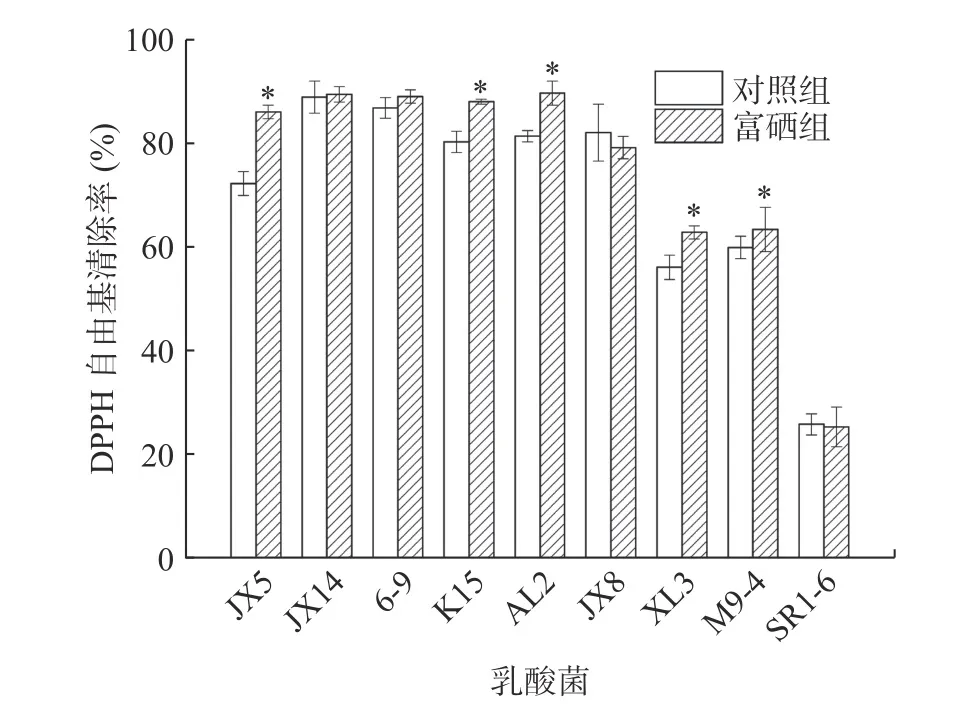
图3 富硒乳酸菌培养基上清液DPPH 自由基清除率Fig.3 DPPH radical scavenging rate of supernatant of Se-enriched LAB culture medium
2.6.1.2 富硒乳酸菌培养基上清液ABTS 自由基清除率 稀释20 倍的培养基上清液对ABTS 自由基的清除率实验结果见图4。可以看出,各菌株的清除自由基能力各异,其中JX5、K15 和M9-4 清除率升高极显著(P<0.01),比对照组分别提高了10.49%、11.11%和10.80%,菌株AL2 和SR1-6 清除率有显著提高(P<0.05),有些菌株提高不显著,可能因为不同菌株对自由基的亲和力不同,表现为清除率大小不同。根据上述实验证明,有机硒对清除自由基具有十分重要的意义。
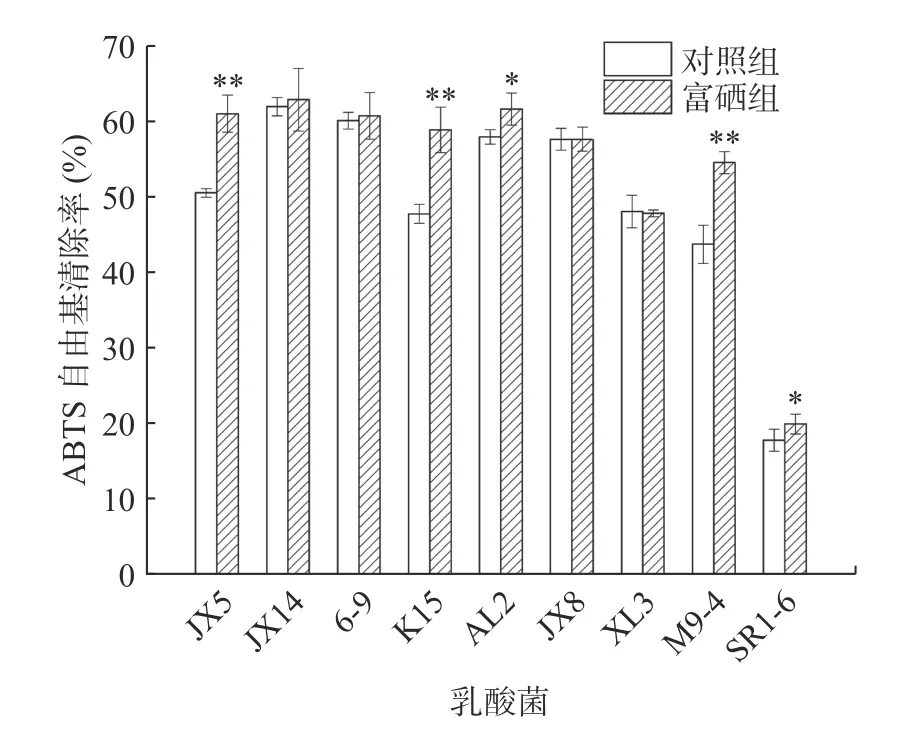
图4 富硒乳酸菌培养基上清液ABTS 自由基清除率Fig.4 ABTS radical scavenging rate of supernatant of Se-enriched LAB culture medium
2.6.2 富硒乳酸菌培养上清液还原力研究 还原力可以判定该液体是否为优良的电子供体,物质的还原力与抗氧化力呈正相关[29]。9 株富硒乳酸菌还原力的大小如图5 所示。相较于自由基清除率实验,乳酸菌富硒之后的还原力总体提升并不明显,其中菌株JX5 上清液还原力极显著增加(P<0.01)、XL3 和M9-4 显著增加(P<0.05)。庞聪颖等[30]实验证明在添加富硒乳酸菌后小鼠血清胆固醇、三酰甘油含量均显著降低,说明富硒乳酸菌可以缓解由玉米赤霉烯酮导致的氧化损伤,富硒之后还原能力有一定的提高。
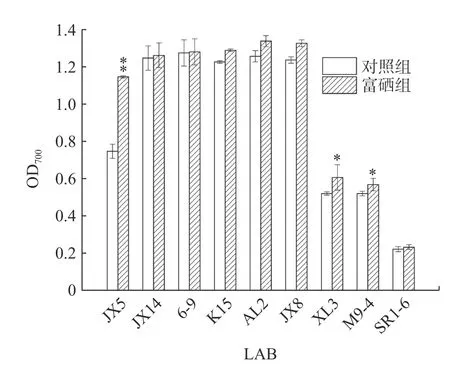
图5 富硒乳酸菌培养基上清液还原力Fig.5 Reductive power of Se-enriched LAB culture medium supernatant
2.6.3 富硒乳酸菌胆盐耐受力研究 乳酸菌等常用的益生菌是否能在体内发挥作用主要在于能否忍受胃的高酸环境以及胆盐耐受力的大小,因此为筛选益生菌,有些研究者已经把胆盐耐受力作为一项重要指标[31-32]。
通过实验结果得出,菌株在胆盐浓度为0.0%~0.3%的培养基中对照组和富硒组均生长较好,浓度为0.4%时乳酸菌生长尚好但OD 值差异明显,可作为适宜浓度用来分析结果,如图6 所示。9 株乳酸菌对胆盐的耐受力不同,相较于对照组,富硒组中菌株JX5 胆盐耐受力极显著增加(P<0.01),JX14、6-9、K15、AL2 和XL3 显著增加(P<0.05)。乳酸菌在生长代谢过程中能产生胆盐水解酶,自身能够耐受一定量的胆盐[33]。胆盐是由肝细胞分泌的胆汁酸与甘氨酸或牛磺酸结合而形成的钠盐或钾盐,研究表明,硒在人体内通常以带负电荷的形态存在,可以与带正电荷的金属离子结合,形成金属-硒-蛋白质复合物,最终把有害重金属离子排出体外,起到解毒作用[34]。由此说明乳酸菌在富硒之后对胆盐的耐受力增强。
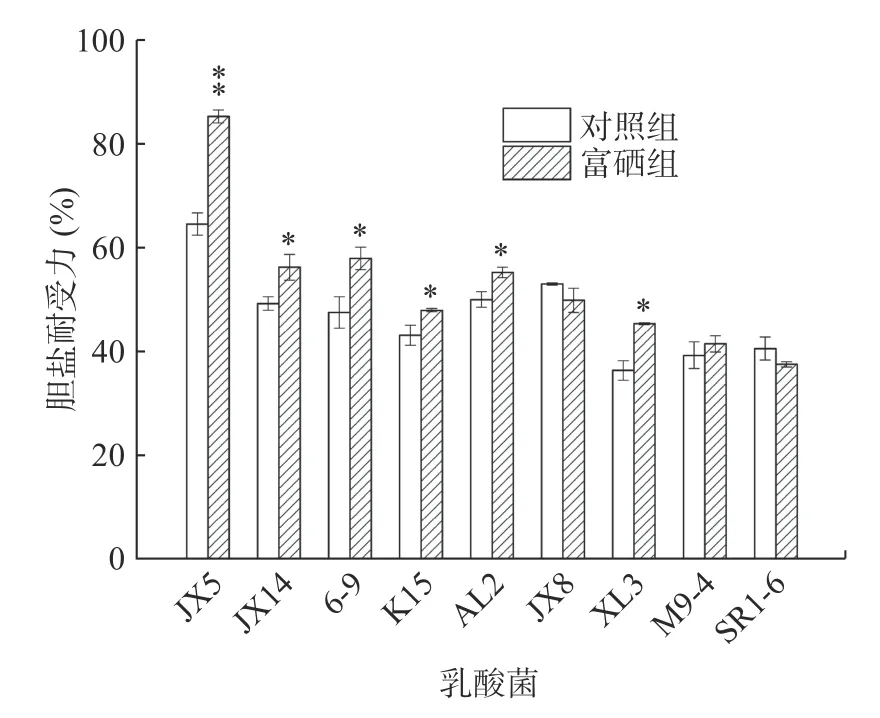
图6 富硒乳酸菌胆盐耐受力研究结果Fig.6 Tolerance of supernatant of Se-enriched LAB to bile salt
2.6.4 富硒乳酸菌人工胃液耐受力研究 将富硒前后的9 株菌进行耐胃液实验,测定菌体2 h 之后的存活率,结果见图7。可知,在未富硒的条件下,9 株乳酸菌有7 株的存活率大于1.00%,其中菌株JX5、6-9和M9-4 为11.24%、7.00%和5.21%;菌株SR1-6的存活率最低,仅有0.49%。经富硒之后,菌株JX5 和M9-4 的存活率显著增高(P<0.05),分别增加至20.33%和8.16%,说明该两株菌在富硒之后耐酸性更强。
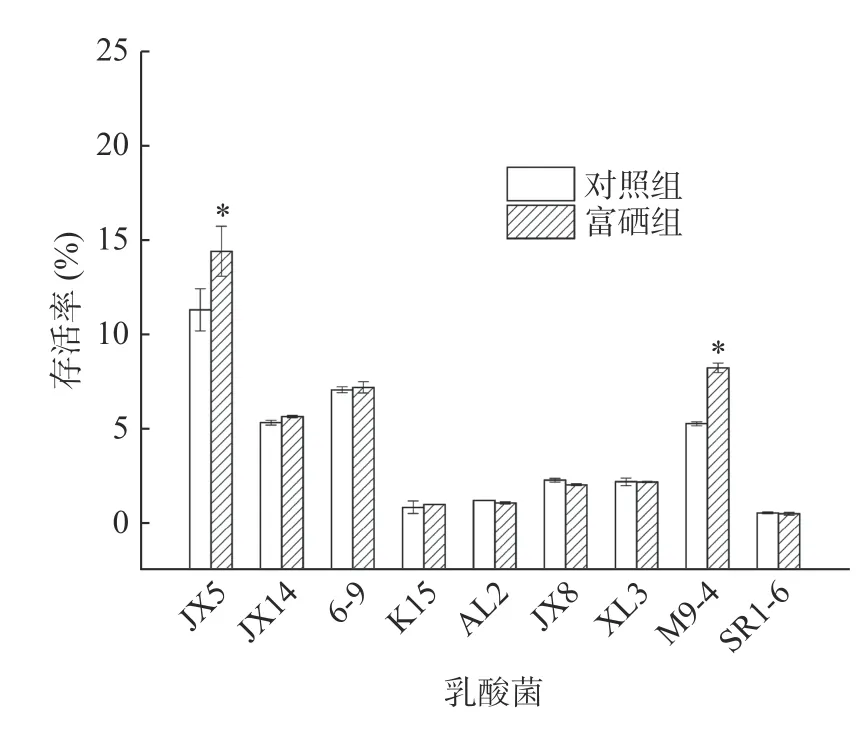
图7 富硒乳酸菌人工胃液耐受力研究结果Fig.7 Tolerance of Se-enriched LAB to artificial gastric fluid
3 结论
本实验从15 株乳酸菌中筛出9 株富硒菌,分别为植物乳杆菌6-9、AL2 和SR1-6;肠膜明串珠菌JX5、JX14 和JX8;干酪乳杆菌M9-4;乳酸乳球菌K15 和XL3。富硒率最高的是JX5,为81.80%,其次为AL2 和K15,富硒率为80.81%和80.23%,SR1-6 最低,为14.92%。通过对各菌株的自由基清除力、还原力和胆盐耐受性实验得出,在富硒之后,菌株JX5、K15、AL2、XL3 和M9-4 在清除DPPH自由基方面相较于对照组有明显升高;菌株JX5、K15、AL2、M9-4 和SR1-6 对ABTS 自由基的清除率有明显升高;菌株JX5、XL3 和M9-4 的还原力有明显升高;菌株JX5 和M9-4 的耐人工胃液性能增强;菌株JX5、JX14、6-9、K15、AL2 和XL3 的胆盐耐受力增强,说明乳酸菌具有一定的转化无机硒为有机硒的能力。
利用乳酸菌的转化力将无机硒转化为有机硒,并将有机硒提取出来,添加到食品、药品中,可作为保健品或护肤品的原料,但是真正应用到实际生产中依旧有很多问题待解决。本文从富硒菌的筛选和体外活性检测方面检测乳酸菌的富硒性能,为富硒乳酸菌的筛选和后续研究提供一定的参考,具体的转化机理和作用机制仍需进一步的探索和阐述。

