超高效液相色谱-串联质谱法测定茭白中井冈霉素的残留
张今君 林刚建 夏慧丽
(台州市食品检验检测中心,浙江台州318000)
井冈霉素是吸水链霉菌井冈变种产生的一种水溶性抗生素,是1973年上海农药研究所从江西井冈山地区土壤中分离得到的[1]。井冈霉素属于七碳氨基环醇类抗生素,在生物活性上表现为广谱的抗真菌活性,具有良好的防治植物病害的作用。经过40多年的农业应用,井冈霉素已经成为最成功的生物源杀菌剂之一,年产超过6万t,产值超过4亿元,可供近6 700万hm2使用[2],目前井冈霉素在我国登记作物有水稻、小麦、草坪。近年来由于氮素化肥使用增加等原因,纹枯病在全国各茭白种植地普遍发生,井冈霉素开始用于茭白中纹枯病的防治工作,且效果良好[3~4]。但目前井冈霉素在茭白中的使用评价工作还未推进[5],有关茭白样品中井冈霉素的检测方法也未见报道,因此,本文建立茭白中井冈霉素残留的检测方法,以期为茭白中井冈霉素的使用评价提供技术支持。
井冈霉素的检测方法有薄层层析法[6]、毛细管电泳法[7]、 气相色谱法[8~9]、 液相色谱法[10~12]、 液相色谱-串联质谱法[13~16]。薄层法用于定性分析,不能提供定量结果;毛细管电泳法检出限为0.2 μg/mL,灵敏度较低;气相色谱法测定井冈霉素需要衍生,过程繁琐;液相色谱法中井冈霉素在210 nm处有最大吸收,多数物质在此波长下会有吸收,易引起基质干扰,定性能力较差。超高效液相色谱串联质谱法(UPLC-MS/MS)将质谱的高选择性、高灵敏度与液相的高效分离能力相结合,近年来在农药检测中被广泛应用,本文应用固相萃取方法净化,亲水作用色谱(HILIC)分离,结合UPLC-MS/MS技术建立茭白中井冈霉素残留量的检测方法。
一、材料与方法
(一)材料与仪器
1.样品采集。茭白来自于市售。
2.标准品与试剂。井冈霉素(纯度86.0%,德国Dr.Ehrenstorfer公司);乙腈、甲醇、甲酸(色谱纯,德国Merck);去离子水,Milli-Q系统纯净水;Oasis HLB小柱,6 mL/200 mg,美国Waters公司。
3.仪器设备。QTRAP 5500三重四极杆-线性离子肼质谱系统,美国AB Sciex公司;UPLC液相色谱系统,日本岛津公司;Allegra X-30R冷冻离心机,美国贝克曼库尔特公司;涡旋混匀器,德国IKA;2150 TH超声波仪,上海安谱;PR 1602ZH/Z电子天平,奥豪斯电子天平有限公司。
(二)标准曲线绘制
1.标准储备液的配制。准确称取井冈霉素标准品10 mg(精确至0.01 mg),用水溶解并定容至10 mL容量瓶中,配制成浓度为1 mg/mL标准储备液, -18℃避光保存。
2.标准工作溶液的配制。准确吸取上述标准储备液0.1 mL置于10 mL容量瓶中,加水稀释并定容至刻度,配制成浓度为10μg/mL的标准中间液,于4℃避光保存。使用时用水配制成合适浓度标准工作溶液,现配现用。
3.标准工作曲线。按优化条件将稀释成合适浓度的标准工作液上机测试,以化合物浓度为横坐标,峰面积为纵坐标绘制标准工作曲线。
(三)仪器条件
1.色谱条件。Waters ACQUITY UPLC BEH HILIC柱(100 mm×2.1 mm,1.7μm)色谱柱,柱温为35℃,流速为300μL/min,进样体积为5 μL,流动相A为含0.1%甲酸水溶液,B为0.1%甲酸乙腈。洗脱条件见表1。

表1 梯度洗脱条件
2.质谱条件。电喷雾离子源(ESI源),正离子扫描(ESI+);多反应监测(MRM);电喷雾电压(IS)5 500 V;雾化气压力(GS1)50 psi; 辅助气压力(GS2)50 psi; 气帘气压力(CUR)35 psi; 离子源温度(TEM)500℃。化合物定量离子对498.2/178.2,定性离子对498.2/336.2,滞留时间100 ms,去簇电压(DP)100V,定量离子对碰撞能量(CE)36 eV,定量离子对碰撞能量(CE)32 eV。
(三)净化方式选择称取2.00 g(精确至0.01 g)粉碎均匀的空白样品18份,分成3组,每组6份,置于50 mL离心管中,分别添加2.5、10.0、50.0、100.0、200.0μg/L井冈霉素标准溶液各1 mL,加入9 mL甲醇,振荡离心后,移取上清液,上清液在45℃水浴中氮吹浓缩至2.5 mL以下待净化。实验以空白样品为对照,比较固相萃取、液液萃取、分散固相萃取3种净化方式对茭白中井冈霉素回收率的影响,重复测定3次。
1.固相萃取法:提取液转入经过预先处理的Oasis HLB小柱,用2 mL水淋洗柱子,收集全部流出液和淋洗液,加水定容至5.0 mL,混匀,过0.22μm滤膜,上机测试。
2.液液萃取法:提取液加水定容至5.0 mL,加入5 mL乙酸乙酯,涡旋振荡2 min,4 000 r/min离心5 min,弃去乙酸乙酯层,重复操作1次,过0.22μm滤膜,上机测试。
3.分散固相萃取法:提取液加水定容至5.0 mL,加入100mg PSA、100 mg C18,涡旋振荡2 min,4 000 r/min离心5 min,过0.22μm滤膜,上机测试。
(五)实测样品前处理
1.提取:称取2.00 g(精确至0.01g)粉碎均匀的样品,置于50 mL具塞离心管中,加入10 mL甲醇,剧烈振荡10 min,在4℃下6 000 r/min离心5 min,将上清液倾入15 mL离心管中,在45℃水浴中氮吹浓缩至2.5 mL以下待净化。
2.净化:将上述提取液转入经过预先处理的Oasis HLB小柱,用2 mL水淋洗柱子,收集全部流出液和淋洗液,加水定容至5.0 mL,混匀,过0.22μm滤膜,上机测试。
(六)基质效应将标准储备液分别用水和基质溶液稀释成0.5、2.0、10.0、20.0、50.0μg/L的标准工作液,上机测试,按照浓度和对应峰面积绘制线性方程。基质效应按公式(1)计算。
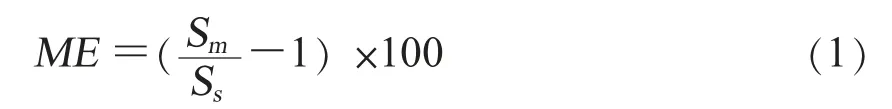
公式(1)中,ME表示基质效应的大小,当ME为正时为基质增强,当ME为负时为基质抑制;Sm为基质匹配标准溶液斜率,Ss为溶剂标准溶液斜率[17]。
二、结果与分析
(一)色谱条件的选择实验比较了BEH C18和BEH HILIC两种色谱柱对井冈霉素的保留能力和分离效果。用BEH C18分离时,井冈霉素在0.83 min出峰,响应强度为3 900 cps,保留能力差,响应较低;用BEH HILIC分离时,化合物保留能力及响应强度增强,出峰时间为3.25 min,响应强度为6 040 cps。因为井冈霉素是极性化合物,HILIC色谱柱配合高比例有机相流动相可有效改善极性化合物保留行为,同时提高电喷雾离子化效率,灵敏度上升。实验又比较了a组乙腈∶0.1%甲酸水;b组0.1%甲酸乙腈∶0.1%甲酸水;c组0.1%甲酸乙腈∶0.1%甲酸及10 mmol/L甲酸铵水3组流动相对色谱峰的影响,结果显示,a组流动相中,色谱峰形拖尾,响应较低;c组流动相中色谱峰形对称,但响应强度只有1 400 cps;b组流动相色谱峰形对称且响应强度高。因此本文选用BEH HILIC色谱柱配合0.1%甲酸乙腈∶0.1%甲酸水对茭白样品中井冈霉素进行分离。25μg/kg井冈霉素在两种色谱柱及3组流动相中的色谱图见图1。
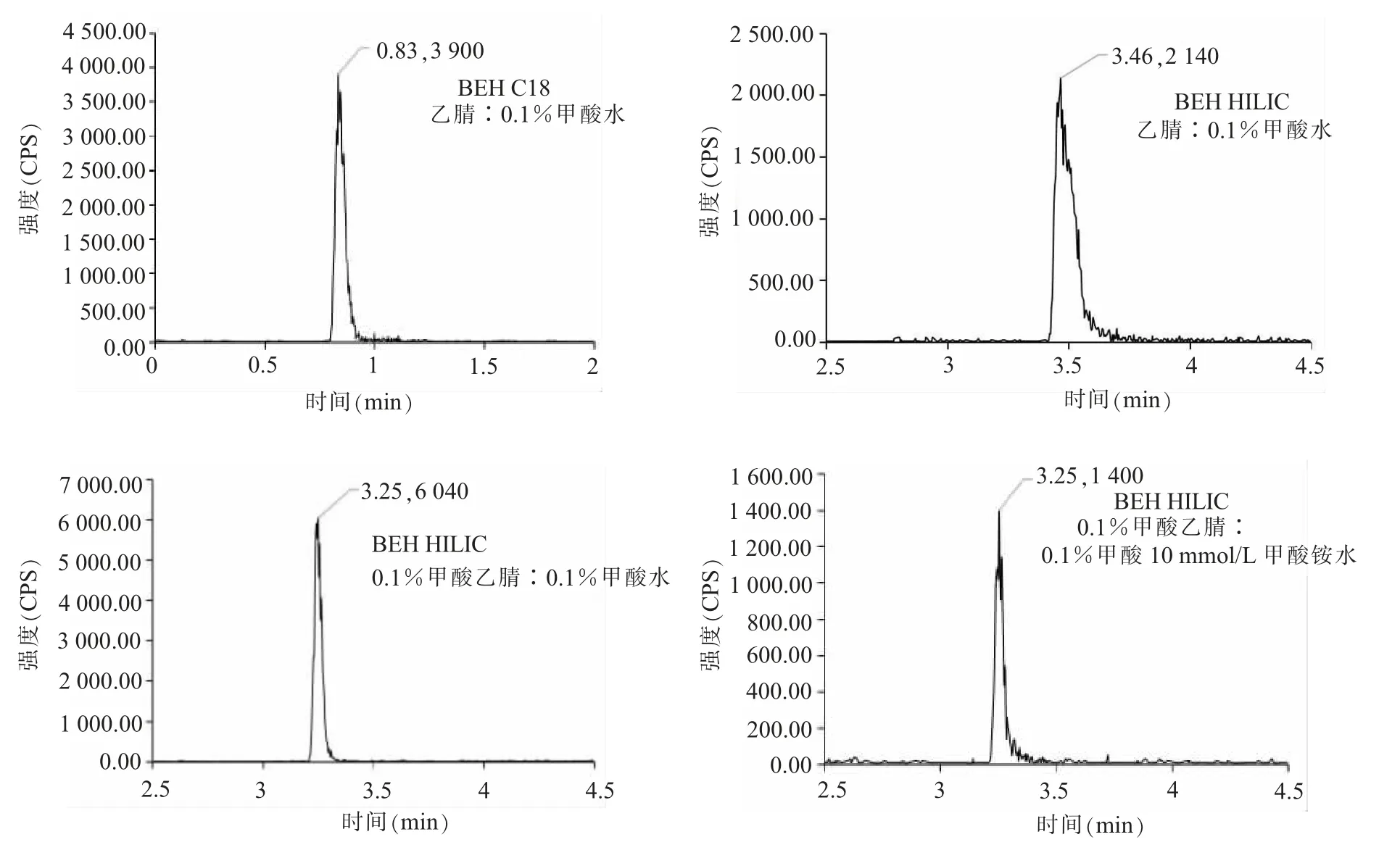
图1 25μg/kg井冈霉素在两种色谱柱及3组流动相中的色谱图
(二)净化条件的选择实验比较了固相萃取、液液萃取、分散固相萃取3种净化方式对茭白中井冈霉素回收率的影响,实验结果如图2所示,可以看出,固相萃取法中5个添加水平井冈霉素的回收率均较高,不同浓度水平间重复性较好,平均回收率为102.9%,标准差(SD)为4.5%;液液萃取法回收率比固相萃取法低,5个浓度水平平均回收率为88.4%,标准差(SD)为9.6%;分散固相萃取法平均回收率为45.5%,标准差(SD)为11.5%。3种净化方式中分散固相萃取法回收率最低,液液萃取法有机溶剂使用量较大,相比而言,固相萃取法溶剂使用量较少,且采用Oasis HLB色谱柱可有效去除茭白中蛋白、糖类等基质干扰,减少基质效应。因此本文采用固相萃取法对样品进行净化。
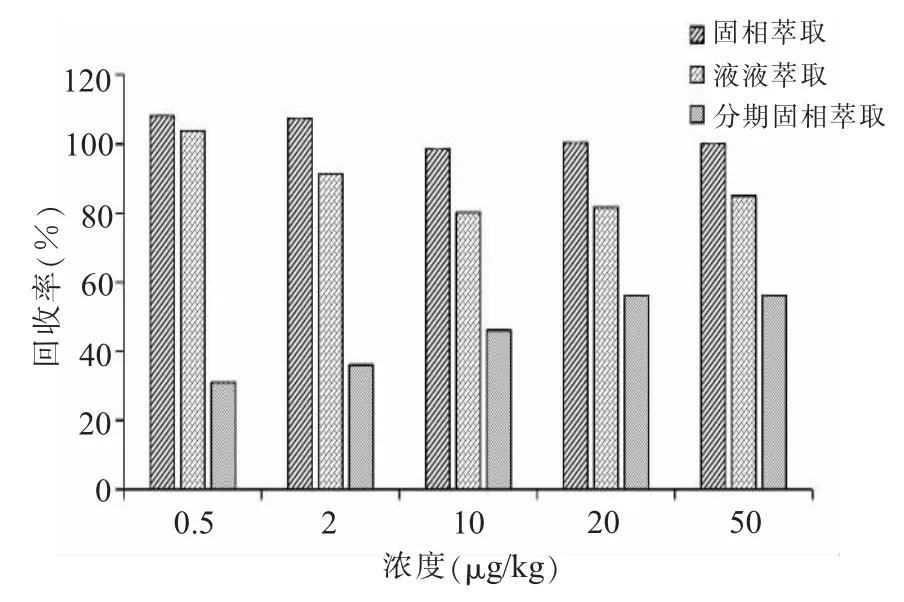
图2 3种净化方式对回收率的影响
(三)线性方程及基质效应按上述实验方法配制0.5~50.0μg/L浓度范围的溶剂标准溶液和基质匹配标准溶液,以定量离子峰面积对应相应浓度绘制标准曲线,获得各自线性方程,计算基质效应,结果见表2。结果显示,井冈霉素在0.5~50.0μg/L浓度范围内线性关系良好,相关系数为0.999 9。基质效应为0.3%,基质增强效应小,选择纯水配制标准工作溶液。
(四)方法的灵敏度、准确度和精密度利用茭白空白基质进行定量限的考察,以10倍信噪比确定井冈霉素定量限;在茭白空白基质中分别按5.0、10.0、50.0μg/kg 3个浓度水平进行加标回收实验,重复测定6次。结果表明,在5.0~50.0μg/kg浓度范围内,井冈霉素在茭白中的平均回收率为98.5%~107.4%,相对标准偏差为2.2%~2.8%,方法定量限为5.0μg/kg。方法精密度和回收率均满足GB/T 27404-2008《实验室质量控制规范食品理化检测》标准[18]要求。具体数据见表3。

表2 不同溶剂中线性方程及基质效应
(五)实际样品测定应用建立的方法对茭白样品中的井冈霉素残留量进行测定,40批次样品中检出井冈霉素3批次,检测结果分别为9.2、10.5和8.8μg/kg。
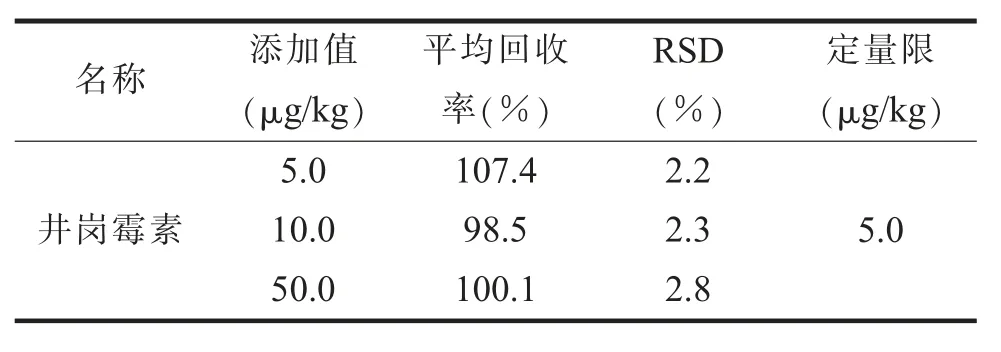
表3 井冈霉素的回收率、标准偏差及检出限等(n=6)
三、结论
本文选用Oasis HLB小柱固相萃取净化,BEH HILIC色谱柱分离,结合超高效液相色谱-串联质谱技术,建立了茭白中井冈霉素残留量的检测方法。结果表明,井冈霉素在0.5~50.0μg/L浓度范围内的线性关系良好,相关系数为0.999 9,3个添加水平的回收率范围为98.5%~107.4%,相对标准偏差为2.2%~2.8%,定量限为5.0μg/kg,满足相关标准规范要求。本方法灵敏度高,选择性好,适用于茭白样品中井冈霉素的定性和定量检测。

