靶向心肌组织的新型腺相关病毒载体的构建及筛选
陈 晨, 杜增民, 吴 侠, 蒋 威, 赵 阳, 肖 啸, 郑 静
(华东理工大学药学院,上海 200237)
心肌病属于一组异质性心肌疾病,是导致患者过早死亡的主要原因,常见症状为心力衰竭、外周水肿、疲劳、劳累呼吸困难、阵发性夜间呼吸困难、晕厥和心脏缺血等[1-3]。常规的治疗包括使用β受体阻滞剂、血管紧张素转换酶抑制剂、手术治疗和外科治疗。但是常规的治疗方法预后不太理想,严重时更需要进行心脏移植[1,4],治疗难度大、风险高,而基因治疗的发展为心肌病持久治疗或治愈提供了新的可能。
腺相关病毒(Adeno-Associated Virus,AAV)是目前心脏基因传递最有效的载体[5-6]。天然的AAV血清型,例如AAV1、AAV6和AAV9能够在小鼠静脉注射后转导到心肌[7-8],而AAV6直接心肌内注射最迅速,转导效率最为高效[9-10],静脉注射会较多地转导到成年小鼠骨骼肌和肝脏中[11-12]。转导过程中AAV载体会感染其他组织,AAV6会感染较多的骨骼肌,AAV9会大量地感染肝脏,这会造成不必要的脱靶危险,所以降低其他组织的特异性十分必要[13-15]。对于特定的疾病,则需要基因载体在特定的细胞和组织中表达,在AAV载体的构建中,使用特异性启动子能够减少AAV载体全身性的表达,可避免目的基因在细胞或组织中有害表达[16],因此,开发新的能够靶向心肌的同时减少非心肌组织感染的AAV载体非常重要,可以减少心肌病基因治疗中的副作用[17]。
AAV基因组由rep基因和cap基因以及两侧的末端重复序列(ITR)基因构成[18]。其中rep基因编码涉及病毒复制、包装和基因组整合的非结构蛋白,而cap基因编码包括3个衣壳结构蛋白VP1、VP2和VP3[19]。从人类和猴子中分离出的大量AAV血清型和其突变体在不同组织上表现出不同的感染性。AAV血清型特异性的主要决定于受体、辅助受体、转导效率等因素[20-21],AAV衣壳的特异性为新型AAV载体的研究和筛选打下了基础[22]。DNA shuffling技术常用来做AAV衣壳载体的改造,得到突变体AAV衣壳库可以被用来筛选理想的载体,例如低中和抗体水平[23-24]和特定组织亲和性[25]的AAV衣壳。
本研究通过DNA shuffling技术和小鼠体内筛选技术设计了心肌靶向的AAV衣壳,对AAV血清型AAV1~AAV4, AAV6~AAV9的cap基因进行了重组,构建了突变体AAV衣壳文库;同时根据AAV在心肌中高靶向性和肝脏中低靶向性的原则,将AAV衣壳文库在小鼠体内进行了两轮筛选,最终筛选到了AAVH50与AAVH59两种衣壳,并且对其在小鼠模型和原代大鼠新生心肌细胞(Primary Neonatal Rat Cardiomyocytes,PNRC)中进行检测,验证了其在心肌靶向性和心肌以外组织的非靶向性。
1 实验部分
1.1 实验材料
8种天然AAV载体(AAV1、AAV2、AAV3B、AAV4、AAV6、AAV7、AAV8、AAV9)、pAAVCMV-GFP、pAAV-CMV-Luc、phelper为华东理工大学新药设计与研发重点实验室保存;大肠杆菌TOP10购于全式金生物;Taq聚合酶、T4连接酶、DNase I酶购于Takara公司;限制性内切酶HindIII和NotI购于Takara公司;HEK293细胞为ATCC(美国菌株保藏中心)保存;胎牛血清(FBS)、DMEM培养 基(Dulbecco’s modified eagle medium)、双 抗(Penicillin-Streptomycin)及胰蛋白酶(2.5 g/L)均购于Biological Industries公司;Benzonase酶购于HaiGene公司;碘克沙醇购于Sigma-Aldrich公司;C57BL/6J小鼠购于杰思捷实验动物公司。
1.2 实验仪器
高速离心机(日本日立公司,Sorvall LYNX型);台式离心机(美国Thermo Fisher公司,FRESCO17型);超速离心机(美国Thermo Fisher公司,Sorcall WX100+型);蛋白纯化仪(美国GE公司,AKTA pure 150型);超净工作台(苏净安泰公司,SW-CJ-2FD型);PCR仪(美国ABI公司,Veriti DX型);qPCR仪(德国耶拿公司,qTOWER3G touch型);活体成像系统(上海锐珂医疗公司,In-vivoMultispectral System FX型);荧光显微镜(德国LEICA公司,DMC4500型)。酶标仪(美国bio Tek公司,Synergy 2型)。
1.3 实验方法
1.3.1 突变体AAV衣壳文库的构建 用AAV1、AAV2、AAV3B、AAV4、AAV6、AAV7、AAV8和AAV9为PCR模板。用引物F1(5′-CCCAAGCTTCGATCATA CGCAGAGAGTACCAA-3′)与R1(5′-ATAAGAATG CGGCCGCAGAGACCAAAGTTCAACTGAAACGA-3′)来进行衣壳基因的扩增,并将8种AAV载体经扩增得到的DNA片段进行等比例混合,在15 ℃下,用DNaseI处理,DNA片段化后进行琼脂糖凝胶电泳、对300~1 000 bp的片段胶回收,加入DNA聚合酶变性,再退火重新组装随机衣壳基因。将产物稀释后,用DNA聚合酶和引物F1/R1来进行PCR(Polymerase Chain Reaction),PCR产物与含有ITR的AAV2衣壳质粒用HindIII和NotI进行双酶切,将PCR产物的基因与AAV2骨架进行连接,连接DNA产物转化到TOP10大肠杆菌,随机选择克隆进行单克隆培养和扩增,得到重组衣壳基因的突变体AAV质粒文库。将突变体AAV质粒文库使用Muller等[26]开发的包装技术,制备了多种突变体AAV衣壳,将其按相同的比例混合得到突变体AAV衣壳文库。
1.3.2 小鼠体内突变型AAV衣壳文库的直接筛选将5×1011vg的突变体AAV衣壳文库注射入成年C57BL/6J小鼠体内。3 d后处死小鼠,使用磷酸盐缓冲液灌流将组织中的血液去除,从心脏和肝脏组织提取DNA,用Taq聚合酶进行PCR扩增DNA,扩增后筛选在心肌中出现频率较高但在肝脏中出现频率低的AAV衣壳,再将这些AAV衣壳按相同比例混合,产生二级AAV衣壳文库,再次通过小鼠尾静脉注射,用相同的方法进行了两轮体内筛选后,最终得到目的AAV衣壳。
1.3.3 小鼠各个组织基因表达检测 衣壳(AAVH50、AAVH59、AAV9、AAV6)、pAAV-CMV-Luc报告基因以及辅助质粒phelper进行三质粒共转染HEK293细胞,从而得到AAVH50-CMV-Luc、AAVH59-CMVLuc、AAV9-CMV-Luc、AAV6-CMV-Luc 4个载体。将含有CMV-Luc报告基因的AAVH50、AAVH59、AAV9、AAV6载体以3×1011vg的剂量通过尾静脉注射C57BL/6J小鼠。3周后,对注射AAVH50、AAVH59、AAV9病毒的小鼠进行活体成像。取AAVH50、AAVH59、AAV9、AAV6病毒注射的小鼠的各个组织。用荧光素酶法检测报告基因的表达。提取心脏和肝脏的总DNA,用QPCR(Real-time Quantitative PCR)进行定量。
1.3.4 原代大鼠新生心肌(PNCR)细胞实验 衣壳(AAVH50、AAVH59、AAV9、AAV6)、pAAV-CMV-Luc/pAAV-CMV-GFP报告基因以及辅助质粒phelper进行三质粒共转染HEK293细胞,从而得到AAVH50-CMV-Luc、AAVH59-CMV-Luc、AAV9-CMV-Luc、AAV6-CMV-Luc、AAVH50-CMV-GFP、AAVH59-CMV-GFP、AAV9-CMV-GFP、AAV6-CMV-GFP 8种载体。将含有CMV-Luc的AAVH50,AAVH59,AAV6,AAV9载体与含有CMV-GFP的AAVH50,AAVH59,AAV6,AAV9载体分别感染大鼠原代心肌细胞,72 h后对细胞进行荧光素酶活性检测和荧光成像检测不同血清型介导GFP基因表达。
1.3.5 统计学分析 对所有数据均进行至少3次平行实验,实验数据表示为平均值±标准差(mean±SD),并用Prism 7.0统计分析软件进行数据分析。选用T检验用于组间比较,p<0.05被认为是差异显著,p<0.01被认为是差异极显著。
2 结果与讨论
2.1 体内AAV突变体库的建立与心肌靶向性衣壳的筛选。
突变体AAV衣壳文库与小鼠体内筛选的结果如图1所示。由图1(a)可见,构建了随机AAV质粒文库后,连接到含有ITR的AAV2载体,对随机筛选的突变型AAV衣壳基因进行DNA限制性酶切分析(图1(b)),结果表明绝大多数随机筛选出的AAV衣壳基因包装AAV衣壳可行。接下来进行了突变体AAV载体文库三质粒包装。在成年小鼠体内进行突变体AAV衣壳文库的生物筛选,尾静脉注射剂量为5×1011vg的AAV衣壳文库,获取心肌中丰富且肝脏中较少的克隆。在两轮筛选后,得到了两个名为AAVH50与AAVH59具有心肌靶向潜力的AAV衣壳。
2.2 AAVH50和AAVH59衣壳序列分析
用软件Align X将AAVH50与AAVH59的测序结果与AAV1~AAV4、AAV6~AAV9的衣壳序列经过对比和筛选,结果如图2所示。结果表明AAVH50衣壳蛋白VP1的氨基酸序列由AAV1(583~736)、AAV2(1~79)、AAV3B(80~123)、AAV6(344~582)、AAV7(222~309)、AAV8(178~221)和AAV9(124~177、210~221、310~343)的衣壳部分序列组成。AAVH59由AAV3B(1~65、262~327)、AAV6(147~261、328~735)与AAV8(66~146)衣壳的部分序列组成。
2.3 AVV9、AAVH50、AAVH59介导Luc基因在小鼠体内表达情况
C57BL/6J小鼠尾静脉分别注射3×1011vg的AAV9-CMV-Luc、AAVH50-CMV-Luc、AAVH59-CMVLuc后,通过活体成像检测体内荧光素酶活性结果如图3所示。结果表明AAV9在小鼠肝脏中有明显的Luc基因表达,但是AAVH50和AAVH59在肝脏中的基因表达低于AAV9,并且在心脏处均有明显的基因表达,而且AAVH50在心脏处表达效果要好于AAVH59。
2.4 AAV6、AVV9、AAVH50、AAVH59衣壳载体在小鼠体内各个组织转导效率以及心脏与肝脏的转导效率对比
为了探究不同衣壳载体在各个组织的转导效率,小鼠尾静脉分别注射3×1011vg的AAV9-CMVLuc、AAV6-CMV-Luc、AAVH50-CMV-Luc、AAVH59-CMV-Luc后,对比了11种小鼠组织中的荧光素酶的活性,结果如图4(a)所示。结果表明,在心脏、胫骨前肌(Tibialis anterior,TA)、前肢、隔膜肌(Diaphragm,DIA)中,AAVH50、AAVH59的表达均低于AAV9(p<0.05)的表达,在肝脏、肺部、肾脏中AAVH50、AAVH59的表达均低于AAV9和AAV6(p<0.05)的表达,在胫骨前肌中,AAVH50的表达低于AAV6的表达(p<0.05),在腓肠肌(Gastrocnemius GAS)中AAVH50表达比AAV9的表达低(p<0.01),在股肌中AAVH50的表达高于AAV6的表达(p<0.05),在脾脏中AAVH59的表达低于AAV6的表达(p<0.05),在胰脏中表达AAVH50低于AAV9(p<0.05),同时发现,与AAV6、AAV9、AAVH50相比,AAVH59在肝脏中的表达水平极低。将4种AAV衣壳载体在心脏与肝脏荧光素酶基因的表达进行比较,结果如图4(b)所示,AAVH50在心脏与肝脏表达的比率为17∶1,AAVH59在心脏与肝脏的表达比率为35∶1,AAV9和AAV6在心脏与肝脏中的比率为分别1∶2和1∶4,结果发现AAVH50与AAVH59心肝表达比显著性高于AAV6与AAV9(p<0.01)。
通过提取心脏和肝脏中的DNA,研究了尾静脉注射后,小鼠的心脏和肝脏中的载体基因拷贝数,结果如图5(a)所示。由图可见,AAVH59在小鼠心脏中的载体DNA的拷贝数低于AAV6的拷贝数(p<0.01),AAVH50的小鼠肝脏中的载体DNA拷贝数低于AAV9和AAV6的拷贝数(分别低169倍和30倍,p<0.01),AAVH59在肝脏拷贝数更加低于AAV9和AAV6的拷贝数(分别低55 000倍和9 830倍,p<0.01),表明AAVH59在肝脏中的表达极低。将4种AAV的心脏与肝脏载体DNA拷贝数的进行比较(图5(b)),结果显示,AAVH50在心脏与肝脏载体拷贝数的比率高于AAV9(p<0.01)和AAV6的比率(p<0.05),AAVH59显著高于AAV9和AAV6(p<0.01),荧光素酶与DNA拷贝数在小鼠心脏和肝脏比率两个方面具有相似的趋势。因此,表明了AAVH50在心脏中表达与AAV6和AAV9表达相近,AAVH59在心脏中表达低于AAV6表达,但两者在肝脏中的表达的均低于AAV6和AAV9表达,同时AAVH59在肝脏中的表达极低,两个新筛选出的载体均在心脏有较好地表达,同时在肝脏中的表达很低。
2.5 AAV6、AVV9、AAVH50、AAVH59在PNRC细胞中的转导效率
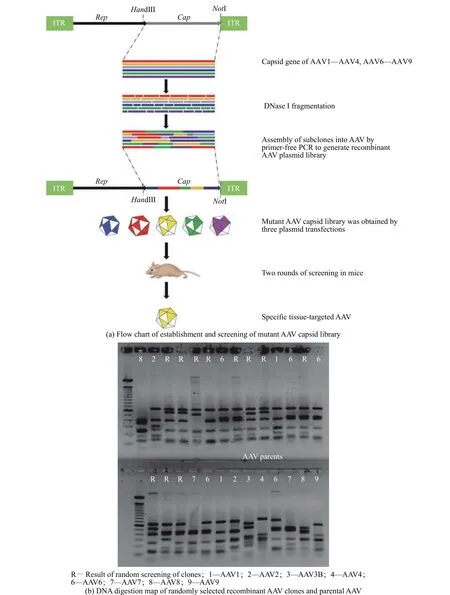
图1 DNA shuffling技术构建突变体AAV衣壳文库与小鼠体内筛选Fig. 1 Construction of mutant AAV capsid library by DNA shuffling technology and in vivo screening in mice
为了体外模拟直接心肌注射的效果,直接对比AAV6、AVV9、AAVH50和AAVH59在大鼠原代心肌细胞中的转导效率。如图6(a)所示,以MOI(Multiplicity of Infection)为1×104和1×103的比例加入AAVH50-CMV-Luc、AAVH59-CMV-Luc、AAV6-CMV-Luc、AAV9-CMV-Luc,利用荧光素酶试剂盒进行荧光素酶含量检测,发现与AAV6直接感染的效率最高,AAVH50直接感染的效率较差,AAVH59感染效率随着MOI(Multiplicity of infection)增加,呈现显著上升的趋势(p<0.05)。
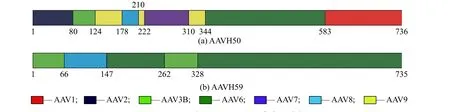
图2 AAVH50与AAVH59的衣壳序列分析Fig. 2 Sequence analysis of the AAVH50与AAVH59 capsid
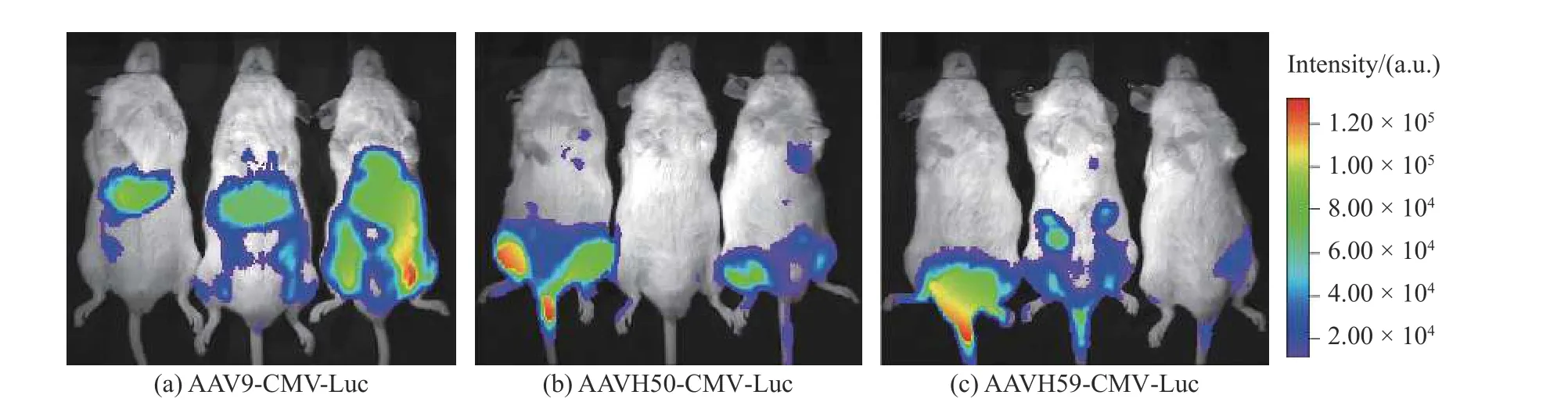
图3 注射AAV9-CMV-Luc、AAVH50-CMV-Luc、AAVH59-CMV-Luc后小鼠荧光素酶活体成像。Fig. 3 In vivo imaging of mouse luciferase after injection of AAV9-CMV-Luc、AAVH50-CMV-Luc、AAVH59-CMV-Luc
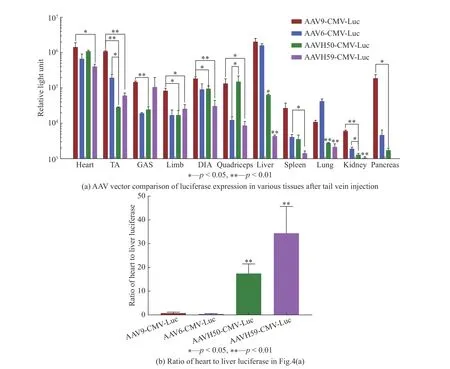
图4 尾静脉注射AAV载体后各种小鼠组织中的荧光素酶活性Fig. 4 Luciferase activity in various mouse tissues after tail vein injection of AAV vector
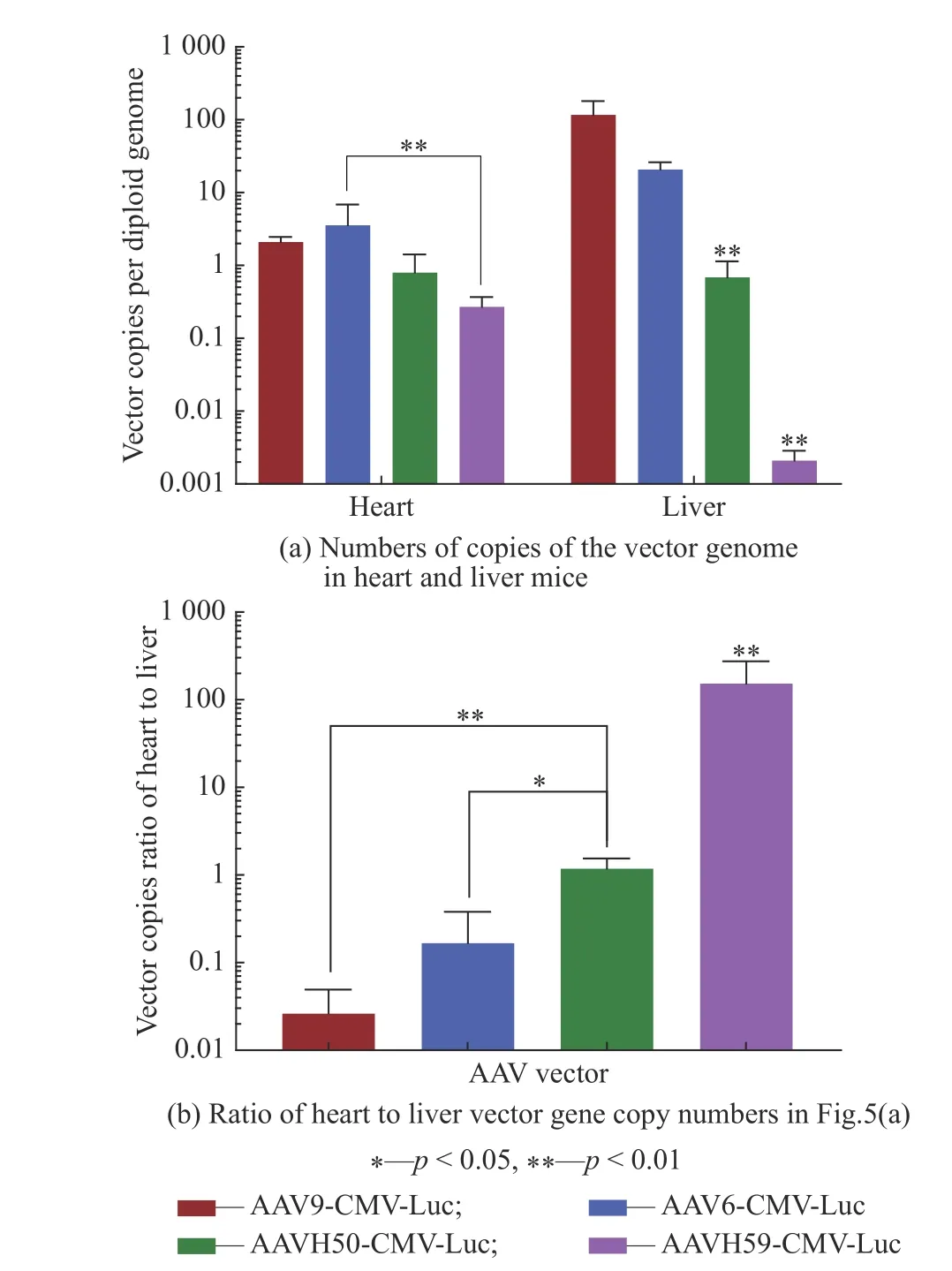
图5 尾静脉注射AAV载体后各种小鼠组织中载体基因组拷贝数Fig. 5 Vector genome copy numbers in various mouse tissues after tail vein injection of AAV vector
加入AAV9-CMV-GFP、AAV6-CMV-GFP、AAVH50-CMV-GFP、AAVH59-CMV-GFP感染大鼠心肌细胞,当MOI值均为1×104时进行GFP荧光检测,结果如图6(b)所示,结果表明每个AAV载体的GFP荧光表达从高到低排序为AAV6,AAVH59,AAVH50和AAV9,与荧光素酶的结果呈相同的趋势。
3 讨 论
心肌疾病的基因治疗,以AAV作为基因治疗的载体具有一定的优势,AAV易于实现长期持久的心肌表达,同时AAV不能自主复制,免疫原性低,较少引发免疫反应,所以AAV载体能够具有心肌基因治疗的潜力。虽然现有的AAV6与AAV9能够有着较强的心肌表达效果[9,12],但是它们组织特异性较差,基因转导心肌的同时会转导到心肌外的其他组织,尤其是肝脏[27]。本研究尝试通过衣壳改造来解决AAV心肌特异性低的问题。
本研究通过DNA shuffling构建了AAV衣壳基因文库,并在体内进行了直接筛选。主要优点是避免了体外筛选的偏差与局限性。为了减少AAV在肝脏的靶向性,提高体内筛选特异性,根据载体在心脏、肝脏出现的频率作为筛选依据应该是最理想和可行的策略[28]。研究结果表明:本研究成功地筛选到了心肌靶向性高且其他组织感染少的两个载体AAVH50与AAVH59。同时,AAVH50与AAV9的心肌感染方式较为类似,尾静脉注射转导心肌的效率较高,AAVH59与AAV6较为类似,直接感染具有较好心肌转导效率(图4、5、6(a))。
对比图3中Luc的活性与图4中病毒拷贝数,发现AAV9, AAVH50和AAVH59的变化趋势相同,但是AAV6的结果出现了不一致的情况,可能是由于病毒拷贝数检测使用的是qPCR定量的方法,反映的是AAV的转导情况,而Luc的活性检测则为AAV转导后的DNA表达情况,因为不同血清型AAV在小鼠体内存在差异性,导致AAV6的Luc的活性与病毒拷贝数不一致。
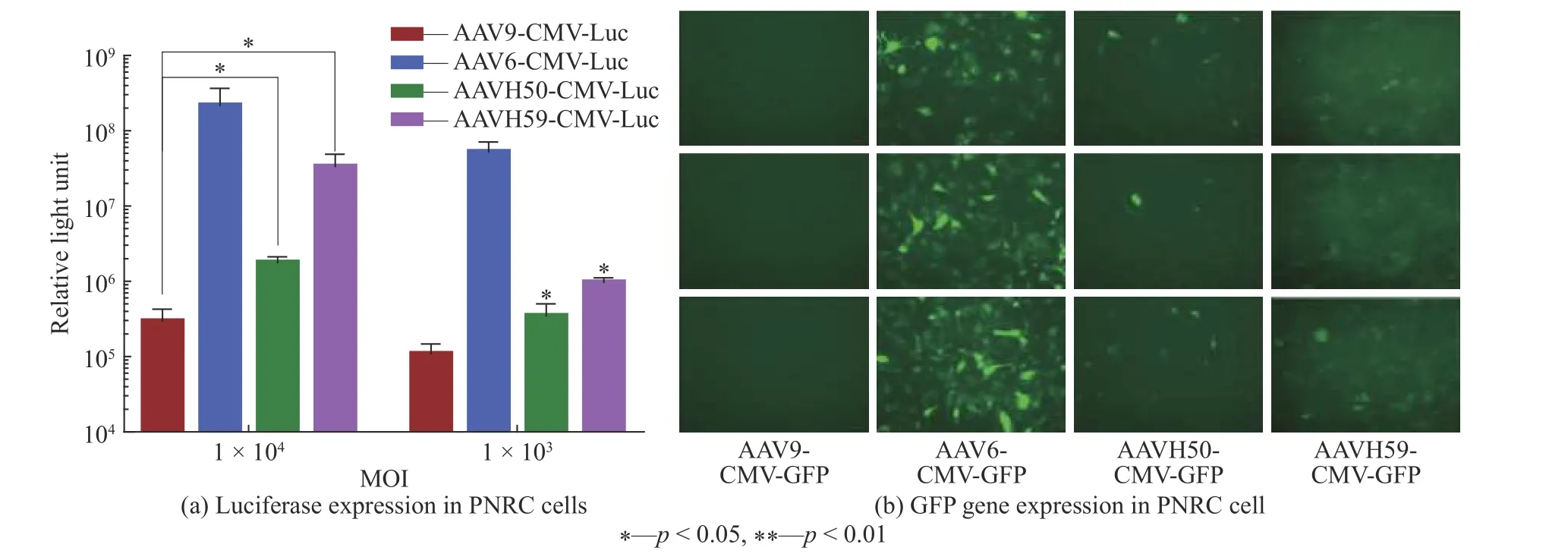
图6 不同AAV载体在原代心肌细胞上的转导效率Fig. 6 Transduction efficiency of different AAV vectors on primary cardiomyocytes
由图6可见,AAV6的Luc表达远高于AAV9、AAVH50,对比图3可以发现,AAV9与AAVH50的值变化不大,而AAV6、AAVH59有非常明显的增加,可能是AAV6通过尾经脉注射,难以透过血管,导致在心肌中的表达受限[11]。但是在对于直接感染心肌组织,AAV6能够快速和高效地转导到啮齿动物心肌[10]。通过GFP荧光的验证,同时也证明了AAV6直接感染心肌细胞具有较高表达,而与AAV6对比,AAV9与AAVH50则荧光信号较低。
综上,AAVH59的性质与AAV6相类似,同时AAVH50则展现出新的特性,两个载体转导情况差异的具体机理尚不清楚,我们推测与载体组成的AAV亲本有关,AAVH50由AAV1,AAV2,AAV3B,AAV6,AAV7,AAV8,AAV9组成,AAVH59由AAV3B,AAV6,AAV8组成。AAV1和AAV6获得的衣壳片段可能在心脏纹肌的感染性方面发挥了关键作用,而AAV7和AAV8可能通过增强内皮细胞内层的转运而改善了系统基因的传递能力[29],所以AAVH50较AAVH59有较好的传递性,而AAVH59同AAV6相似,具有较直接的感染性。
最后本研究并没有能够提高心肌的转染效率,后续可以通过使用心脏特异性启动子进行AAV载体的优化,进一步增强AAVH50与AAVH59在心肌中的基因表达,为心肌疾病的基因治疗提供帮助。

