昆仙胶囊与他克莫司治疗特发性膜性肾病疗效比较
姬 萌,马媛媛,郭醉爽,吴茜彤,孟园园,马东红,侯玉龙,尚瑞华,郭明好
(1.新乡医学院第一附属医院肾脏病医院,河南 卫辉 453100;2.郑州大学第一附属医院肾内科,河南 郑州450000;3.新乡市第一人民医院肾内科,河南 新乡 453000)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)是成人原发性肾病综合征的常见病理类型。目前普遍认为,IMN的发病机制与环境和遗传因素有关。近年来,随着IMN发病率的持续上升,IMN的治疗在我国受到广泛的关注。然而,由于种族、环境、经济、生活方式等因素的差异,至今尚未就IMN的治疗达成共识。目前IMN的治疗方案众多,包括激素、生物制剂、环磷酰胺、他克莫司及其他免疫抑制剂治疗,但对于免疫抑制剂的选择、开始免疫抑制治疗的理想时间以及可确切从免疫抑制中受益的患者群体仍然存在争议。因此,IMN的最佳治疗方案仍不确切[1-3]。雷公藤与其单体成分已被证实有抑制尿蛋白排泄的作用[4-6]。昆仙胶囊的主要有效成分昆明山海棠为卫茅科雷公藤属,其含有多种与雷公藤相同的活性成分。研究表明,昆明山海棠有较强的细胞免疫抑制作用[7-8]。目前,昆仙胶囊已被用于治疗类风湿关节炎等风湿性疾病[9]。临床观察到昆仙胶囊同样具有降尿蛋白的作用[10]。他克莫司联合激素治疗IMN是目前专家共识中最常用的方案。本研究通过对比昆仙胶囊联合糖皮质激素与他克莫司联合糖皮质激素治疗IMN的临床疗效及不良反应,探讨昆仙胶囊联合糖皮质激素治疗IMN的疗效及安全性,以期为临床治疗IMN方案的选择提供依据。
1 资料与方法
1.1 一般资料选择2019年3月至2020年1月于新乡医学院第一附属医院肾脏病医院行肾活检并确诊为初发IMN的60例患者为研究对象。病例纳入标准:(1)年龄35~70岁;(2)确诊时24 h尿蛋白>3.5 g且血肌酐<176μmmol·L-1;(3)治疗开始前6个月内未应用任何免疫抑制剂。排除标准:(1)患有糖尿病及严重心脏、肝脏疾病者;(2)对治疗药物过敏者;(3)有严重感染、恶性肿瘤、心功能不全、静脉血栓等严重并发症者;(4)妊娠及有生育要求者。将患者随机分为昆仙胶囊组和他克莫司组,每组30例。2组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会批准,所有患者在入组前签署知情同意书。

表1 2组患者一般资料比较Tab.1 Comparison of baseline data of patients between the two groups
1.2 治疗方法患者均以血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂类为基础用药,根据病情给予利尿,控制血压、血脂、血糖等治疗。昆仙胶囊组患者给予昆仙胶囊(广州白云山陈李济药厂有限公司,国药准字Z20060267),每日3次,每次0.6 g,口服,疗程为3个月(若无缓解者可延长至6个月),之后逐渐减量至每日3次、每次0.3 g,维持1 a后停药;泼尼松片(浙江仙琚制药有限公司,国药准字H14021710)0.5 mg·kg-1·d-1口服8周,逐渐减量(每2周减5 mg),减至10 mg·d-1维持6个月后缓慢减量至停药。他克莫司组患者给予他克莫司(杭州中美华东制药有限公司,国药准字H20094027)0.050~0.075 mg·kg-1·d-1,分2次空腹口服,每12 h 1次,0.5 a后减量50%维持治疗,然后缓慢减量至停药;泼尼松片用法同昆仙胶囊组。
1.3 主要试剂与仪器尿白蛋白、肌酐检测试剂盒(免疫比浊法)购自美国西门子公司;C8000全自动生物化学分析仪购自美国ARCHITECT公司,Cobas e411全自动电化学发光分析仪购自德国罗氏公司。
1.4 观察指标
1.4.1 实验室检查完成入组筛选后,记录所有患者一般资料。2组患者于治疗前抽取空腹静脉血,检测血常规、尿常规、血糖、血清白蛋白、血尿素氮、血肌酐、总胆固醇、三酰甘油、丙氨酸转氨酶、天门冬氨酸氨基转移酶、血清抗磷脂酶A2受体(phospholipase A2 receptor,PLA2R)抗体滴度等指标,留取24 h尿液检测24 h尿蛋白定量。于治疗1、3、6、12个月时,抽取2组患者空腹静脉血检测血清白蛋白,留取24 h尿液检测24 h尿蛋白定量。
1.4.2 临床效果分别于治疗1、3、6、12个月时评估2组患者的临床疗效。疗效判定标准[11]:完全缓解:尿蛋白定量<0.3 g·d-1,血清白蛋白>35 g·L-1,肾功能稳定。部分缓解:尿蛋白定量为0.3~3.5 g·d-1或下降幅度超过50%,血清白蛋白>30 g·L-1,肾功能相对较为稳定。未缓解:患者的临床症状及实验室检查未达到部分缓解。总有效率=(完全缓解例数+部分缓解例数)/总例数×100%。完全缓解率=完全缓解例数/总例数×100%。记录2组患者治疗期间的不良反应。
1.5 统计学处理应用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用非参数检验;计数资料以频数和百分率表示,采用χ2检验或Fisher确切概率法;2组患者治疗前后24 h尿蛋白及血清白蛋白水平比较采用重复测量方差分析,运用简单效应分析比较组间及组内差异;P<0.05为差异有统计学意义。
2 结果
2.1 随访情况随访期间,昆仙胶囊组有1例患者在治疗第7个月因未缓解自行停药退出,1例患者未能按要求复查实验室指标退出本研究,共28例患者完成随访;他克莫司组共30例患者完成随访。
2.2 2组患者治疗效果比较结果见表2。治疗1、3、6、12个月时,2组患者的完全缓解率比较差异均无统计学意义(χ2=1.047、0.259、0.074、0.006,P>0.05)。治疗1个月时,昆仙胶囊组患者的总有效率高于他克莫司组,差异有统计学意义(χ2=5.557,P<0.05);治疗3、6、12个月时,2组患者的总有效率比较差异无统计学意义(χ2=1.479、0.265、0.251,P>0.05)。

表2 2组患者治疗效果比较Tab.2 Comparison of efficacy of patients between the two groups
2.3 2组患者治疗前后24 h尿蛋白、血清白蛋白水平比较结果见表3。治疗前,2组患者24 h尿蛋白、血清白蛋白水平比较差异无统计学意义(P>0.05)。昆仙胶囊组患者治疗1、3、6、12个月时的24 h尿蛋白水平均低于治疗前,差异有统计学意义(P<0.05);治疗12个月时,昆仙胶囊组患者24 h尿蛋白水平低于治疗1个月,差异有统计学意义(P<0.05);组内其余不同时间点24 h尿蛋白水平两两比较差异均无统计学意义(P>0.05)。他克莫司组患者治疗6、12个月时的24 h尿蛋白水平显著低于治疗前及治疗1、3个月时,差异有统计学意义(P<0.05);组内其余不同时间点24 h尿蛋白水平两两比较差异均无统计学意义(P>0.05)。治疗1、3个月时,他克莫司组患者24 h尿蛋白水平高于昆仙胶囊组,差异有统计学意义(P<0.05);治疗6、12个月时,2组患者的24 h尿蛋白水平比较差异无统计学意义(P>0.05)。
表3 2组患者不同时间点24 h尿蛋白、血清白蛋白水平比较Tab.3 Comparison of 24-hour urine protein and serum albumin levels of patients in different treatment time between the two groups(±s)
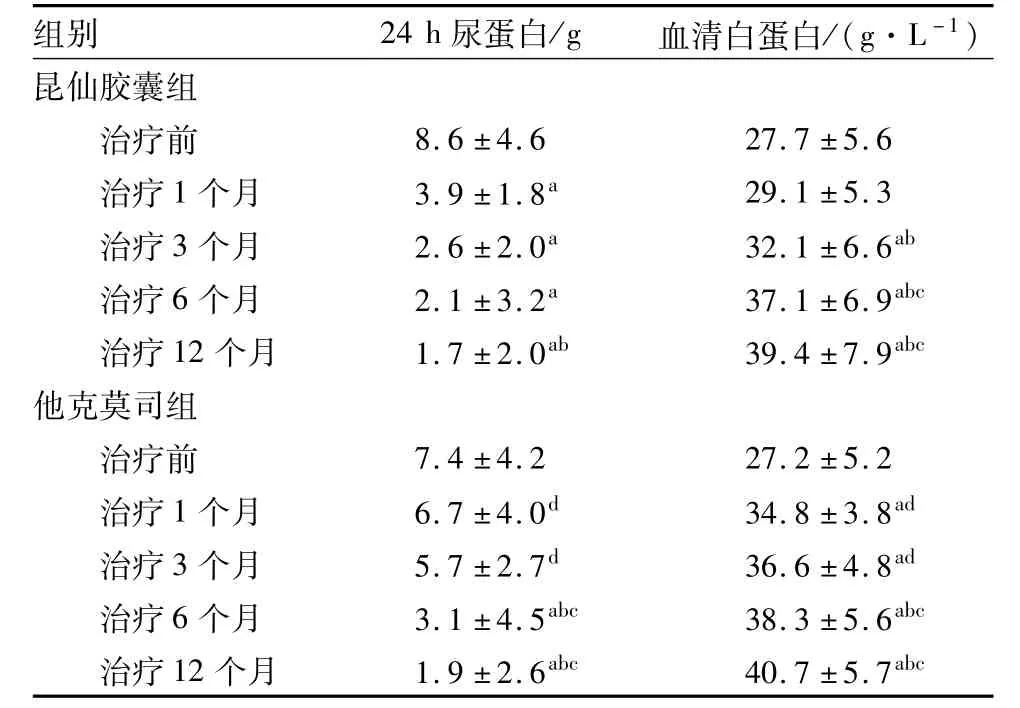
表3 2组患者不同时间点24 h尿蛋白、血清白蛋白水平比较Tab.3 Comparison of 24-hour urine protein and serum albumin levels of patients in different treatment time between the two groups(±s)
注:与治疗前比较a P<0.05;与治疗1个月时比较b P<0.05;与治疗3个月时比较c P<0.05;与昆仙胶囊组同时间点比较d P<0.05。
组别24 h尿蛋白/g血清白蛋白/(g·L-1)昆仙胶囊组治疗前8.6±4.6 27.7±5.6治疗1个月3.9±1.8a 29.1±5.3治疗3个月2.6±2.0a 32.1±6.6ab治疗6个月2.1±3.2a 37.1±6.9abc治疗12个月1.7±2.0ab 39.4±7.9abc他克莫司组治疗前7.4±4.2 27.2±5.2治疗1个月6.7±4.0d 34.8±3.8ad治疗3个月5.7±2.7d 36.6±4.8ad治疗6个月3.1±4.5abc 38.3±5.6abc治疗12个月1.9±2.6abc 40.7±5.7 abc
治疗3、6、12个月时,昆仙胶囊组患者的血清白蛋白水平高于治疗前及治疗1个月时,差异有统计学意义(P<0.05);治疗6、12个月时,昆仙胶囊组患者血清白蛋白水平均高于治疗3个月时,差异有统计学意义(P<0.05);其余组内不同时间点血清白蛋白水平两两比较差异均无统计学意义(P>0.05)。治疗1、3、6、12个月时,他克莫司组患者的血清白蛋白水平均高于治疗前,差异有统计学意义(P<0.05);治疗6、12个月时,他克莫司组患者血清白蛋白水平均高于治疗1、3个月时,差异有统计学意义(P<0.05);组内其余不同时间点血清白蛋白水平两两比较差异均无统计学意义(P>0.05)。治疗1、3个月时,他克莫司组患者血清白蛋白水平高于昆仙胶囊组,差异有统计学意义(P<0.05);治疗6、12个月时,2组患者的血清白蛋白水平比较差异无统计学意义(P>0.05)。
2.4 2组患者不良反应比较昆仙胶囊组育龄期女性月经紊乱4例,治疗结束后月经逐渐恢复正常;胃肠道反应1例,经对症治疗后缓解;丙氨酸转氨酶升高1例,经保肝治疗于1周内恢复正常;不良反应发生率为21.4%(6/28)。他克莫司组患者出现胃肠道反应3例,经对症治疗后症状均缓解;丙氨酸转氨酶、天门冬氨酸氨基转移酶升高2例,经保肝治疗于1周内恢复正常;糖代谢异常3例,给予药物控制后血糖恢复正常;肺部感染2例,泌尿系感染1例,经抗感染治疗后好转;静脉血栓1例,给予对症治疗后好转;新发高血压2例,给予药物控制后血压恢复正常;不良反应发生率为46.7%(14/30)。昆仙胶囊组患者的不良反应发生率低于他克莫司组,差异有统计学意义(χ2=4.083,P<0.05)。
3 讨论
IMN为慢性肾脏病中的常见病、多发病,其发病率近年来逐渐升高。改善全球肾脏病预后组织指南建议,IMN治疗时不宜单独使用糖皮质激素,需合用免疫抑制剂,大多数IMN患者存在针对不同肾小球抗原的自身抗体,如PLA2R1抗体、具有抗凝血酶反应蛋白1型结构域7A的自身抗体[12-13]。有学者在PLA2R1阴性的膜性肾病患者亚群中发现了针对Exostosin 1/Exostosin 2和神经表皮生长因子样蛋白的新抗原[14-15]。各种抗原的存在进一步印证了该疾病的自身免疫性。他克莫司有足细胞保护作用,可稳定细胞骨架,抑制T细胞活化,从而有效降低蛋白尿,他克莫司联合糖皮质激素现已作为临床上治疗IMN常用的经典方案之一。
昆仙胶囊问世以来,因其具有较好的免疫抑制和抗炎作用,被广泛应用于类风湿关节炎、系统性红斑狼疮等多种自身免疫性疾病的治疗。近年来,该药在肾脏疾病领域多有应用,并已初步获得良好的疗效。单独应用或在原有治疗基础上加用昆仙胶囊在降低肾脏病相关蛋白尿方面均有良好效果,且对难治性肾病综合征蛋白尿亦有效。临床研究发现,昆仙胶囊在肾病综合征治疗中疗效确切,可显著促进肾功能恢复,降低机体炎症介质干扰素-γ、白细胞介素-21水平[16]。既往文献报道,昆仙胶囊可有效降低蛋白尿,对不同病理类型的慢性肾脏病均有效,对膜性肾病疗效最佳[17]。有研究显示,昆仙胶囊对肝、肾的损害明显低于雷公藤,且对肝脏及性腺的影响是可逆的[7]。
本研究将昆仙胶囊联合糖皮质激素与经典方案他克莫司联合糖皮质激素进行对比,结果显示,治疗1个月时,昆仙胶囊组患者的总有效率显著高于他克莫司组,而治疗3、6和12个月时,2组患者总有效率比较差异均无统计学意义;在治疗的不同时期,2组患者完全缓解率比较差异均无统计学意义;2组患者在随访过程中24 h尿蛋白定量均较治疗前降低,治疗1、3个月时,昆仙胶囊组患者24 h尿蛋白定量显著低于他克莫司组,而在治疗6、12个月时,2组患者的24 h尿蛋白水平比较差异无统计学意义;经治疗2组患者的血清白蛋白水平均升高,治疗1、3个月时,他克莫司组患者血清白蛋白水平高于昆仙胶囊组,2组患者治疗6、12个月时血清白蛋白水平比较差异无统计学意义。以上结果说明,昆仙胶囊联合泼尼松可有效降低IMN患者的蛋白尿,提高血清白蛋白水平,与他克莫司方案疗效相当,且起效较快。在治疗早期,他克莫司组患者血清白蛋白水平明显升高,可能的原因是他克莫司有免疫抑制之外的肝脏保护作用,可促进肝脏合成血清白蛋白[18];由于昆仙胶囊的肝脏毒性,该组患者血清白蛋白水平的升高较他克莫司组缓慢;因此,严重低蛋白血症患者使用昆仙胶囊时应予以重视。本研究中大部分患者对治疗耐受性良好,昆仙胶囊组的主要不良事件是育龄期女性月经紊乱,停药后月经恢复正常,因此,对于育龄期女性使用昆仙胶囊时应注意疗程不宜过长。他克莫司组不良反应有胃肠道反应、转氨酶升高、糖代谢异常、感染等。使用昆仙胶囊联合糖皮质激素方案的不良反应发生率显著低于他克莫司联合糖皮质激素方案。昆仙胶囊作为一种新型的中药复方制剂,在治疗IMN时,能有效降低蛋白尿。
综上所述,昆仙胶囊联合糖皮质激素治疗IMN的疗效与他克莫司方案相当,且具有起效更快、安全性高、不良反应相对较少等优点。该方案对IMN远期预后的影响仍需要大样本、长期随访的随机对照研究证实。

